人脑胶质瘤细胞来源外泌体的提取鉴定及微环境中的摄取
2021-05-27龙妮娅出良钊董明昊肖祖沐
高 远 龙妮娅 出良钊 刘 健 董明昊 肖祖沐
1)贵州医科大学外科学教研室,贵州 贵阳 550004 2)贵州医科大学附属医院,贵州 贵阳 550004 3)贵州医科大学分子生物学重点实验室,贵州 贵阳 550004 4)贵州省人民医院,贵州 贵阳 550004
胶质瘤约占中枢神经系统原发性恶性肿瘤的80%[1],基本上是无法治愈的[2]。外泌体在神经胶质瘤的诊断和治疗中逐渐引起众多学者的关注。外泌体参与神经胶质瘤的病理过程,通过作用于神经胶质瘤细胞及其周围基质细胞的代谢,促进癌症的进展、血管生成、转移、耐药性和免疫抑制。
外泌体的平均直径约为100 nm,由双脂层组成[3]。这种外泌体载体是高度可变的,取决于细胞类型的来源、细胞状态和其微环境[4]。外泌体可由细胞分泌释放到细胞外液的微环境中,从免疫细胞到肿瘤细胞[5]。外泌体通过不同的途径将信息传递给受体细胞:(1)外泌体膜上的蛋白直接与受体细胞膜上的蛋白接触,触发细胞内信号级联;(2)外泌体胞膜与受体细胞胞膜融合,释放其内容物进入受体细胞;(3)靶向细胞直接吞噬外泌体并将其内化为组成部分[6]。肿瘤的微环境是一个复杂的生态体系,是肿瘤起始和进展各个阶段的积极参与者。越来越多的证据表明外泌体易从大多数体液中获取,包括血液、唾液、尿液、腹水和脑脊液,可作为肿瘤液体活检具有前途的标志物[7]。
近年来,肿瘤微环境作为预后因素或治疗靶点受到广泛关注。通过外泌体的释放,肿瘤微环境通过转移生物活性分子如microRNA 促进肿瘤的进展。然而越来越多的证据表明,癌症的进展不仅是由基因改变驱动的,而且由肿瘤细胞和周围微环境共同建立。在胶质瘤中,肿瘤微环境由非肿瘤细胞组成,如内皮细胞、肿瘤相关巨噬细胞、小胶质细胞、星形胶质细胞、细胞外基质成分、蛋白质和分泌因子等,均参与肿瘤细胞间通讯,从而调节疾病的进展。癌细胞与肿瘤微环境之间强大交叉作用的重要参与者是外泌体。在胶质母细胞瘤中,肿瘤细胞释放的外泌体,包括mRNA、miRNA 和血管生成蛋白,能够作用于内皮细胞,促进肿瘤在微环境中的发展。外泌体miRNA 通过调节多种信号通路与神经胶质瘤发生相关。肿瘤细胞与肿瘤微环境之间的双向互导通过促进肿瘤细胞增殖、侵袭和血管生成,促进肿瘤的发展和进展。在肿瘤微环境中能量代谢的重编程以及抑制细胞死亡和免疫反应都是众所周知的癌症特征。已有研究表明肿瘤微环境可以预测预后,被认为是一个有趣的治疗靶点。研究表明,除了改变肿瘤微环境外,阻断与肿瘤细胞双向互通或重建能够抑制肿瘤生长的微环境逆转其表型可能是有用的。
因此,进行人脑胶质瘤细胞培养上清液来源的外泌体的提取、鉴定及观察胶质瘤细胞摄取外泌体,为后续外泌体在肿瘤机制的研究提供实验基础。
1 材料与方法
1.1 材料人脑胶质瘤细胞U251 细胞系购于中科院上海细胞库,DMEM 高糖培养基(美国Gibco 公司),无外泌体胎牛血清(美国BD 公司),0.25%胰蛋白酶(美国BI 公司)。BCA 蛋白测定试剂盒(碧云天生物公司),蛋白快速裂解液和5×SDS-PAGE蛋白上样缓冲液(上海碧云天生物技术有限公司),CD63(一抗)(英国Abcam)、TSG101(一抗)(英国Abcam)、辣根酶标记山羊抗小鼠IgG(二抗)(英国Abcam),化学发光显影液(美国BI 公司)。外泌体荧光染色液PKH67 Green Fluorescent Cell Linker Kit(美国Sigma公司)。低温智能超速离心机(Hitachi,日本),透射电子显微镜(美国FEI公司TECNAI G2),马尔文粒度分析仪(英国马尔文Nanosight NS300 仪),共聚焦显微镜(日本Olympus)。
1.2 方法
1.2.1 细胞培养:细胞培养及细胞培养上清液外泌体的收集将冻存的第5代U251细胞以含有10%无外泌体血清、100 U/mL青霉素的高糖型DMEM培养基,在37 ℃、5% CO2、饱和湿度环境下的细胞培养箱内培养。无外泌体血清培养72 h后,收集培养上清液,将120 mL培养基分装于3个离心管中。
1.2.2 外泌体的提取:将收集到的培养基分装于超速离心机专用的离心管中,4 ℃、300 g 离心10 min 后肉眼可见沉淀为细胞及细胞碎片(弃沉淀),吸取上清液于新的离心管中,4 ℃、2 000 g 离心10 min 后肉眼可见沉淀为死细胞及未除去的细胞碎片(弃沉淀),吸取上清液于新的离心管中,4 ℃、10 000 g 离心30 min,肉眼可见离心管底部有稍许白色沉淀为细胞器等微小颗粒(弃沉淀),吸取上清液用0.22 μm 滤膜过滤除去>200 nm 的颗粒,最后将过滤后的液体4 ℃、100 000 g 离心70 min 离心结束后得到的沉淀为外泌体及其蛋白质,再次重复上一步骤,离心结束后得到的沉淀即为分离纯化的外泌体。离心结束后,小心吸尽沉淀上方液体,用100 μL PBS(pH=7.4)缓冲液重悬后储存于 80 ℃冰箱待用。具体外泌体提取流程图见图1。

图1 外泌体提取流程图Figure 1 The purification procedure of exosomes
1.2.3 外泌体的鉴定
1.2.3.1 透射电子显微镜观察外泌体形态及大小:将超速离心法提取的外泌体用50 μL 2%多聚甲醛重悬,吸取10 μL 外泌体悬液滴加于铜网上,室温静置5 min。PBS 漂洗3 次,5 min/次。1%戊二醛固定5 min,双蒸水漂洗2 min,4%醋酸双氧铀负染5 min,滤纸吸去残液,室温晾干,透射电镜下观察形态并拍照。1.2.3.2 马尔文粒度分析仪检测外泌体大小:首次进行外泌体测试前,用纯水通过针筒注射器打入样品池进行冲洗工作。冲洗完毕后,对外泌体进行适当稀释,然后将初步稀释后的外泌体用1 mL注射器打入样品池中,将整个样品池推入主机内,出现纳米颗粒布朗运动的实时图像,待机器自动读数,即可出报告图。
1.2.3.3 Western blotting 实验检测外泌体表面特异性分子标志:Western blotting法检测外泌体内源性蛋白表达水平:在37 ℃水浴中速溶冻存的外泌体,取100 μL 并迅速加入6×的RIPA 裂解液,混匀后在冰上裂解30 min 后收集于离心管中12 000 r/min 离心20 min。配制BCA测蛋白浓度的标准样品,并取5 μL样品加入到BCA混合液中混匀。将提取的蛋白上清与5×蛋白上样缓冲液体积比按照4∶1混合,置100 ℃沸水浴中加热10 min。于根据目的蛋白的大小配置浓度10%或15%的SDS-PAGE 电泳胶中进行电泳,结束后将蛋白转印至PVDF膜上,10%封闭液进行封闭,加入CD63(1∶500)及TSG101(1∶1 000)单克隆抗体,4 ℃摇床孵育过夜,TBST 室温下洗膜3 次,10 min/次,之后加入二抗标记(1∶4 000),在摇床上室温孵育2 h,TBST在室温下洗膜10 min,重复3次。ECL化学发光显色,用Odyssey 荧光扫描系统检测PVDF膜的荧光。
1.3 荧光共聚焦显微镜观察胶质瘤细胞摄取外泌体
1.3.1 外泌体染色:将重悬的外泌体加入1 mL DiluentC 液中,同时将4 μL PKH67 染色液加入1 mL DiluentC 液中,染色10 min。染色结束后再次移入高速离心管中,4 ℃离心,100 000 g × 70 min,用100 μL PBS磷酸盐缓冲液将外泌体沉淀重悬即可用于后续实验。
1.3.2 荧光共聚焦显微镜观测:将50 μL PKH67 染色的外泌体重悬液加入无外泌体10% FBS的DMEM培养基中混匀后与U251细胞共孵育24 h。使用PBS磷酸盐缓冲液冲洗2次,5 min/次。加入4%的多聚甲醛固定5~10 min 后,用PBS 磷酸盐缓冲液冲洗3 遍,5 min/次。染色完毕后,吸净液体。加入1 滴(20 ~50 μL)抗荧光衰减的封闭液,尽量减少气泡。随后荧光共聚焦显微镜观察样品。
2 结果
2.1 人脑胶质瘤U251细胞生长状况以无外泌体血清培养基培养U251细胞48 h,细胞贴壁生长紧密,细胞形态呈梭形、圆形、条形等多形态同时出现(图2)。

图2 胶质瘤U251细胞形态(×100)Figure 2 The morphology of glioma U251 cells(×100)
2.2 人脑胶质瘤U251 细胞外泌体形态及大小通过超速离心法得到U251细胞培养上清中的物质,在透射电子显微镜下可见直径30 ~150 nm、外形呈典型的杯状和双凹圆盘的扁平球囊体,圆形茶托样囊泡具有完整的膜结构,均质且具有脂质双层膜结构圆形或椭圆形的囊泡状结构的小体,内部含有低电子密度的物质(图3)。囊泡膜结构清晰可见,符合外泌体的电镜下特征。
2.3 囊泡的大小U251 细胞来源的外泌体粒径大小通过马尔文粒度分析仪测量,粒径为54.5 ~255.5 nm,平均143.1 nm,粒径主峰为148 nm(图4)。
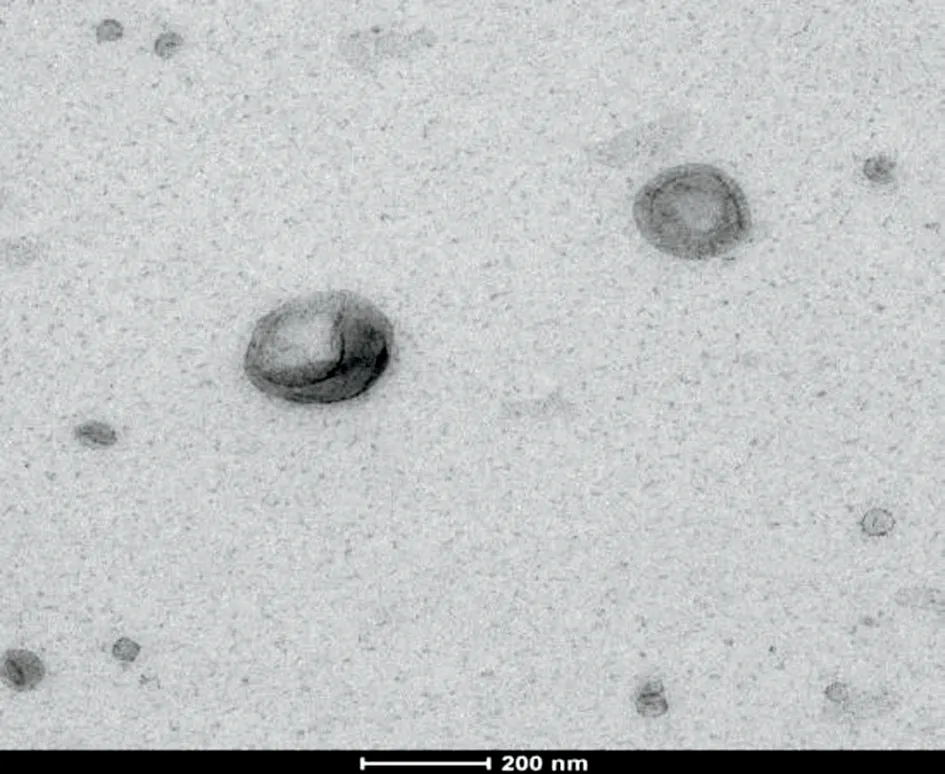
图3 U251细胞来源的外泌体在电镜下的形态Figure 3 Morphology of exosomes from U251 cells under electron microscope
2.4 胶质瘤U251 细胞外泌体标志蛋白鉴定Western blotting 结果验证了外泌体特异性标志蛋白的表达,可见CD63、TSG101表达呈阳性,进一步证实提取的微囊泡是外泌体(图5)。
2.5 荧光共聚焦显微镜观察胶质瘤U251 细胞摄取外泌体共聚焦显微镜发现荧光标记的外泌体加入到U251 细胞24 h 以后均能进入细胞内,说明U251细胞能有效摄取外泌体,并能清楚观察到外泌体集中分布于细胞质中(图6)。

图4 外泌体粒径检测Figure 4 Particle size identification of exosomes
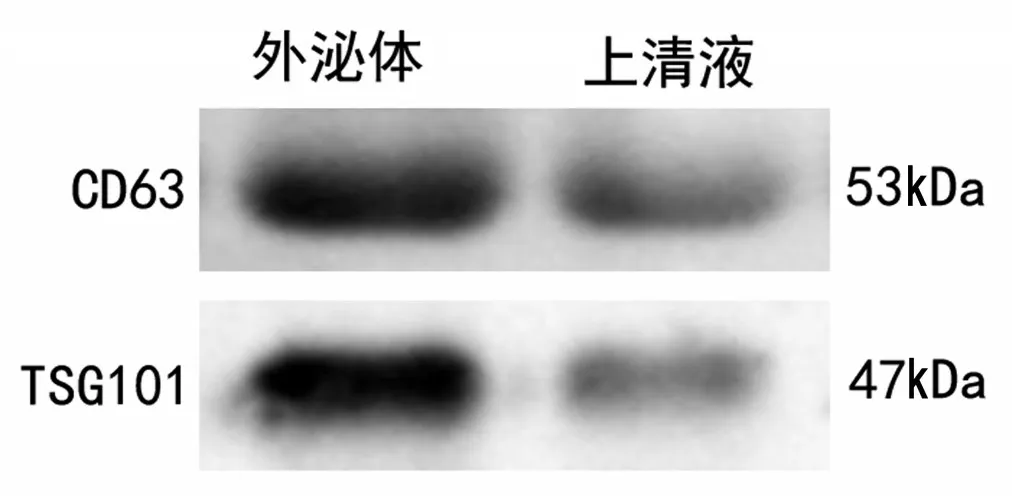
图5 胶质瘤U251细胞上清液及外泌体标志蛋白表达Figure 5 The expression levels of exosomal protein markers in supernatants derived culture media and exosomes

图6 胶质瘤细胞摄取荧光标记的外泌体Figure 6 Fluorescently labeled U251 exosomes were uptaken by glioma cells
3 讨论
外泌体与微泡和凋亡小体不同[8-9]。外泌体的直径30 ~150 nm,在透射电镜下呈杯状。外泌体可以介导细胞间通讯,经过配体受体相互作用传递信息[8]。外泌体是液体活检中很有前途的生物标志物(蛋白质和核酸),包含多种生物标志物,代表肿瘤的异质性[10]。外泌体可以通过血脑屏障,成为细胞间通讯的桥梁。研究表明,胶质瘤衍生的特异性外泌体作为胶质瘤早期诊断的非侵入性候选标志物具有巨大的潜力。
外泌体的分离和纯化方法包括超速离心法、超滤法、尺寸排斥色谱法和基于微孔板的磁免疫捕获法[11-12],目前,超速离心法是分离提纯外泌体的主要技术。虽然没有统一的鉴定标准,但超速离心法在不同的研究中被证明是有效的[13]。外泌体的检测可通过纳米颗粒示踪分析(NTA)和透射电子显微镜(TEM)实现;此外,可通过相关蛋白(TSG101 和Alix)、四跨膜蛋白(CD81、CD63和CD9)、细胞质蛋白(Hsp90和Hsp70)、整合素和膜联蛋白等外泌体的特异性标志蛋白区分。
越来越多的证据表明,神经胶质瘤细胞主动向周围微环境释放外泌体,这些外泌体具有多向性能力,通过重新编程癌细胞及其周围基质细胞的代谢,促进癌症快速进展、血管生成、转移、耐药性和免疫抑制[7]。外泌体参与从癌细胞到其他癌细胞的信号传递,以及传播细胞生长、转化和存活信号。在胶质母细胞瘤中,外泌体可以转移EGFRvⅢ蛋白,帮助野生型细胞的转化,通过自我促进的方式刺激人脑胶质瘤细胞的增殖[14]。MA等[15]研究表明,神经胶质瘤细胞中的糖代谢,促进了糖酵解,导致其向肿瘤样表型转化。来自缺氧的胶质母细胞瘤细胞分泌的外泌体易于诱导血管的生成[16]。在胶质瘤中,来自恶性细胞的外泌体已被证明通过在不同癌细胞亚群之间或癌细胞与周围基质细胞之间转移致癌和免疫调节蛋白和核酸,促进肿瘤进展[17]。有趣的是,正常乳腺上皮细胞分泌的外泌体抑制乳腺癌细胞的外泌体分泌,意味着一种反馈控制维持动态平衡[18]。已有研究证实,PTRF 不仅在胶质瘤组织中,而且在血清外泌体中都可作为诊断性生物标志物。PTRF/CD63比值可预测外泌体分泌,表明其对胶质瘤的诊断、预后和手术效果具有良好的判定能力。更重要的是,根据血清外泌体中的PTRF水平诊断胶质瘤是微创的,因只需要抽血[19]。
无创诊断是胶质瘤患者的迫切需求,外泌体将是癌症诊断和靶向治疗中一种较为理想的生物标志物,因其紧密代表了它们亲代细胞的状态,在循环中相对稳定,可以很容易地从体液中收集。外泌体内容物作为诊断和预后生物标志物的潜力已经在各种癌症中进行了研究[20]。需要开发出更快、更便捷的方法验证从人类癌症患者标本中提取的外泌体作为生物标志物。利用纳米技术将小分子或用于癌症治疗的药物装入外泌体也得到开发[17]。从合适的供体细胞获得大量外泌体的新策略的改进,有效地将治疗药物引入外泌体,以及优化外泌体靶向输送到特定组织,将促进外泌体作为天然载体在临床治疗中的使用。本实验成功从人脑胶质瘤细胞系U251 培养上清液中提取外泌体并鉴定,通过运用激光共聚焦显微镜可以清楚观察到U251 细胞成功摄取了U251细胞分泌的外泌体。
通过本实验成功分离提纯出胶质瘤细胞中的外泌体,并观察到外泌体在微环境中的形态及分布,其集中分布于细胞质中,为外泌体的研究提供进一步参考。
