慢性糖尿病性肾损伤对AD 小鼠脑内海马区淀粉样斑块的影响
2021-05-27郑娜刘希
郑 娜 刘 希
1)郑州市第三人民医院,河南 郑州450099 2)郑州大学第一附属医院,河南 郑州450052
Alzheimer病(Alzheimer’s disease,AD)为最常见的痴呆类型,目前尚无有效的治疗手段。该病起病隐匿,以记忆、认知功能进展性下降,伴思维、语言、计划能力的降低及精神行为异常,最终完全失去生活自理能力为临床特点[1-3]。脑内淀粉样蛋白斑块沉积、神经纤维缠结、神经元及其突触结构丧失是AD的三大病理特征[4-5]。具有神经毒性的Aβ 蛋白过量产生并在细胞外沉积形成淀粉样斑块,是AD独有的病理特点[6-7],尽管AD发病原因可能多种多样,但最终都会导致Aβ淀粉样斑块在脑内大量沉积,并引起下游反应,造成神经元不断凋亡,降低Aβ的水平成为预防和治疗AD的有效途径[8]。
糖尿病性肾病(diabetic nephropathy,DN)是终末期肾病的最常见原因,随着肥胖及老龄化的不断进展,DN的发生率逐年提高。传统上T2DM和AD被视为独立的两个疾病,但通过对T2DM 和AD 的广泛深入研究,发现二者在流行病学关联和一些常见的病理生理机制的相通之处。AD 患者常伴2 型糖尿病,与普通人群相比,T2DM 病人患AD 的风险增加50%~150%[8]。除典型的三大病理特征以外,中枢神经细胞胰岛素抵抗为AD主要病理特点之一,基础研究还发现胰岛素抵抗或胰岛素缺失均可促进Aβ蛋白沉积和τ 蛋白磷酸化,因此AD 被主流学界认为是中枢神经系统内的糖尿病(T3 DM或pre-T2DM)[9-11]。目前DM 与AD 的关系已成为临床和基础研究的热点,事实上AD患者合并糖尿病性肾损伤在临床中很常见,但糖尿病性肾损伤对AD 认知功能的影响无论基础研究和临床研究目前均非常缺乏。
为发现糖尿所致慢性肾损伤对AD 的影响并探究其可能潜在的机制,本研究在动物水平探索DN合并AD对认知功能的影响。通过在AD双转基因动物模型APP/PS1E9Δ基础上通过链脲佐菌素及单侧肾切除构建的慢性糖尿病性肾损伤动模型,发现慢性糖尿病性肾损伤可增加脑内Aβ 蛋白的表达,加重AD小鼠脑内海马区淀粉样斑块的沉积,同时发现DN小鼠脑内活化的小胶质细胞密度增加,推测可能通过增加胶质细胞的不当过度活化导致斑块沉积。本研究发现糖尿所致慢性肾损伤可加重AD的病理改变,积极治疗DN 可减轻AD 合并DN 患者认知功能下降的进展,为临床治疗提供证据。
1 资料与方法
1.1 实验动物及分组APP/PS1 dE9 双转基因小鼠(背景C57BL/6J)购于北京澄天生物(iBio Logistics),货号:34832-JAX。所有用于实验的小鼠均通过PCR法基因检测确认APP/PS1dE9 双转基因。样本量估计基于前期预实验结果及样本量总估算公式,8 只/组,可实现至少80%的检验效能(α=0.05,双侧)。小鼠接受处理后死亡的样本排除在样本总量内。24只雄性3 月龄APP/PS1 小鼠(体质量25 ~33 g)采用抽签法随机平均分为溶剂+假手术组、链脲佐菌素诱导Ⅱ型糖尿病+假手术组、单侧肾切除+链脲佐菌素糖尿病性肾病组。饲养于每天12 h 日照/黑暗转换的无菌SFP动物房环境内。
1.2 侧肾切除+链脲佐菌素糖尿病性肾病模型建立及肾功能检测按照TESCH等[12]关于糖尿病性肾病模型构建的描述,切除小鼠的右侧肾脏。2周后经腹腔注射35 mg/(kg·d)体质量链脲佐菌素(STZ)连续5 d,在整个实验过程中,小鼠的血糖一直处于稳定、中度的高血糖状态。小鼠24 h的蛋白尿4周即显著性升高,且随着时间的延续呈进行性升高的趋势。切除右侧肾4 周后对小鼠血糖及肾功能指标进行检测。各组在接受处理60 d 后进行血糖及肾功能检测,采用罗氏血糖仪检测禁食后12 h每天08:00血糖,血浆尿素氮采用比色检验试剂盒(Invitrogen™EIABUN)采用酶标仪在450 nm 读取吸光度,根据标准曲线计算血浆尿素氮水平,血清肌酐采用PRP-X200阳离子交换柱(Hanmilton,Agilent 1100)的高压液相色谱(HPLC)系统检测。
1.3 免疫荧光检测脑内海马区淀粉样斑块小鼠脑组织经冰的PBS 灌注后置于4%多聚甲醛溶液中固定24 h,经30%蔗糖溶液梯度脱水后OCT 包埋。Thermo Scientific冰冻切片机沿矢状面连续切出10 μm厚度的脑片,经PBST 破膜处理,10%驴血清室温孵育30 min封闭非特异性抗原。与待检蛋白相应的一抗4 ℃过夜孵育后,AlexaFlour 488 或AlexaFlour 594(Invitrogen,USA)偶联的二抗4 ℃2 h孵育,细胞核由含有DAPI 的防光猝灭剂染色。β 淀粉斑块由鼠抗Aβ 单克隆抗体(6E10,Biolegend,USA)检测,BACE2由羊抗兔FLAG多克隆抗体(Sigma-Aldrich)检测;二抗采用AlexaFlour 488 偶联的驴抗鼠抗体和AlexaFlour 594 偶联的驴抗羊抗体检测相应的一抗。Nikon i9 荧光显微镜对染色后的脑片进行观察拍照。在海马区域随机每隔100 μm取脑片一张用于统计计数,每只小鼠共取5张。在分析各组小鼠β淀粉样蛋白载量时,定义淀粉样蛋白直径>20 μm的β淀粉斑块纳入统计范围,采用image J(NIH)软件对β淀粉样蛋白载量进行数量分析,计算每视野中β淀粉斑块面积占视野总面积额的百分比为斑块载量。
1.4 ELISA 检测脑内Aβ40和Aβ42根据制造商提供的ELISA 试剂盒说明,使用β-淀粉样蛋白比色法的ELISA 试剂盒(购于Invitrogen)测量Aβ1-42(货号KHB3441)和Aβ1-40(货号KHB3481)的浓度。称小鼠半脑质量并在10 倍过量的5 mol/L 胍缓冲液(pH 8.0)中匀浆。将匀浆在室温下轻轻摇动4 h,并通过30 000 g 高速离心10 min。将离心后的上清液以50 倍浓度加纯水稀释,将胍浓度降低至0.1 mol/L,然后再应用于ELISA。在Biotek EPOCH2酶标仪上读出读数并绘制出标准曲线,根据标准曲线计算出浓度。
1.5 统计学方法采用Graphpad Prism 6统计软件对所有数据进行统计分析。所有结果均以均数±标准差(±s)表示。不同组别不同样本比较采用one-way ANOVA,采用Kruskal-Wallis非参数检验,事后分析采用Dunn’s多重比较检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同组小鼠的空腹血糖、血尿素氮、血肌酐水平对各组在接受处理60 d 后进行血糖及血尿素氮、血肌酐等肾功能指标检测。见表1。
2.2 糖尿病肾损伤加重AD小鼠脑内海马区淀粉样斑块沉积淀粉样斑块在海马区域沉积是引起AD记忆障碍的主要原因。为验证糖尿所致慢性肾损伤是否对AD 动物脑内斑块的作用,选择Aβ 特异的单克隆抗体6E10 对接受不同处理的小鼠脑冰冻切片进行免疫荧光染色。较传统的苏丹红和Thioflavin-S染色,6E10 单克隆抗体对淀粉样斑块有较高的敏感性和特异性,使非特异性染色大大降低(图1A)。结果显示接受单侧肾切除+链脲佐菌素糖尿病性肾病组的APP/PS1 小鼠海马区域β 淀粉样板块数量显著低于接受溶剂+假手术组、链脲佐菌素诱导Ⅱ型糖尿病+假手术组(P<0.05),而接受溶剂+假手术组和链脲佐菌素诱导Ⅱ型糖尿病+假手术组差异无统计学意义(P>0.05,图1B)。
2.3 糖尿病肾损伤增加AD小鼠脑内Aβ40和Aβ42的表达AD 小鼠脑内Aβ40、Aβ42为淀粉样蛋白前体蛋白(APP)剪切后的产物,Aβ 的量可反映出APP 经β剪切的产物的情况。其中Aβ42为最具有细胞毒性的剪切产物,因此,脑内Aβ蛋白的量可发映AD脑内损伤的严重程度。结果显示,单侧肾切除+链脲佐菌素糖尿病性肾病组AD 小鼠脑内Aβ40、Aβ42蛋白含量均显著高于溶剂+假手术组、链脲佐菌素诱导Ⅱ型糖尿病+假手术组(P<0.01),而接受溶剂+假手术组和链脲佐菌素诱导Ⅱ型糖尿病+假手术组差异无统计学意义(P>0.05,图2)。
2.4 糖尿病肾损伤促进AD 小鼠脑内小胶质细胞活化AD 脑内的胶质细胞活化状况与脑内淀粉样斑块的吞噬作用存在相关性,其中小胶质细胞过度反应是AD 严重程度的一个重要指标。采用面荧光法对接受不同处理的AD 小鼠脑内海马区域的Iba-1+的小胶质细胞进行计数,结果发现单位面积内单侧肾切除+链脲佐菌素糖尿病性肾病组AD小鼠海马区域内的Iba-1+细胞数量均显著高于溶剂+假手术组、链脲佐菌素诱导Ⅱ型糖尿病+假手术组(P<0.01),而接受脲佐菌素诱导Ⅱ型糖尿病+假手术组也显著高于溶剂+假手术组(P<0.05)。见图3。
表1 不同组别血糖及肾功能指标 (±s)Table 1 Comparison of blood glucose and renal function indexes in different groups (±s)

表1 不同组别血糖及肾功能指标 (±s)Table 1 Comparison of blood glucose and renal function indexes in different groups (±s)
注:与 溶剂+假手术组比较,#P<0.05;与溶剂+假手术组比较,*P<0.05,***P<0.001
组别溶剂+假手术组T2DM+假手术组T2DM+右肾切除组F组间(P)n888血糖(mmol/L)5.2±0.60 13.16±1.60#14.78±1.81*3.78(0.04)血尿素氮(mmol/L)12.26±1.24 14.18±1.71n.S.21.71±1.69***1.11(0.35)血肌酐(μmol/L)16.49±1.9 18.03±1.53n.S.27.25±3.00*1.38(0.27)

图1 不同组别AD小鼠脑内海马区淀粉样斑块情况Figure 1 Amyloid plaques in the hippocampus of AD mice in different groups

图2 同组别Aβ40与Aβ42蛋白表达情况Figure 2 Protein expression of Aβ40 and Aβ42 in the same group
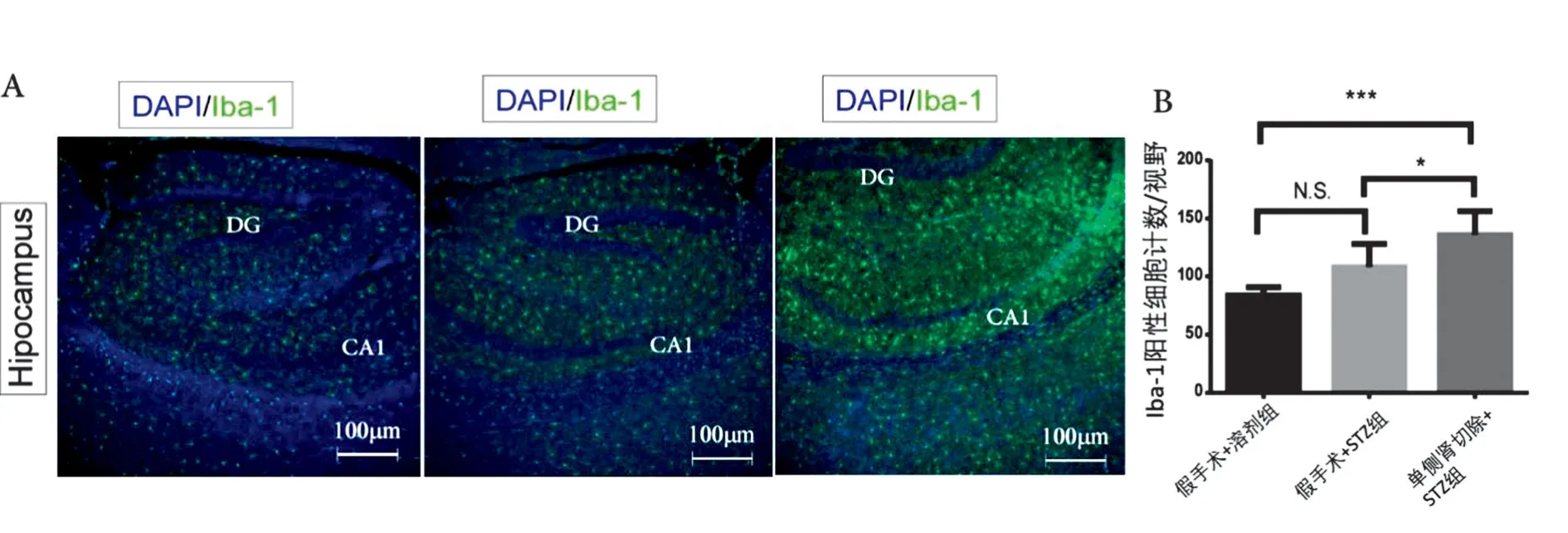
图3 不同组别AD小鼠脑内海马区小胶质细胞活化情况Figure 3 The activation of microglia in the hippocampus of AD mice in different groups
3 讨论
随着人口老龄化的发展,糖尿病和AD的发病率逐年提高,而糖尿病是引起终末期肾病最常见的原因,AD合并糖尿病肾病在临床上并不少见,而且越来越多的证据证明AD 和糖尿病有很多共同之处[13]。中枢神经内神经元上的胰岛素受体下调导致的胰岛素抵抗可能是AD发病的分子机制之一[14-15],此外,在AD分子机制中起关键作用的β位点剪切酶2同样在胰腺β细胞内的异常剪切会导致胰岛素分泌不足[16],部分抗糖尿病药物甚至可以应用在AD的治疗上[17]。
慢性糖尿病血糖控制不佳最终会发展成为终末期肾病。基础研究发现,Toll-like receptor4(TLR4)信号通路调控异常[18]及中枢神经系统内RAS系统激活是糖尿病性肾病和AD 的共同机制[19]。本课题在AD基因背景下采用广泛认可的方法构建糖尿病性慢性肾损伤模型,模拟临床中AD 合并糖尿病肾损伤,观察糖尿病肾病对AD小鼠脑内淀粉样斑块及Aβ蛋白表达的影响,发现糖尿病肾损伤促进AD小鼠脑内细胞过度活化,这可能是导致AD小鼠脑内淀粉样斑块增高的原因之一。
有报道指出,脑内小胶质细胞的过度不当活化是导致淀粉样斑块不能被激活的小胶质细胞有效清除的原因[20]。研究发现小胶质细胞的过度活化可作为AD认知障碍损伤的一个敏感指标[21],适度控制小胶质细胞的活化及促进M2 样激化的吞噬作用可促进脑内淀粉样斑块的降低,从而达到对AD的免疫调节作用[22]。结合本研究结果推测糖尿病肾损伤可能激活脑内的RAS 系统,通过TLR4 信号通路促进AD小鼠脑内细胞过度活化,从而导致脑内淀粉样斑块过度沉积及Aβ 蛋白的表达升高。本研究在动物水平首次发现了糖尿病肾损伤促进AD 小鼠脑内斑块沉积,加重了AD相关的脑损伤,积极治疗DN可减轻AD合并DN患者认知功能下降的进展。
