橙皮素调控miR‐182‐5p对口腔鳞癌BcaCD885细胞迁移和分泌IL‐6、IL‐8的影响
2021-05-26王超马旭亮程瑞卿张晶晶杨莉河北省眼科医院口腔种植科邢台054001
王超 马旭亮 程瑞卿 张晶晶 杨莉(河北省眼科医院口腔种植科,邢台 054001)
口腔鳞癌是常见头颈部恶性肿瘤,患病人群趋于年轻化,给人类的生命健康带来巨大危害,虽然近些年关于口腔鳞癌的研究越来越多,但口腔鳞癌患者的生存率却没有得到明显改善[1]。口腔鳞癌的发生除了与癌细胞恶性生长、转移有关以外,还与肿瘤微环境有关,肿瘤细胞能够分泌炎症因子,加快肿瘤进程[2]。橙皮素是一种黄酮类的化合物,在花卉、水果、食品等物质中广泛存在,具有生物及药理学活性[3]。橙皮素具有降低胆固醇、改善糖尿病肾病、治疗痤疮、保护神经等功能[4]。有研究发现,橙皮素还具有抗肿瘤功效,体外能够抑制结直肠癌、食管癌、前列腺癌等肿瘤细胞生长,对肿瘤细胞EMT、迁移和侵袭能力有抑制作用[5‐7]。对舌癌的研究显示,橙皮素处理后的舌癌细胞增殖能力降低,细胞周期被阻滞[8]。目前尚不明确橙皮素对口腔鳞癌细胞迁移、侵袭、EMT以及分泌IL‐6、IL‐8的作用。miR‐182‐5p是一个与肿瘤有关的小分子RNA,在人体组织中具有多种生物学作用,其在口腔癌中表达上调,能够诱导肿瘤进展,miR‐182‐5p被认为是肿瘤发生过程中的促进因子[9]。本次实验探讨橙皮素调控miR‐182‐5p对口腔鳞癌细胞迁移、侵袭、EMT以及分泌IL‐6、IL‐8的影响,为橙皮素治疗口腔鳞癌的临床应用提供实验基础。
1 材料与方法
1.1 材料橙皮素购自成都德思特生物技术有限公司;E‐cadherin抗体购自武汉艾美捷科技有限公司;N‐cadherin抗体购自美国Proteintech;IL‐8含量测定试剂盒购自南京森贝伽生物科技有限公司;Vi-mentin抗体购自美国Santa Cruz Biotechnology;miR‐182‐5p mimics、mimics control购自上海吉玛制药技术有限公司;IL‐6含量测定试剂盒购自杭州赛基生物科技有限公司;MMP‐9抗体购自美国GeneTex。
1.2 方法
1.2.1 CCK‐8检测橙皮素对口腔鳞癌BcaCD885细胞增殖的影响口腔鳞癌BcaCD885细胞接种到96孔板,接种密度为3 000个细胞/孔,置37℃,5%CO2培养箱中培养过夜,将上清溶液弃掉,细胞分成2组,分别为Control组和Hesperidin组,Control组为0µmol/L橙皮素作用组,Hesperidin组又分成4个浓度梯度,分别为20、40、80、160 µmol/L橙皮素作用组,继续培养24 h。将培养板取出,将孔中的液体吸弃,添加100 µl的细胞培养液和10 µl的CCK‐8溶液,均匀混合,置于37℃培养4 h。将酶标仪波长调整为450 nm,检测每个孔的OD值。常规方法计算细胞存活率。
1.2.2 Transwell小室检测橙皮素对BcaCD885细胞迁移和侵袭的影响将Control组和Hesperidin组(40、80、160 µmol/L)BcaCD885细胞悬浮在不含血清的细胞培养液中备用。细胞侵袭实验前以基质胶湿化小室,步骤如下:将基质胶4℃融化,用不含血清的DMEM稀释,每孔中加入100µl稀释后的基质胶,37℃孵育2 h。其余实验步骤均相同,简述如下:吸取细胞溶液添加到小室的上室中,每孔200µl,在下室中添加含有10%胎牛血清的细胞培养液500µl。置于37℃,5%CO2培养箱中培养24 h。用棉签把没有穿膜的细胞擦掉,用4%的多聚甲醛固定,0.1%结晶紫染色。在显微镜下计数细胞穿膜数目。
1.2.3 Western blot检 测 橙 皮 素 对BcaCD885细 胞中E‐cadherin、Vimentin、N‐cadherin、MMP‐9蛋白表达的影响分别取培养24 h后的Control组和Hes-peridin组(40、80、160 µmol/L)BcaCD885细胞,用PBS洗涤,添加RIPA溶液(按照1∶100比例添加PMSF),置于冰上反应5 min,快速振荡10 s,重复该过程5次。4℃,10 000 g离心10 min。吸取上清溶液,分装备用。按照BCA方法对蛋白浓度进行分析。此次实验选择10%的分离胶和5%的浓缩胶进行SDS‐PAGE电泳。在蛋白样品中添加2×Loading Buffer溶液,放在100℃孵育5 min。每孔中添加40µg的蛋白样品,首先以70 V的电压电泳30 min,然后换成100 V继续电泳1.5 h。将NC膜按照凝胶的大小进行裁剪,以300 mA的恒流转膜90 min。将NC膜放在5%牛血清白蛋白溶液中,室温结合2 h。将NC膜放在1∶1 000稀释后的一抗溶液中,4℃环境中结合过夜。再将NC膜放在1∶4 000稀释后的二抗溶液中,室温结合1 h。采用ECL化学发光显色液进行显影。Im-age J分析条带的灰度值,以β‐actin作为内参,分析目的蛋白相对表达变化。
1.2.4 ELⅠSA法检测橙皮素对BcaCD885细胞分泌ⅠL‐6、ⅠL‐8的影响分别取培养24 h后的Control组和Hesperidin组(40、80、160µmol/L)BcaCD885细胞培养液上清,以ELISA法检测IL‐6、IL‐8水平,步骤分别参照IL‐6、IL‐8含量测定试剂盒说明书进行。
1.2.5 qRT‐PCR法检测橙皮素对BcaCD885细胞中miR‐182‐5p表达的影响分别取培养24 h后的Control组 和Hesperidin组(40、80、160 µmol/L)BcaCD885细胞,按照107个细胞中添加1 ml的Trizol试剂分别提取细胞中的总RNA。用灭菌的双蒸水调节紫外分光光度计的准确性,添加样品,检测OD260/OD280的比值(在1.8~2.0之间)。利用PrimeScript RT reagent Kit进行逆转录反应,取1 µg的RNA,加 入2 µl的gDNA Eraser Buffer、1 µl的gDNA Eraser,最后添加RNase Free water至10 µl,42℃孵育2 min,4℃孵育5 min,继续在上述溶液中加入1 µl的PrimeScript RT Enzyme mixⅠ、4 µl的5×PrimeScript Buffer 2、1 µl的RT Primer mix、10 µl的Reaction solution,最后添加RNase Free water至30µl,放在37℃孵育15 min,85℃孵育5 s,4℃备用。以SYBR Premix Ex TaqⅡ进行PCR反应,取2 µl的cDNA,加 入0.5 µl的Reverse primer和Forward primer、5 µl的SYBR Green PCR Master mix,添 加RNase Free water至10 µl,95℃孵育10 s,55℃孵育30 s,72℃孵育30 s。U6为内参,按照2-ΔΔCT法计算miR‐182‐5p的表达水平。miR‐182‐5p F:5′‐GGGT‐TTGGCAATGGTAGAACTCA‐3′,R:5′‐CCAGTGA‐CGGGTCCGAGGT‐3′;U6 F:5′‐CTCGCTTCGAGCG-CACA‐3′,R:5′‐AACGTTTCACGAATTTGCGT‐3′。
1.2.6 细胞转染及逆转作用BcaCD885细胞中分别转染miR‐182‐5p mimics、mimics control(转染步骤参照转染试剂Lipofectamine®2000进行),然后用含80 µmol/L橙皮素细胞培养液培养24 h,记为Hes-peridin+miR‐182‐5p和Hesperidin+miR‐NC组,分别测定细胞增殖(步骤参照1.2.1中CCK‐8法)、迁移、侵袭(步骤参照1.2.2中Transwell小室法)和E‐cad-herin、Vimentin、N‐cadherin、MMP‐9蛋白表达(步骤参照1.2.3中Western blot法)以及细胞分泌IL‐6、IL‐8水平(步骤参照1.2.4中ELISA法)。
1.3 统计学分析用SPSS21.0分析统计实验数据,以±s表示,两组数据间比较使用t检验,多组差异比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 橙皮素对BcaCD885细胞增殖的影响与0 µmol/L橙皮素处理的Control组比较,20 µmol/L橙皮素处理后的BcaCD885细胞存活没有变化,而40、80、160 µmol/L橙皮素处理后的细胞存活率降低,选择40、80、160 µmol/L橙皮素进行后续实验。见表1。
2.2 橙皮素对BcaCD885细胞迁移、侵袭和EMT的影响与0µmol/L橙皮素处理的Control组比较,40、80、160 µmol/L橙皮素处理后的细胞迁移和侵袭数目依次降低,细胞中E‐cadherin蛋白表达水平依次升高,细胞中Vimentin、N‐cadherin、MMP‐9蛋白水平依次降低。橙皮素抑制口腔鳞癌BcaCD885细胞迁移、侵袭和EMT。见图1和表2。
2.3 橙皮素对BcaCD885细胞分泌ⅠL‐6、ⅠL‐8的影响与0 µmol/L橙皮素处理的Control组比较,40、80、160µmol/L橙皮素处理后的细胞分泌IL‐6、IL‐8依次减少。橙皮素抑制BcaCD885细胞分泌IL‐6、IL‐8。见表3。
2.4 橙皮素对BcaCD885细胞中miR‐182‐5p表达的影响与0µmol/L橙皮素处理的Control组比较,40、80、160µmol/L橙皮素处理后的细胞中miR‐182‐5p水平依次减少。橙皮素下调BcaCD885细胞中miR‐182‐5p的表达水平。见表4。
表1 橙皮素处理后BcaCD885细胞存活率(±s)Tab.1 Survival rate of BcaCD885 cells treated with hes-peretin(±s)

表1 橙皮素处理后BcaCD885细胞存活率(±s)Tab.1 Survival rate of BcaCD885 cells treated with hes-peretin(±s)
Note:Compared with Control,1)P<0.05.
Groups Survival rate(%)100.00±9.52 96.32±8.21 80.23±6.941)68.52±5.111)50.31±4.281)20.068<0.001 Control Hesperidin Hesperetin concentra-tion(µmol/L)0 20 40 80 160 F P
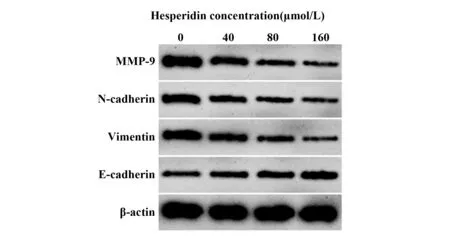
图1 Western blot检测橙皮素处理后BcaCD885细胞中E‐cadherin、Vimentin、N‐cadherin、MMP‐9蛋白水平Fig.1 Western blot detection of E‐cadherin,Vimentin,N‐cadherin and MMP‐9 protein levels in BcaCD885 cells treated with hesperetin
表2 橙皮素处理后BcaCD885细胞迁移数目、侵袭数目和E‐cadherin、Vimentin、N‐cadherin、MMP‐9蛋白水平(±s)Tab.2 Number of migration,invasion and protein levels of E‐cadherin,Vimentin,N‐cadherin and MMP‐9 of CD885 cells after hesperetin treatment(±s)
Note:Compared with Control,1)P<0.05;compared with 40µmol/L,2)P<0.05;compared with 80µmol/L,3)P<0.05.
Groups Number of migrations Number of invasion E‐cadherin Vimentin N‐cadherin MMP‐9 0.68±0.08 0.50±0.061)0.36±0.031)2)0.24±0.041)2)3)103.200<0.001 Control Hesperidin Hesperetin concentration(µmol/L)0 40 80 160 F P 186.63±17.45 163.22±14.171)126.89±10.201)2)90.10±8.851)2)3)93.600<0.001 152.32±13.56 127.41±10.131)88.39±7.551)2)63.11±3.261)2)3)160.641<0.001 0.23±0.02 0.30±0.031)0.42±0.041)2)0.53±0.041)2)3)140.267<0.001 0.60±0.06 0.49±0.051)0.35±0.031)2)0.22±0.021)2)3)133.135<0.001 0.55±0.04 0.38±0.031)0.30±0.021)2)0.20±0.031)2)3)207.395<0.001
表3 橙皮素处理后BcaCD885细胞分泌IL‐6、IL‐8水平(±s)Tab.3 Levels of IL‐6 and IL‐8 secreted by BcaCD885 cells after hesperetin treatment(±s)
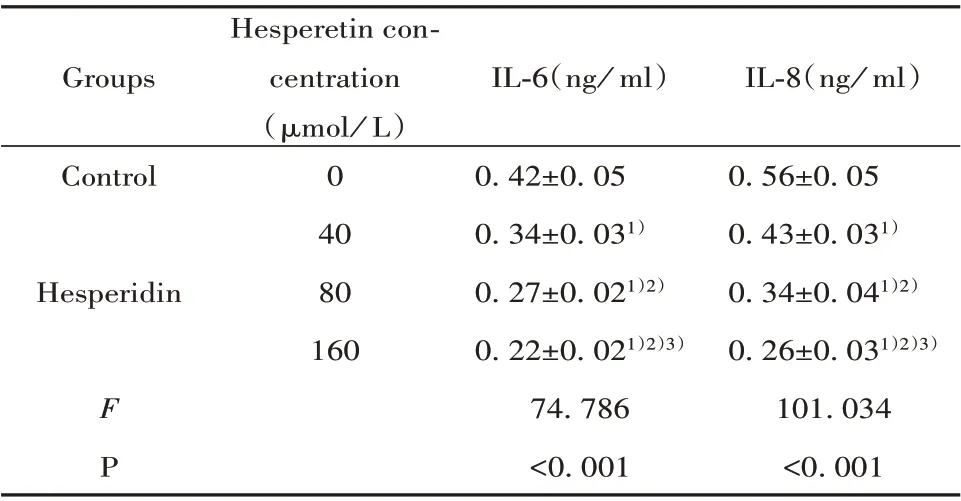
表3 橙皮素处理后BcaCD885细胞分泌IL‐6、IL‐8水平(±s)Tab.3 Levels of IL‐6 and IL‐8 secreted by BcaCD885 cells after hesperetin treatment(±s)
Note:Compared with Control,1)P<0.05;compared with 40 µmol/L,2)P<0.05;Compared with 80µmol/L,3)P<0.05.
Groups IL‐6(ng/ml)IL‐8(ng/ml)0.56±0.05 0.43±0.031)0.34±0.041)2)0.26±0.031)2)3)101.034<0.001 Control Hesperidin Hesperetin con-centration(µmol/L)0 40 80 160 F P 0.42±0.05 0.34±0.031)0.27±0.021)2)0.22±0.021)2)3)74.786<0.001
表4 橙皮素处理后BcaCD885细胞中miR‐182‐5p的水平(±s)Tab.4 Level of miR‐182‐5p BcaCD885 cells after hesper-etin treatment(±s)

表4 橙皮素处理后BcaCD885细胞中miR‐182‐5p的水平(±s)Tab.4 Level of miR‐182‐5p BcaCD885 cells after hesper-etin treatment(±s)
Note:Compared with Control,1)P<0.05;compared with 40µmol/L,2)P<0.05;compared with 80µmol/L,3)P<0.05.
miR‐182‐5p level 1.00±0.11 0.68±0.051)0.50±0.041)2)0.41±0.031)2)3)142.789<0.001 Groups Control Hesperidin Hesperetin concentra-tion(µmol/L)0 40 80 160 F P
表5 miR‐182‐5p mimics转染和橙皮素处理后BcaCD885细胞中miR‐182‐5p水平、细胞存活率、迁移数目、侵袭数目和E‐cadherin、Vimentin、N‐cadherin、MMP‐9蛋白水平以及细胞分泌的IL‐6、IL‐8水平(±s)Tab.5 miR‐182‐5p level,cell survival rate,migration number,invasion number and E‐cadherin,Vimentin,N‐cadherin,MMP‐9 in BcaCD885 cells after miR‐182‐5p mimics transfection and hesperetin treatment protein level and IL‐6 and IL‐8 levels secreted by cells(±s)
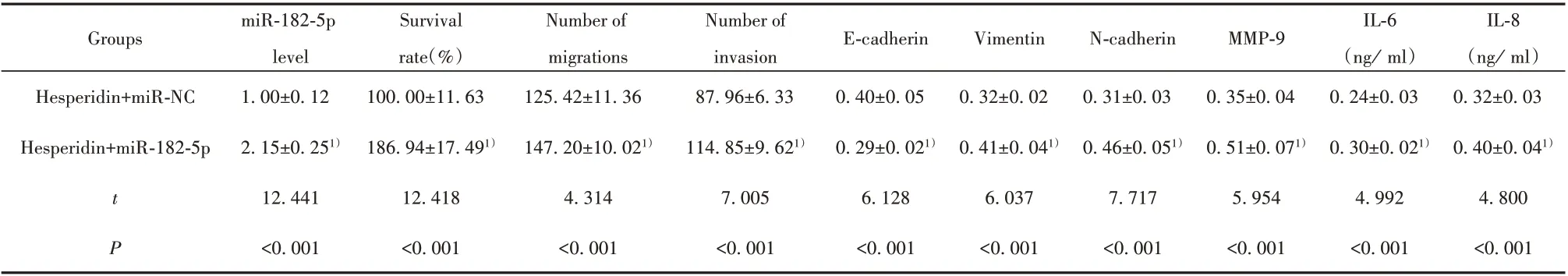
表5 miR‐182‐5p mimics转染和橙皮素处理后BcaCD885细胞中miR‐182‐5p水平、细胞存活率、迁移数目、侵袭数目和E‐cadherin、Vimentin、N‐cadherin、MMP‐9蛋白水平以及细胞分泌的IL‐6、IL‐8水平(±s)Tab.5 miR‐182‐5p level,cell survival rate,migration number,invasion number and E‐cadherin,Vimentin,N‐cadherin,MMP‐9 in BcaCD885 cells after miR‐182‐5p mimics transfection and hesperetin treatment protein level and IL‐6 and IL‐8 levels secreted by cells(±s)
Note:Compared with Hesperidin+miR‐NC,1)P<0.05.
Groups E‐cadherin Vimentin N‐cadherin MMP‐9 Hesperidin+miR‐NC Hesperidin+miR‐182‐5p t P miR‐182‐5p level 1.00±0.12 2.15±0.251)12.441<0.001 Survival rate(%)100.00±11.63 186.94±17.491)12.418<0.001 Number of migrations 125.42±11.36 147.20±10.021)4.314<0.001 Number of invasion 87.96±6.33 114.85±9.621)7.005<0.001 0.40±0.05 0.29±0.021)6.128<0.001 0.32±0.02 0.41±0.041)6.037<0.001 0.31±0.03 0.46±0.051)7.717<0.001 0.35±0.04 0.51±0.071)5.954<0.001 IL‐6(ng/ml)0.24±0.03 0.30±0.021)4.992<0.001 IL‐8(ng/ml)0.32±0.03 0.40±0.041)4.800<0.001
2.5 上调miR‐182‐5p对橙皮素调控BcaCD885细胞增殖、迁移、侵袭、EMT和分泌ⅠL‐6、ⅠL‐8的影响与Hesperidin+miR‐NC组比较,Hesperidin+miR‐182‐5p组BcaCD885细胞中miR‐182‐5p水平升高,细胞存活率、迁移数目、侵袭数目均升高,细胞中E‐cad-herin蛋白表达水平减少,Vimentin、N‐cadherin、MMP‐9蛋白表达水平升高,细胞分泌的IL‐6、IL‐8增多。见表5和图2。
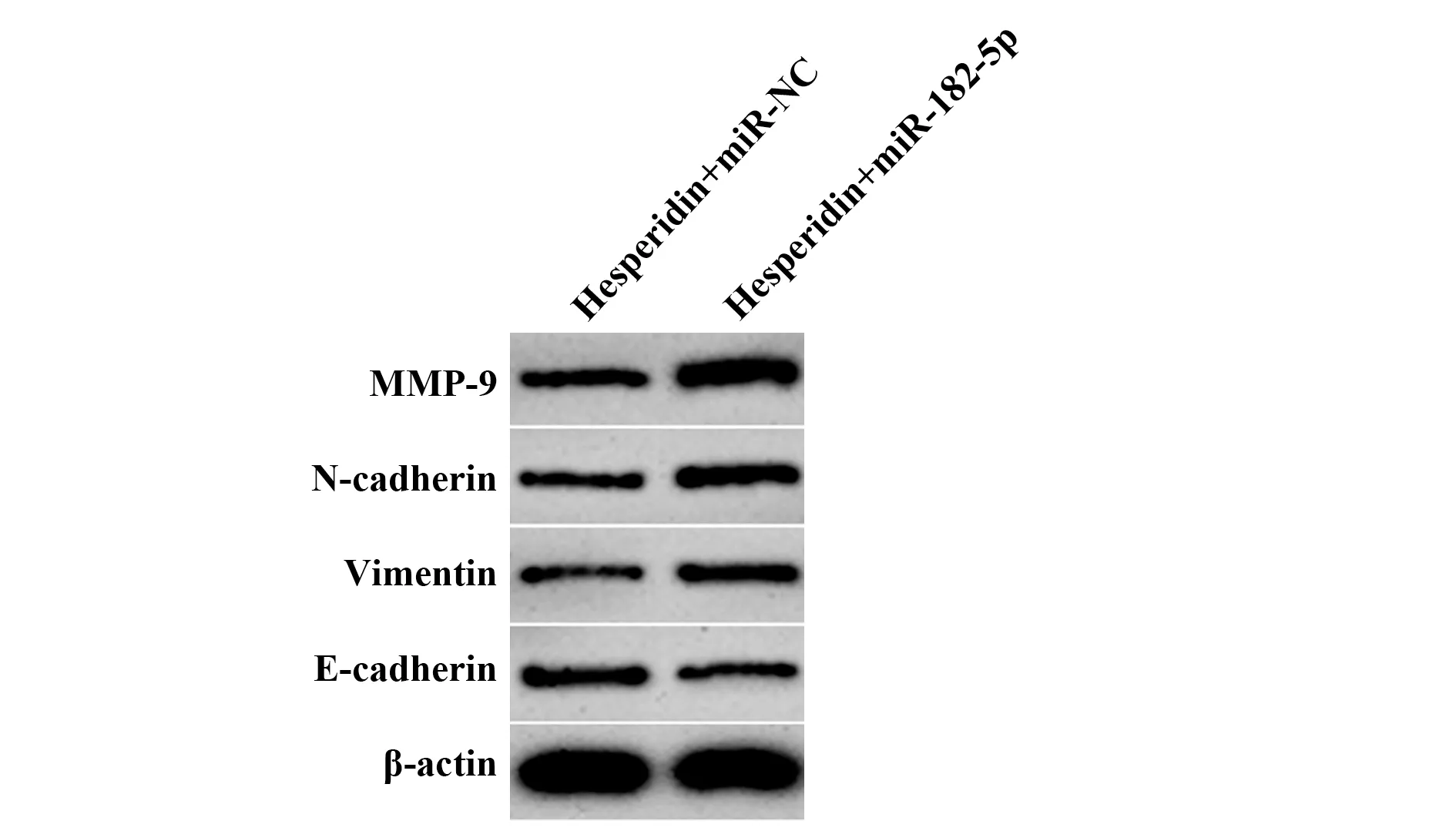
图2 Western blot检 测BcaCD885细 胞E‐cadherin、Vi-mentin、N‐cadherin和MMP‐9蛋白水平Fig.2 Western blot detection of E‐cadherin,Vimentin,N‐cadherin and MMP‐9 protein level in BcaCD885 cells
3 讨论
橙皮素广泛存在于自然界中的多种物质如水果、花卉,具有抗氧化、消炎、降血压等功效,对动脉粥样硬化、肺组织损伤等具有治疗作用[10]。有研究显示,橙皮素具有抗肿瘤作用,对结肠癌细胞迁移和侵袭有抑制作用,橙皮素治疗后的宫颈癌细胞EMT水平降低,细胞增殖能力降低[5,11]。在舌癌研究中发现橙皮素能够体外抑制舌癌细胞增殖,具有抗舌癌作用[8]。本实验显示,橙皮素处理后的口腔鳞癌细胞的增殖能力降低,说明橙皮素能够在体外抑制口腔鳞癌细胞的生长,这与之前的研究结果相一致。
肿瘤的转移是一个十分复杂的过程,不仅与细胞内多种基因的异常表达调控有关,还与肿瘤微环境有关[12‐13]。肿瘤细胞从原来的位置脱落以后,通过降解细胞外基质,迁移、侵袭至新的组织,形成新的病发灶,肿瘤细胞降解细胞外基质依赖于细胞外基质降解酶,其中基质金属蛋白酶的作用极为关键,MMP‐9属于基质金属蛋白酶家族成员之一,其在肿瘤中表达上调,能够促进肿瘤转移[14]。EMT是肿瘤发生转移的早期标志,EMT是指上皮细胞特征逐渐消失而表现出间质细胞特征的过程[15]。Vimen-tin、N‐cadherin是间质细胞标志蛋白,在肿瘤中过度表达;E‐cadherin是上皮细胞标志蛋白,在肿瘤中表达下调;Vimentin、N‐cadherin表达水平升高而E‐cadherin表达水平降低被认为是EMT的标志[16‐17]。肿瘤微环境是近年来的研究热点,包括众多细胞因子、免疫因子等,IL‐6、IL‐8是在口腔鳞癌中表达上调的促炎因子,口腔鳞癌细胞分泌IL‐6、IL‐8增多能够促进癌症转移[18‐19]。研究显示,橙皮素处理后的结肠癌HCT116细胞迁移和侵袭能力降低,细胞中的MMP‐9水平下降[5]。在宫颈癌中亦发现,橙皮素提高肿瘤细胞中E‐cadherin表达水平,抑制细胞EMT[8]。本实验发现,橙皮素处理后的口腔鳞癌细胞迁移和侵袭数目减少,细胞中Vimentin、N‐cad-herin、MMP‐9蛋白表达水平降低,E‐cadherin蛋白表达水平升高,说明橙皮素抑制口腔鳞癌细胞迁移、侵袭和EMT,这与其他研究结果相符,均说明橙皮素在肿瘤细胞恶性生物学行为中的抑制功效。同时本研究还显示,橙皮素能通过减少细胞分泌IL‐6、IL‐8而发挥抑制口腔鳞癌转移的功能。
虽然已经有很多研究发现橙皮素具有抗肿瘤作用,但目前对橙皮素抗肿瘤的作用机制尚不明确。本实验发现,橙皮素处理后的口腔鳞癌细胞中miR‐182‐5p表达水平降低,橙皮素作用机制可能与miR‐182‐5p有关。miR‐182‐5p定位在人类第7号染色体上,其首次发现于小鼠眼组织,参与视力、听力的发育,与脂肪肝、肿瘤等病理过程有关[20‐22]。miR‐182‐5p在肿瘤中表达上调,并且参与肿瘤细胞的增殖和转移过程。在口腔鳞癌中的实验发现,miR‐182‐5p表达上调能够促进肿瘤细胞的迁移和侵袭,反 之,下 调miR‐182‐5p能 抑 制 肿 瘤 细 胞恶 性 表型[9,23]。本实验显示,上调miR‐182‐5p能够逆转橙皮素对口腔鳞癌细胞增殖、迁移、侵袭、EMT和分泌IL‐6、IL‐8的影响,这说明橙皮素通过下调miR‐182‐5p参与口腔鳞癌进展。
综上所述,橙皮素通过下调miR‐182‐5p表达而抑制口腔鳞癌细胞增殖、迁移、侵袭、EMT和分泌IL‐6、IL‐8,这为橙皮素治疗口腔鳞癌的临床应用提供了理论资料,为研究橙皮素抗肿瘤分子机制奠定了基础。本研究尚未分析橙皮素通过何种靶向机制影响口腔鳞癌进展,且没有在多株口腔鳞癌细胞中进行验证,我们将在后续实验中对这部分内容进行探讨。