灯盏花素通过TGF‐β1/Smads通路减轻急性心肌梗死大鼠心室重构①
2021-05-26赵博彭建军李广平任利辉首都医科大学附属北京世纪坛医院心内科北京100038
赵博 彭建军 李广平 任利辉(首都医科大学附属北京世纪坛医院心内科,北京 100038)
急性心肌梗死(acute myocardial infarction,AMI)是一种严重的心脏疾病,分为ST抬高和非ST抬高MI,但两者治疗方法相似[1]。老年AMI患者的相对比例不断提高,给社会带来沉重经济负担[2‐3]。由于老年AMI患者的特殊性和复杂性,尚无有效治疗手段实现心脏康复[4]。心室重构与AMI并发症密切相关,是导致AMI患者预后不良的重要原因,因此寻找新的方案抑制心室重构可能有助于AMI治疗[5]。灯盏花素是从中草药中分离得到的类黄酮糖苷混合物,可通过抑制炎症反应或抗氧化应激发挥心肌保护作用[6]。临床研究显示,给予AMI患者经皮冠状动脉介入术后灯盏花素治疗有助于改善其心肌功能[7]。此外,MI后,活化的转化生长因子‐β1(transforming growth factor‐β1,TGF‐β1)可依赖Smads信号通路参与心室重构[8]。本研究通过构建AMI大鼠模型,初步研究灯盏花素对AMI的作用机理,以期为AMI治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级、雌性SD大鼠,8周龄,体重(220±10)g,购自上海剑钝生物科技有限公司,生产许可证号:SCXK(沪)2019‐0027。实验经我院动物伦理委员会批准,并遵守3R保护原则。
1.1.2 药品与试剂灯盏花素片购自广东彼迪药业有限公司;TGF‐β1通路激活剂(SRI‐011381 hy-drochloride)购自北京百奥莱博科技有限公司;阿司匹林肠溶片购自沈阳奥吉娜药业有限公司;Masson三色染色(G1340)和HE染色(G1120)染色试剂盒购自北京Solarbio公司;TGF‐β1(ab215715)、Smad2(ab40855)、p‐Smad2(ab188334)、Smad3(ab40854)兔抗大鼠单抗、p‐Smad3(ab51177)、β‐actin(ab8227)兔抗大鼠多抗、山羊抗兔lgG(H+L)二抗(ab6721)购自Abcam公司。
1.1.3 主要仪器M50倒置荧光显微镜购自上海万衡精密仪器有限公司;EVOS M5000细胞成像系统购自美国Thermo Fisher Scientific公司;EK‐1000B型多普勒彩超仪购自江苏亿康电子科技有限公司;BioPac生理仪购自美国BIOPAC公司。
1.2 方法
1.2.1 建模参考文献[9]建立AMI大鼠模型:采用1%戊巴比安腹腔麻醉大鼠,气管插管接呼吸机(55次/min,潮气量3 ml/100 g)和心电图,对大鼠左侧备皮消毒后,剪开左侧4肋间皮肤,钝性开胸以暴露心脏,于前肢下2 mm左右结扎冠状动脉,观察到左心室前壁心肌颜色变化和心电图ST段弓背抬高0.3 mV以上后,迅速将心脏放回胸腔,缝合手术切口,每天腹腔注射青霉素,若大鼠术后24 h存活,则建模成功。
1.2.2 分组及处理大鼠开胸暴露心脏但不结扎作为假手术组(n=11)。AMI造模成功的大鼠分为5组:模型组(n=10)、灯盏花素Ⅰ组(n=11)、灯盏花素Ⅱ组(n=11)、TGF‐β1激活剂组(n=11)和阳性对照组(n=10)。假手术组和模型组每天灌胃给予等量生理盐水,灯盏花素Ⅰ组、灯盏花素ⅠⅠ组、TGF‐β1激活剂组、阳性对照组每天分别灌胃给予50、200 mg/kg灯盏花素、10 mg/kg TGF‐β1激活剂+200 mg/kg灯盏花素、100 mg/kg阿司匹林肠溶片,建模成功次日开始给药,1次/d,连续4周[10]。
1.2.3 心脏超声检测末次给药4 h麻醉大鼠,固定大鼠四肢,采用多普勒心脏彩超检测大鼠心脏左室以下指标:舒张末径(end‐diastolic dimension,EDd)、收缩末径(end‐systolic dimension,ESd)、射血分数(ejection fraction,EF)、短轴缩短率(fractional shortening,FS),每组数据测量3次以上,取平均值[9]。
1.2.4 血流动力学指标检测分离大鼠颈总动脉,插入导管至左心室,采用生理检测系统记录左室压上升最大速率(+dp/dtmax)和左室压下降最大速率(-dp/dtmax),每组数据测量3次以上,取平均值。
1.2.5 HE染色颈椎脱臼处死大鼠,取出心脏,清洗后分离得左心室,分为2份,一份采用4%多聚甲醛固定,脱水、包埋后制成石蜡切块;一份保存于-80℃液氮中备用。将保存的石蜡切块制成4 µm左右切片,脱蜡、脱水,根据试剂盒说明书进行HE染色,封片,显微镜下观察。
1.2.6 Masson测定实验取1.2.5石蜡切片,根据Masson染色试剂盒说明书进行染色,随机选取5个视野,显微镜下观察心肌组织纤维化程度。
1.2.7 Western blot实验RIPA裂解液裂解各组大鼠心肌组织匀浆上清,BCA试剂盒定量总蛋白。取20 µg蛋白样品,5% SDS‐PAGE电泳分离,转膜,5%牛血清蛋白封膜,依次加入TGF‐β1、Smads2、Smads3、p‐Smads2、p‐Smads3、Smads7和β‐actin一抗(1∶1 000),4℃孵育12 h,TBST洗3次,10 min/次,加入二抗(1∶5 000),25℃孵育40 min,曝光显影,Image J定量分析。
1.3 统计学分析采用SPSS25.0软件进行统计学分析,计量数据以±s表示,两组间比较采用t检验,多组间比较行单因素方差分析,进一步比较采用SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠超声检查结果与假手术组相比,模型组大鼠左心室EDd和ESd值显著升高(P<0.05),EF和FS值显著降低(P<0.05);与模型组相比,灯盏花素Ⅰ组、灯盏花素Ⅱ组和阳性对照组大鼠左心室EDd和ESd值显著降低(P<0.05),EF和FS值显著升高(P<0.05);与灯盏花素II组相比,TGF‐β1激活剂组大鼠左心室EDd和ESd值显著升高(P<0.05),EF和FS值显著降低(P<0.05),见表1。
2.2 各组大鼠血流动力学指标与假手术组相比,模型组大鼠左心室+dp/dtmax和-dp/dtmax值显著降低(P<0.05);与模型组相比,灯盏花素Ⅰ组、灯盏花素Ⅱ组和阳性对照组大鼠左心室+dp/dtmax和-dp/dtmax值显著升高(P<0.05);与灯盏花素Ⅱ组相比,TGF‐β1激活剂组大鼠左心室+dp/dtmax和-dp/dtmax值显著降低(P<0.05),见表2。
2.3 各组大鼠心肌组织病理学变化假手术组大鼠心肌组织形态正常,心肌细胞排列紧密,细胞空隙较小;模型组大鼠心肌细胞排列紊乱,细胞间隙显著扩大;灯盏花素Ⅰ组、Ⅱ组和阳性对照组大鼠心肌细胞排列略不规则,细胞间隙明显比模型组缩小;与灯盏花素Ⅱ组相比,TGF‐β1激活剂组大鼠心肌细胞排列更加不规则,细胞间隙变大,见图1。
2.4 各组大鼠心肌纤维化情况假手术组大鼠几乎无蓝色胶原沉积变化;模型组大鼠可见明显间质胶原沉积;与模型组相比,灯盏花素Ⅰ组、Ⅱ组和阳性对照组大鼠心肌组织胶原密度明显降低,胶原沉积得到显著改善;与灯盏花素Ⅱ组相比,TGF‐β1激活剂组大鼠胶原沉积增多。
2.5 各组大鼠心肌组织TGF‐β1和Smads蛋白表达与假手术组相比,模型组大鼠心肌组织TGF‐β 1、Smads2和Smads3蛋白表达显著升高(P<0.05),Smads7蛋白表达显著降低(P<0.05);与模型组相比,灯盏花素Ⅰ组、灯盏花素Ⅱ组和阳性对照组大鼠心肌组织TGF‐β1、Smads2和Smads3蛋白表达显著降低(P<0.05),Smads7蛋白表达显著升高(P<0.05);与灯盏花素Ⅱ组相比,TGF‐β1激活剂组大鼠心肌组织中TGF‐β1、Smads2和Smads3蛋白表达显著升高(P<0.05),Smads7蛋白表达显著降低(P<0.05),见图3。
表1 各组大鼠心脏超声检查结果比较(±s)Tab.1 Comparison of results of echocardiography in rats in each group(±s)
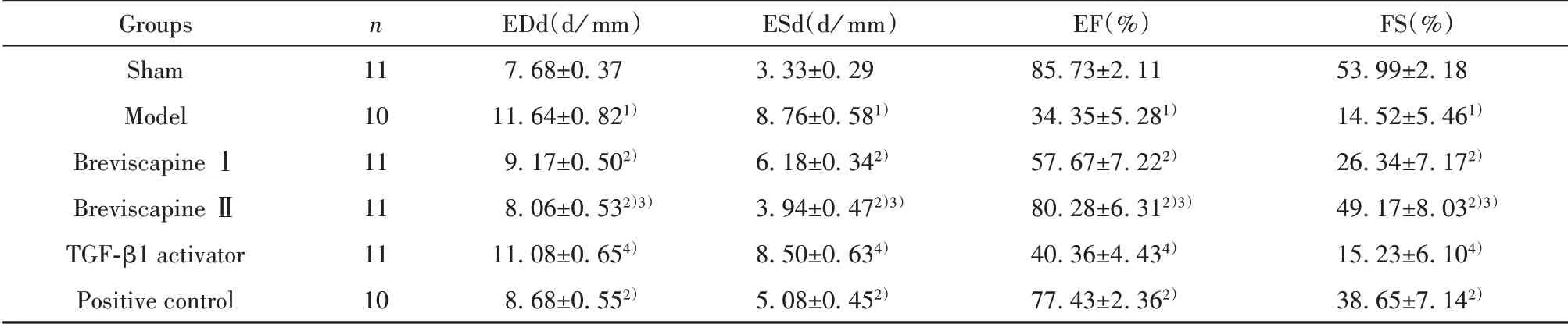
表1 各组大鼠心脏超声检查结果比较(±s)Tab.1 Comparison of results of echocardiography in rats in each group(±s)
Note:Compared with Sham group,1)P<0.05;compared with Model group,2)P<0.05;compared with Breviscapine I group,3)P<0.05;compared with Breviscapin II group,4)P<0.05.

图1 HE染色观察各组MI大鼠心肌组织病理学变化(×200)Fig.1 Histopathological changes of myocardium in ratswith MI in each group by HE staining(×200)

图2 Masson染色观察各组MI大鼠心肌纤维化变化(×200)Fig.2 Changes of myocardial fibrosis in rats with MI in each group by Masson staining(×200)
表2 各组大鼠血流动力学指标比较(±s,mmHg/ms)Tab.2 Comparison of hemodynamic indexes of rats in each group(±s,mmHg/ms)

表2 各组大鼠血流动力学指标比较(±s,mmHg/ms)Tab.2 Comparison of hemodynamic indexes of rats in each group(±s,mmHg/ms)
Note:Compared with Sham group,1)P<0.05;compared with Model group,2)P<0.05;compared with Breviscapine I group,3)P<0.05;compared with Breviscapin II group,4)P<0.05.

图3 各 组 大 鼠 心 肌 组 织TGF‐β1、Smads2、Smads3和Smads7蛋白表达Fig.3 Expressions of TGF‐β1,Smads2,Smads3 and Sma‐ds7 proteins in myocardial tissue of rats in each group
3 讨论
心室重构可导致心脏功能下降,是AMI后发病率和死亡率的独立决定因素,严重影响患者生命安全[11]。超声心电图监测和血流动力指标可量化AMI局部和整体心室重构和心脏功能,故可用于AMI大鼠模型心脏重塑评价[12‐13]。本研究显示,与对照组相比,模型组大鼠左心室EDd、ESd显著升高,EF、FS、+dp/dtmax、-dp/dtmax显著降低,表明AMI大鼠发生心室重构和心脏功能障碍,提示建模成功。
灯盏花属于菊科植物,首载于《滇南本草》,可活血化瘀、消炎止痛[14]。灯盏花素为灯盏花的主要活性成分,具有抗炎、抗氧化和抗血管生成等作用[15]。WANG等[16]研究显示,灯盏花素可用于防治和治疗慢性完全闭塞患者血运重建后的左心室重建,恢复患者心肌功能;赵天等[17]发现,灯盏花素可通过改善血流和血液动力学指标改善大鼠动脉粥样硬化。本研究发现,给予灯盏花素治疗后,AMI大鼠心室重构及心脏功能障碍显著改善,提示灯盏花素可恢复AMI大鼠心脏功能,推测灯盏花素可能通过预防心室重构延缓AMI发展,但具体机制有待进一步研究。
TGF‐β在病理和生理过程中起重要作用,其中TGF‐β1与AMI后心室重构病理机制密切相关[18]。Smads蛋白是丝/苏氨酸受体的下游信号分子,也是TGF‐β受体中胞内激酶的唯一底物,具有转录激活作用[19]。Smads蛋白家族包括受体调节蛋白Smad1、Smad2、Smad3、Smad5、Smad8、Smad19、共同介质蛋白Smads4和抑制性蛋白Smad6、Smad7 3类,其中TGF‐β1可导致Smad2和Smad3磷酸化,抑制Smads7表达参与AMI进展[8]。本研究显示,与对照组相比,模型组大鼠心肌细胞排列紊乱,细胞间隙显著扩大,可见明显的间质胶原沉积等病变,TGF‐β1、磷酸化的Smads2和Smads3蛋白表达显著升高,Smads7蛋白表达显著降低,提示AMI大鼠心脏功能障碍可能与TGF‐β1/Smad2/Smad3/Smads7途径相关。给予灯盏花素治疗后,AMI大鼠心肌组织病变显著改善,TGF‐β1/Smad2/Smad3信号通路受抑制,Smads7蛋白水平显著上升,与临床常用药物阿司匹林肠溶片治疗效果接近,推测灯盏花素可能通过抑制TGF‐β1/Smads信号通路延缓AMI心室重构,发挥心脏保护作用。
LU等[20]发现,TGF‐β1/Smad2/Smad3信号途径的激活加重了慢性心力衰竭大鼠心室重构、心肌纤维化和胶原沉积等病理变化。本研究联合采用灯盏花素和TGF‐β1激活剂治疗发现,AMI大鼠心肌组织TGF‐β1蛋白表达、Smads2和Smads3磷酸化水平比单独采用灯盏花素治疗时显著升高,Smads7蛋白表达显著降低,大鼠心室重构、心肌组织病变程度和心肌纤维化加重,提示TGF‐β1激活剂可逆转灯盏花素对AMI大鼠心室重构的抑制作用。另有研究证实,抑制TGF‐β1蛋白表达和Smad2蛋白磷酸化可上调AMI大鼠心肌组织Smad7蛋白表达,降低AMI大鼠心肌组织中胶原水平,改善心室重构[21]。因此,推测TGF‐β1/Smads信号通路可能是灯盏花素治疗AMI的关键靶点。