茯苓多糖改善HDL功能并通过PPARγ/LXRα/ABCA1抗AS机制研究①
2021-05-26于宁宋囡王莹杨关林贾连群辽宁中医药大学沈阳110847
于宁 宋囡 王莹 杨关林 贾连群(辽宁中医药大学,沈阳 110847)
近年来,心血管疾病患病率与死亡率仍处于逐年上升阶段,死亡率居首位,占居民疾病死亡构成的40%以上,已成为重大的公共卫生问题,防治心血管疾病刻不容缓[1]。动脉粥样硬化(atherosclero-sis,AS)为心血管疾病的主要病理学基础,主要表现为大、中动脉内膜脂质沉积,内膜增厚隆起,中膜平滑肌细胞和基质增生,最终导致管腔狭窄至闭塞[2]。胆固醇逆向转运(cholesterol reverse transport,RCT)为改善AS脂质沉积的主要机制,是指作为受体的高密度脂蛋白将泡沫细胞及动脉粥样硬化斑块等肝外组织细胞中的胆固醇转运至肝脏进行分解代谢,合成分泌胆汁,通过肠道排出体外的过程,是正常机体维持脂代谢平衡的重要机制之一[3]。PPARγ/LXRα/ABCA1信号通路是参与RCT的经典通路之一。流行病学研究显示,HDL‐C与心血管事件呈负相关,HDL‐C浓度每升高1 mg/dl,冠心病的风险就会降低2%~3%[4]。HDL参与RCT,发挥抗氧化、抗炎功能。但在慢性炎症、血脂异常、糖尿病、AS等病理条件下,HDL的结构和成分发生改变,导致功能异常,即成为dyHDL,dyHDL可阻碍RCT过程[5]。研究表明,茯苓多糖具有抗炎、抗氧化、抗肿瘤、防治肝损伤、心脑血管疾病的作用[6]。本研究以dyHDL与胆固醇逆转运为切入点,探讨茯苓多糖作为药物干预是否能够通过改善dyHDL并促进胆固醇逆转运PPARγ/LXRα/ABCA1信号通路防治AS,为AS防治提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物32只SPF级ApoE‐/‐小鼠,6~8周龄,体重20~22 g,同龄遗传背景相同的C57BL/6J小鼠10只,所有动物购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012‐0001,辽宁中医药大学实验动物中心饲养,自由摄食饮水,温度(22±5)℃,湿度(50±2)%。
1.1.2 药物及试剂茯苓多糖(索莱宝,批号A6520);辛伐他汀(杭州制药有限公司州默沙东,批号J20180007);ABCA1抗 体(Immunoway,批 号YN2847);PPARγ抗体、LXRα抗体(proteintech,批号分别为16643‐1‐AP、14351‐1‐AP);β‐actin抗体(康为试剂,批号CW0096);CYP7A1抗体、SR‐B1抗体(博奥森,批号分别为bs‐2399R、bs‐1186R);小鼠SAA ELISA试剂盒、小鼠S1P ELISA试剂盒(上海酶联生物科技有限公司,批号分别为ml001976、ml062988)。
1.1.3 实验仪器7500 Real‐time PCR仪(美国Applied Biosystems公司);梯度PCR仪(美国ABI,veriti 96 well Thermal Cycler);全自动生化分析仪(日本东芝,TBA‐120FR);湿转印电泳槽、垂直电泳槽(美国Bio‐Rad)。
1.2 方法
1.2.1 实验分组、造模与给药全部ApoE‐/‐小鼠,给予高脂饲料喂养,8周后抽取2只,光学显微镜下观察小鼠主动脉斑块是否已形成作为判断造模成功与否的标志。按随机数字表法将小鼠分为模型组、茯苓多糖组、辛伐他汀组,每组10只。10只C57BL/6J小鼠作为正常组。正常及模型组给予生理盐水,茯苓多糖组给予茯苓多糖,按0.2 g/(kg·d),0.5 ml/次,灌胃,给药4周。正常组喂养普通饲料,模型组、茯苓多糖组、辛伐他汀组喂养高脂饲料。
1.2.2 血脂检测采用10%水合氯醛麻醉小鼠,腹主动脉取血,将血液放入促凝管中放置2 h后,2 500 r/min,离心20 min,将上清吸于1.5 ml EP管中,-80℃保存。全自动生化分析仪检测TG、TC、HDL‐C、LDL‐C含量。
1.2.3 HE、油红O染色法检测肝脏脂质沉积情况HE染色:将小鼠肝脏置于4%多聚甲醛中,梯度脱水,石蜡包埋,切成5 µm厚的切片,用HE染色,洗涤10 min,95%乙醇脱水2次,二甲苯透明,中性树胶封片,光学显微镜观察肝脏病理组织学形态。
油红O染色:将放置于4%多聚甲醛中的肝脏取出,包埋,制备厚度为8~10µm的冰冻切片,油红O染色10 min,75%酒精分化2 s,水洗1 min,苏木素复染2 min,自来水洗涤。1%盐酸酒精分化并水洗,氨水蓝水洗后甘油明胶封片,光学显微镜下观察肝脏脂质沉积情况。
1.2.4 ELⅠSA法检测小鼠血清SAA、S1P含量将小鼠血清吸取于1.5 ml的EP管中,设计排版,分别设置标准品孔、空白孔、样品孔,标准品孔加入50µl的标准品,样品孔加入样品稀释液40µl、样品10µl,依次进行加酶、温育、洗涤、显色,最后加终止液,以空白孔调零,450 nm波长测定每孔吸光度。
1.2.5 Real time RT‐PCR法检测小鼠肝脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1mRNA表达称取小鼠肝脏100 mg,RNA提取试剂盒提取小鼠肝脏RNA,去除DNA,逆转录成cDNA,采用SYBR Green进行实时荧光PCR。PCR反应程序设定:95℃10 min,95℃15 s,60℃1 min,40个循环。ΔCT值为目的mRNA CT值与内参mRNA CT值的差值,ΔΔCT为各实验组ΔCT与空白对照组ΔCT的差值,平均相对含量=2‐ΔΔCT。实验重复3次。引物序列见表1。
1.2.6 Western blot法检测小鼠肝脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1蛋白表达称取小鼠肝脏100 mg,加入已加入蛋白酶抑制剂的RIPA 1 ml,组织研磨,4℃12 500 r/min离心15 min,吸取上清于1.5 ml EP管中,BCA蛋白定量测定各组肝脏浓度,计算上样量,加入2×上样缓冲液,100℃变性5 min,每组按照60µg电泳,分离胶80 V 15 min,浓缩胶100 V 30 min,电泳完成后进行转膜,100 V 80 min,5%脱脂奶粉封闭1 h,一抗孵育过夜,1×TBST洗涤3次,每次15 min,二抗孵育1 h,1×TBST洗涤3次,每次15 min,制备发光液,曝光,分析灰度值。
1.3 统计学处理采用SPSS16.0软件统计分析,计量资料以±s表示,多组之间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血脂水平与正常组比较,模型组小鼠血清TG、TC、LDL‐C水平明显升高(P<0.01),HDL‐C明显降低(P<0.01);与模型组比较,茯苓多糖、辛伐他汀组TG、TC、LDL‐C水平明显降低(P<0.01),HDL‐C明显升高(P<0.01)。见表2。

表1 Real time RT‐PCR的相关引物序列Tab.1 Related primer sequences of Real time RT‐PCR
2.2 各组小鼠肝脏脂质沉积情况HE染色:正常组肝脏组织结构正常,肝小叶中央可见呈发射状排列的肝索和肝血窦。肝细胞圆形,胞质均质嗜酸性,细胞核较大、圆形;模型组肝脏组织结构紊乱,肝血窦受压变窄。肝细胞体积增大,胞质疏松,可见双核肝细胞;茯苓多糖与辛伐他汀组肝脏结构恢复接近正常组。肝细胞呈条索状排列,肝细胞索间可见肝血窦,肝细胞圆形,胞质均质嗜酸性,细胞核较大、圆形。见图1A。
油红O染色:正常组肝细胞内未见细胞肿胀和脂肪变性;模型组肝细胞发生明显的脂肪变性,肝细胞内可见大小不等的脂肪滴;茯苓多糖与辛伐他汀组肝组织中脂滴含量较模型组明显减少,接近正常组。见图1B。
2.3 各组小鼠血清SAA、S1P含量与正常组比较,模型组小鼠血清SAA含量明显升高,S1P明显降低(P<0.01);与模型组比较,茯苓多糖组、辛伐他汀组SAA含量明显降低,S1P含量明显升高(P<0.01)。见图2。
2.4 各 组 小 鼠 肝 脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1 mRNA表达与正常组比较,模型组小鼠肝脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1 mRNA表达显著降低(P<0.01);与模型组比较,茯苓多糖组、辛伐他汀组PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1 mRNA表达显著升高(P<0.05,P<0.01)。见图3。
表2 各组小鼠血清TG、TC、HDL‐C、LDL‐C水平(±s)Tab.2 Levels of TG,TC,HDL‐C and LDL‐C in serum of mice in each group(±s)
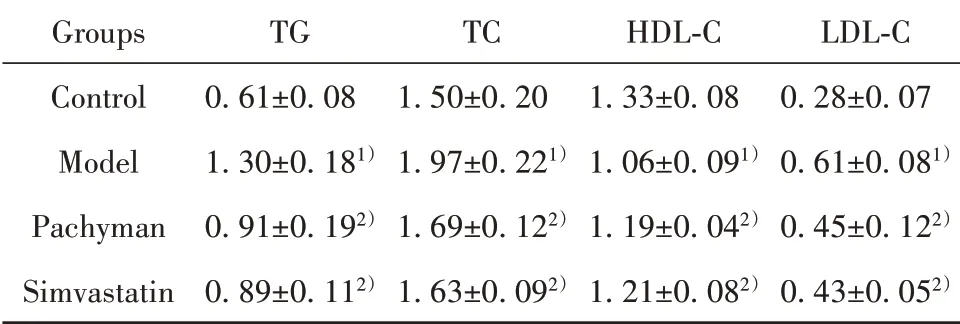
表2 各组小鼠血清TG、TC、HDL‐C、LDL‐C水平(±s)Tab.2 Levels of TG,TC,HDL‐C and LDL‐C in serum of mice in each group(±s)
Note:Compared with the control group,1)P<0.01;compared with the model group,2)P<0.01.
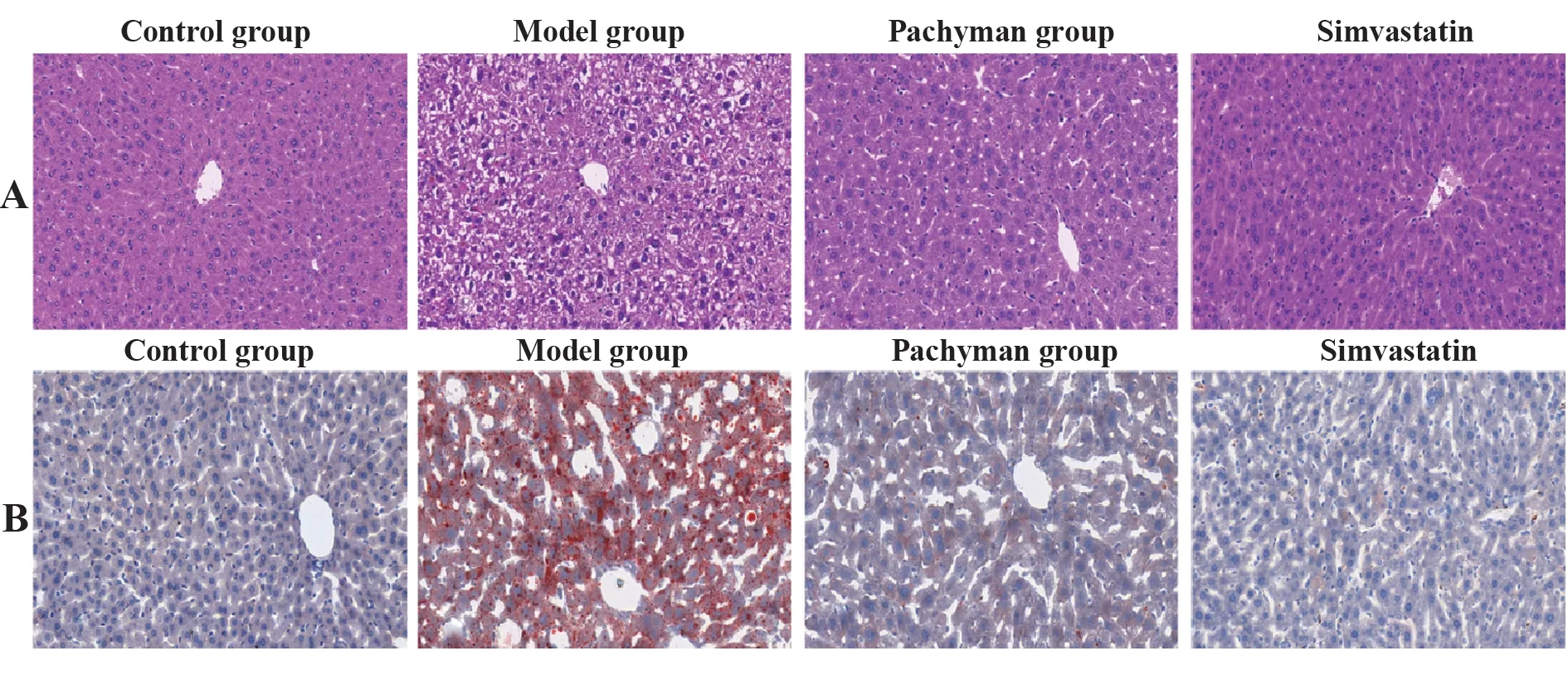
图1 各组小鼠肝脏HE、油红O染色情况Fig.1 Staining of HE and Oil Red O in liver of mice in each group

图2 各组小鼠血清SAA、S1P含量Fig.2 Contents of SAA and S1P in serum of mice in each group
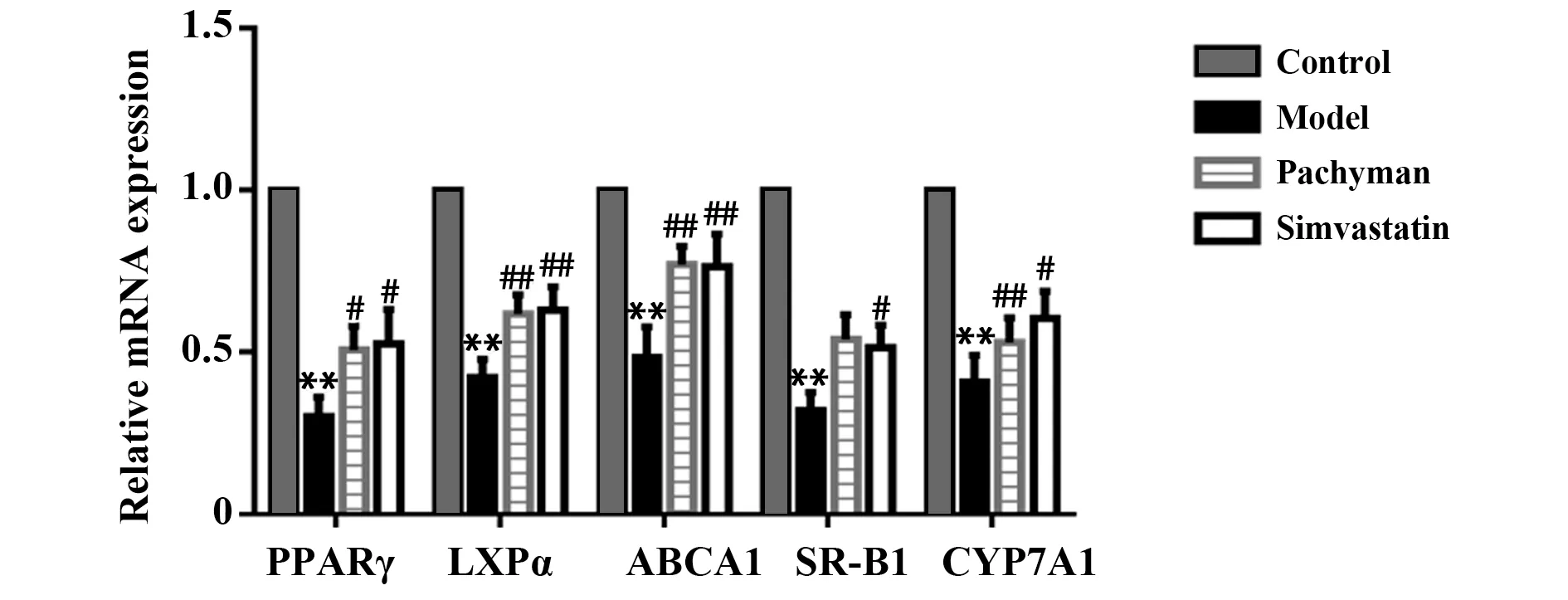
图3 各组小鼠肝脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1mRNA表达情况Fig.3 Expression of PPARγ,LXRα,ABCA1,CYP7A1 and SR‐B1 mRNA in liver of mice in each group

图4 各组小鼠肝脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1蛋白表达情况Fig.4 Protein expression of PPARγ,LXRα,ABCA1,CYP7A1 and SR‐B1 in liver of mice in each group
2.5 各组小鼠肝脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1蛋白表达与正常组比较,模型组小鼠肝脏PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1蛋白表达显著降低(P<0.01);与模型组比较,茯苓多糖组、辛伐他汀组PPARγ、LXRα、ABCA1、CYP7A1、SR‐B1蛋白表达显著升高(P<0.05,P<0.01)。见图4。
3 讨论
AS以动脉壁脂质沉积、细胞死亡和斑块纤维化为特征,是冠心病、脑梗死、外周血管狭窄等多种缺血性心脑血管疾病的共同病理基础,目前认为是一种特殊形式的慢性炎症,严重威胁人类健康。因此,防治AS具有重要意义[7‐8]。中医将其归为“心悸”“胸痹”“中风”“脉痹”“脱疽”的范畴,认为多由本虚标实所致。脾气虚弱无力,水谷精微失于运化,水湿内生,聚而为痰,瘀阻脉络,成痰瘀阻络之势,日久形成AS等心脑血管疾病。《诸病源候论·诸痰论》曰:“诸痰者,此由血脉壅塞,饮水积聚而不消散,故成痰也”,说明“血中之痰浊”是血脂异常、AS的致病因素[9]。茯苓多糖是茯苓的主要单体成分,具有抗肿瘤、抗炎、抗遗传损伤、免疫调节、抑菌、抗病毒、抗氧化、护肝催眠等药理作用[10‐11]。研究发现,茯苓多糖能够增强细胞免疫,特别是巨噬细胞的吞噬活性,能通过活化肝脏细胞的AKT信号通路,抑制NF‐κB信号通路改善肝损伤[12]。临床在心血管疾病治疗上常采用桂枝与茯苓协同防治心血管疾病。有文献报道,二者协同具有抑制NF‐κB及MMP‐2的表达作用,从而重塑进程动脉粥样硬化大鼠模型心脏微小血管,显著降低血清和脑组织中TNF‐α、ET‐1水平,提高缺血脑组织的供血速度,对缺血脑组织启动保护机制[13]。茯苓多糖可通过抑制IL‐33/ST2信号通路的激活,减少肥大细胞活化,抑制炎症因子的表达,降低结肠炎症浸润程度[14]。关于茯苓多糖对肝脏脂质代谢方面的研究尚不多见[15‐16]。因此,针对脾虚痰浊内生的中医病机,课题组采用具有健脾化痰功效的茯苓的主要成分茯苓多糖作为药物干预,探讨其是否通过调节肝脏胆固醇逆转运过程进而改善AS。实验结果显示,与模型组比较,茯苓多糖能够显著降低血清TG、TC、LDL‐C水平,升高HDL‐C水平,肝脏组织结构接近于正常,肝细胞呈条索状排列,肝细胞索间可见肝血窦,脂肪空泡明显减轻,表明茯苓多糖可在一定程度上改善血脂水平,调节肝脏脂质代谢,进而改善AS。
众所周知,HDL‐C是AS的保护因素,但近年来的研究发现单纯增加HDL‐C的数量并不能有效降低AS的风险,人们逐渐意识到HDL不单纯是量的改变,更应该关注质的变化[17]。国际上,将正常的HDL称为功能性HDL,其具有抗氧化、抗炎、抗血栓、促纤溶以及改善内皮细胞功能等生物学活性。在急性期、慢性炎症及一些代谢性疾病中,HDL会发生一系列的病理性修饰,导致其组成成分以及功能基团发生改变,将此类HDL称为“失功能HDL”(dyHDL)[18]。S1P具有抗AS的作用,存在于HDL外层,是鞘磷脂代谢的中间产物之一,既可作为细胞内第二信使发挥作用,又可与HDL表面上的特定细胞受体(S1PR)结合而发挥其生物学效应[19‐21]。血浆中60%~80%的S1P通过ApoM与HDL结合,参与调节HDL的抗氧化、抗炎等效应[22]。临床研究证明HDL‐S1P含量与冠心病程度呈负相关,我国学者研究发现,冠心病PCI术后HDL‐S1P含量高的患者,再狭窄率显著降低[23]。SAA是一种急性相反应蛋白,与脂蛋白相联系,在炎症发生时,SAA的表达会升高1 000倍,取 代HDL的 主 要 载 脂 蛋 白ApoAI[24]。SAA会牢牢吸住位于动脉壁上的HDL,抑制HDL与周围细胞胆固醇结合,抑制LCAT活性,从而降低了ApoAI介导的RCT,且加速血液循环中HDL的清除。有研究表示HDL组分SAA/ApoAI比值具有评估dyHDL含量的价值[25]。因此,通过检测血清S1P、SAA含量可侧面反映dyHDL含量。本实验结果发现,与正常组比较,模型组小鼠血清S1P明显降低,SAA明显升高,说明ApoE‐/‐小鼠HDL功能明显降低。与模型组比较,茯苓多糖及辛伐他汀组小鼠血清S1P明显升高,SAA明显降低,差异具有统计学意义,说明茯苓多糖能够纠正HDL失功能状态改善AS。
PPARγ为过氧化物酶体增殖物激活受体家族一员,主要分布于肝脏和脂肪组织中,在调控糖脂代谢、抗炎、抗AS的发展中具有重要作用。PPARγ通过激活下游效应分子上调ABCA1和SR‐B1的表达,促进巨噬细胞胆固醇的流出,抑制巨噬细胞的泡沫化,抑制AS的形成[26‐27]。LXRα是核受体超家族成员,在肝脏、肾脏、巨噬细胞中大量分布,具有调节胆固醇代谢的作用,通过调控下游基因AB-CA1,促进胆固醇逆转运[28‐29]。机体内胆固醇清除的经典有效途径是在胆固醇7α‐羟化酶(CYP7A1)的作用下生成胆汁酸,而CYP7A1基因是LXRα的下游基因,故LXR‐α也有调控胆汁酸的作用[30]。SR‐B1能够介导肝脏摄取胆固醇并促进胆汁分泌,从而促进RCT,抑制AS的发生。研究发现dyHDL可阻碍RCT过程,存在于HDL外膜的SAA、S1P等因子导致HDL失功能,抗氧化、抗炎、保护内皮细胞等功能失调,阻碍RCT的发生,肝脏脂质代谢失调,进而导致AS的发生[31]。本实验结果发现,与正常组比较,模型组小鼠肝脏PPARγ、LXRα、ABCA1、SR‐B1、CYP7A1 mRNA、蛋白表达显著降低;与模型组比较,茯苓多糖与辛伐他汀组小鼠肝脏PPARγ、LXRα、ABCA1、SR‐B1、CYP7A1 mRNA、蛋白表达显著升高,综合ELISA结果中茯苓多糖组SAA表达下调、S1P表达上调,说明茯苓多糖能够通过恢复HDL功能并促进胆固醇逆转运通路PPARγ‐LXRα‐AB-CA1改善ApoE‐/‐小鼠肝脏脂质沉积,防治AS。
基于以上研究,本课题组认为茯苓多糖可能通过抑制dyHDL,即恢复HDL功能并通过胆固醇逆转运通路PPARγ‐LXRα‐ABCA1改善ApoE‐/‐小鼠肝脏脂质沉积情况,有望为茯苓多糖防治心脑血管疾病提供新的思路和方法。有关茯苓多糖的含量,给药时 间 与改善HDL功能并通过PPARγ/LXRα/AB-CA1抗AS有否依赖关系,本课题组还会进一步研究,并在体外实验中进行验证。