不同分子量的枸杞多糖组分对树突状细胞成熟的影响①
2021-05-26陈艳平廖海锋王青罗霞邓向亮周联广州中医药大学广州510006
陈艳平 廖海锋王青 罗霞 邓向亮 周联(广州中医药大学,广州 510006)
近年来,多糖的研究逐渐引起重视,其组成较为复杂,分子量可从几千到几十万[1]。目前研究认为,多糖生理功效和生物活性与其分子量大小、聚合度、分支度及溶液中高级构象等有关,多糖分子量太大或太小均会引起其活性下降[2]。多糖的相对分子量越大,体积越大,越不利于多糖跨越多重细胞膜进入生物体内发挥生物学活性,但分子量过低也无法形成产生活性的聚合结构[3]。
枸杞子为茄科植物宁夏枸杞(Lycium bar-barum L.)的干燥成熟果实,具有滋补肝肾、益精明目的功效,是一种常见的药食同源的中药材。现代药理学研究表明,枸杞多糖(Lycium barbarumpolysaccharides,LBPs)是枸杞的主要活性成分,具有增强免疫功能、抗肿瘤、抗氧化、抗衰老、抗肝损伤、降血糖等多种生物学活性或药理作用[4‐7]。多项研究表明,LBPs可促进树突状细胞(dentritic cells,DCs)的分化和成熟,其活性可能与分子量大小有关[8‐10]。课题组前期试验采用膜分离技术从枸杞粗多糖中分离得到不同分子量的枸杞多糖组分(LBP2、LBP3、LBP4和LBP5)[11]。本文比较不同分子量的多糖组分促进DCs成熟的差异,筛选出活性最强的组分,为枸杞多糖的进一步研究和利用提供依据。
1 材料与方法
1.1 材料
1.1.1 供试品LBPs组分:不同分子量LBPs组分由广州泽力生物技术有限公司通过膜透析技术分离纯化所得。按照分子量的大小分别为LBP2(分子量350~400 kD,糖66.88%,水12.8%)、LBP3(分子量40~350 kD,糖54.47%,水14.59%)、LBP4(分子量8~40 kD,糖56.53%,水14.88%)、LBP5(分子量3~8 kD,糖55.21%,水15.85%)。
1.1.2 试剂RPMI1640培养基(Gibco公司);胎牛血清(Biological Industries公司);Murine GM‐CSF和Murine IL‐4(PerproTech公 司);PE/Cy7 anti‐mouse CD11c antibody、FITC anti‐mouse CD80 antibody、PE anti‐mouse MHCⅡ(I‐A)、PE/Cy5 anti‐mouse CD86 antibody(eBioscience公司);脂多糖LPS(Sigma‐Al-drich公司);Cytometric Bead Array(CBA)Mouse In-flammation Kit(BD公司)。
1.1.3 仪器SW‐CJ‐2FD型超净工作台(江苏苏净安泰公司);L535R型台式冷冻离心机(湖南湘仪实验室仪器开发有限公司);FACSCantoⅡ流式细胞仪(BD公司);MCO‐20AIC型CO2培养箱(SANYO公司);BDS 300型倒置生物显微镜(重庆奥特光学仪器有限公司);Multiskan FC型酶标仪(Thermo公司)。
1.1.4 实验动物SPF级雄性C57BL/6小鼠,6~8周龄,体重18~22 g,由广东省医学实验动物中心提供,动物许可证号SCXK(粤)2013‐0002。
1.2 方法
1.2.1 小鼠骨髓源DCs的原代培养参照《免疫学技术及其应用》中的培养条件,即10~20 ng/ml GM‐CSF和1 ng/ml IL‐4,本研究初步比较原代细胞培养条件,通过检测其特异性表型获得纯度最好的未成熟DCs[12]。具体操作过程如下:无菌取C57BL/6小鼠股骨和胫骨,RPMI1640基础培养基反复冲洗骨髓腔,收集骨髓细胞置于离心管中。将获得的骨髓细胞通过400目不锈钢筛网过滤后,离心(300 g,5 min,4℃),弃上清。加入2 ml红细胞裂解液,混匀,1 min后离心(300 g,5 min,4℃),弃上清。再用RPMI1640基础培养基洗涤骨髓细胞2次。设置3个组别的培养条件,分别为A组(GM‐CSF 10 ng/ml,IL‐4 1 ng/ml)、B组(GM‐CSF 20 ng/ml,IL‐4 2 ng/ml)、C组(GM‐CSF 20 ng/ml,IL‐4 1 ng/ml)。将细胞因子溶解于RPMI1640完全培养基并达到设定浓度值,重悬细胞并调整浓度为1×106个/ml,以4 ml/孔接种于6孔培养板,置于细胞培养箱培养。3 d后进行全量换液,补充含特定浓度细胞因子的RPMI1640完全培养基。在第5天到第7天期间,每1~2 d半量换液1次。第8天收集半悬浮细胞,加入CD11c PE/cy7 anti‐mouse抗体。涡旋,常温下孵育20 min后,流式细胞仪收集1万个细胞,检测CD11c阳性细胞的比例进行纯度鉴定。
1.2.2 Griess法观察LBPs不同组分对DCs释放NO的影响收集1.2.1中A组未成熟的DCs,以含10% FBS的RPMI1640完全培养基重悬细胞,将细胞浓度调整为1×106个/ml接种于96孔板,100µl/孔。分组如下:正常组(Control组)、LPS组(0.1µg/ml),枸杞多糖LBP2、LBP3、LBP4、LBP5组(各组分剂量分别为25、50、100、200µg/ml)。加药后,将细胞置于细胞培养箱中培养24 h后吸取细胞培养液上清,按NO试剂盒说明书操作,酶标仪测定540 nm波长下OD值。根据标准品拟合出标准曲线,并换算实际的NO浓度值。
1.2.3 CBA法检测LBPs不同组分对DCs分泌细胞因子的影响DCs在成熟过程中会分泌多种细胞因子,包括IL‐6、IL‐10、MCP‐1、IFN‐γ和TNF‐α等。为了研究LBP2、LBP3、LBP4、LBP5对DCs分泌细胞因子的影响,分别加入25µg/ml的LBPs各组分刺激DCs,24 h后收集培养液上清,另加入浓度为0.1µg/ml的LPS作为对照,根据试剂盒说明书,CBA法检测培养液上清IL‐6、IL‐10、MCP‐1、IFN‐γ和TNF‐α的浓度。
1.2.4 流式细胞术检测LBP3对DCs表面分子表达的影响DCs在成熟过程中,会伴随MHCⅡ、CD40、CD80和CD86等表达升高。LBP3在LBPs几个组分中表现出最强的诱导DCs成熟的活性。课题组既往研究表明,与其他组分相比,LBP3表现出更强的抗肿瘤及促进巨噬细胞活化作用[11,13]。故本部分对LBP3诱导DCs表型成熟的作用进行验证。收集1.2.1中A组的未成熟DCs,将细胞浓度调整为2×105个/ml,以0.5 ml/孔接种于24孔板。设置Con-trol组、LPS(0.1 µg/ml)组、LBP3(25、50、100、200µg/ml)组,共6个分组。加药刺激24 h后,收集DCs至流式管并离心(300 g,5 min,4℃)。添加CD11c PE/cy7 anti‐mouse,MHCⅡPE anti‐mouse,CD80 FITC anti‐mouse,CD86 PE/cy5 anti‐mouse抗体,将抗体与细胞混合涡旋,常温下孵育20 min。离心,弃上清,400µl PBS涡旋细胞。流式细胞术检测CD11c+MHCⅡ+、CD11c+CD80+、CD11c+CD86+DCs的表达情况。
1.3 统计学处理采用SPSS18.0统计软件进行处理,数据以±s表示。组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠骨髓来源DCs的体外诱导及培养由表1可知,小鼠骨髓细胞在A(GM‐CSF 10 ng/ml,IL‐4 1 ng/ml)、B(GM‐CSF 20 ng/ml,IL‐4 2 ng/ml)、C(GM‐CSF 20 ng/ml,IL‐4 1 ng/ml)3种培养条件下均可被诱导为未成熟DCs,A组诱导条件下CD11c+DC的比例高于B组和C组,达到82.1%,故后续研究均采用10 ng/ml GM‐CSF,1 ng/ml IL‐4条件诱导培养未成熟DCs。
显微镜下观察在A组诱导条件下的细胞形态如图1,自第3天起,细胞开始变得不规则并贴附在培养板底部,细胞集落逐渐形成。至第8天,半悬浮细胞变得更为密集,且细胞较为饱满,形态不规则,与相关文献报道的未成熟DC形态相符[13‐14]。
2.2 Griess法检测LBPs各组分对DCs释放NO的影响如图2所示,除LBP2外,LBP3、LBP4、LBP5均可剂量依赖性地促进未成熟DCs释放NO。与其他3个LBPs组分相比,LBP3刺激DCs释放NO的能力最强,差异具有统计学意义(P<0.05或P<0.01)。
2.3 CBA法检测枸杞多糖各组分对DCs释放细胞因子的影响如图3所示,LBP2的活性较低(P>0.05);LBP3和LBP5均可促进DCs分泌IL‐6、IL‐10、MCP‐1、IFN‐γ和TNF‐α(P<0.05或P<0.01);LBP4能促进DCs分泌IL‐6、MCP‐1和TNF‐α(P<0.01)。此外,对4种多糖组分刺激DCs分泌细胞因子进行比较分析,除LBP3刺激DCs分泌的MCP‐1浓度低于LBP5外(P<0.01),其他细胞因子浓度均高于另外3种多糖组分。
表1 不同培养条件对CD11+DCs比例的影响(±s,n=3)Tab.1 Proportion of CD11+DCs under different culture conditions(±s,n=3)

表1 不同培养条件对CD11+DCs比例的影响(±s,n=3)Tab.1 Proportion of CD11+DCs under different culture conditions(±s,n=3)
Note:Compared with control group,1)P<0.001.
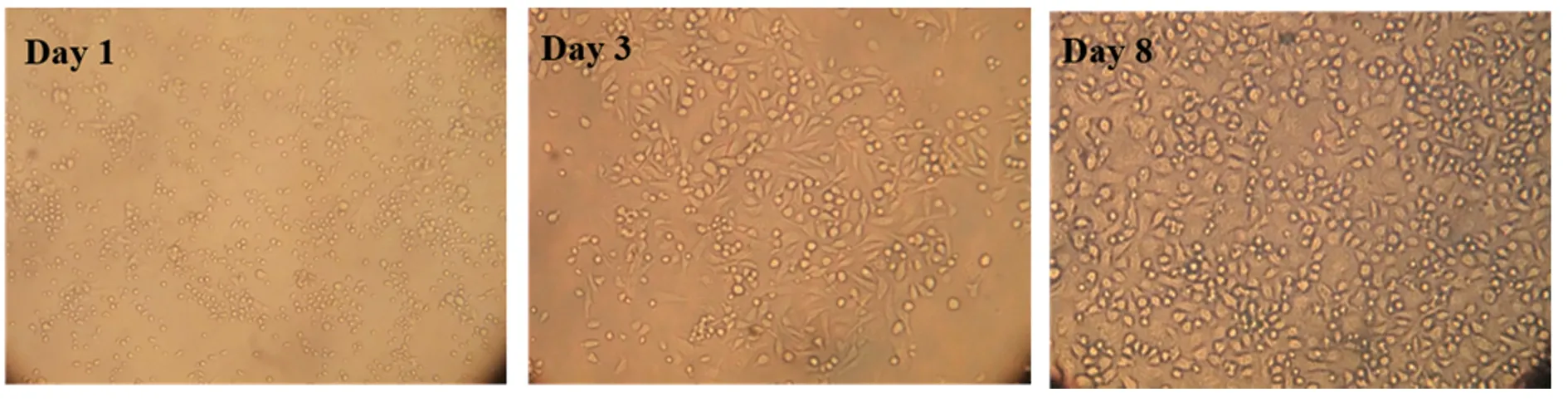
图1 10 ng/ml GM‐CSF联合1 ng/ml IL‐4诱导未 成熟DCs的细胞形态(×200)Fig.1 Morphology of immature DCs induced by 10 ng/ml GM‐CSF and 1 ng/ml IL‐4(×200)
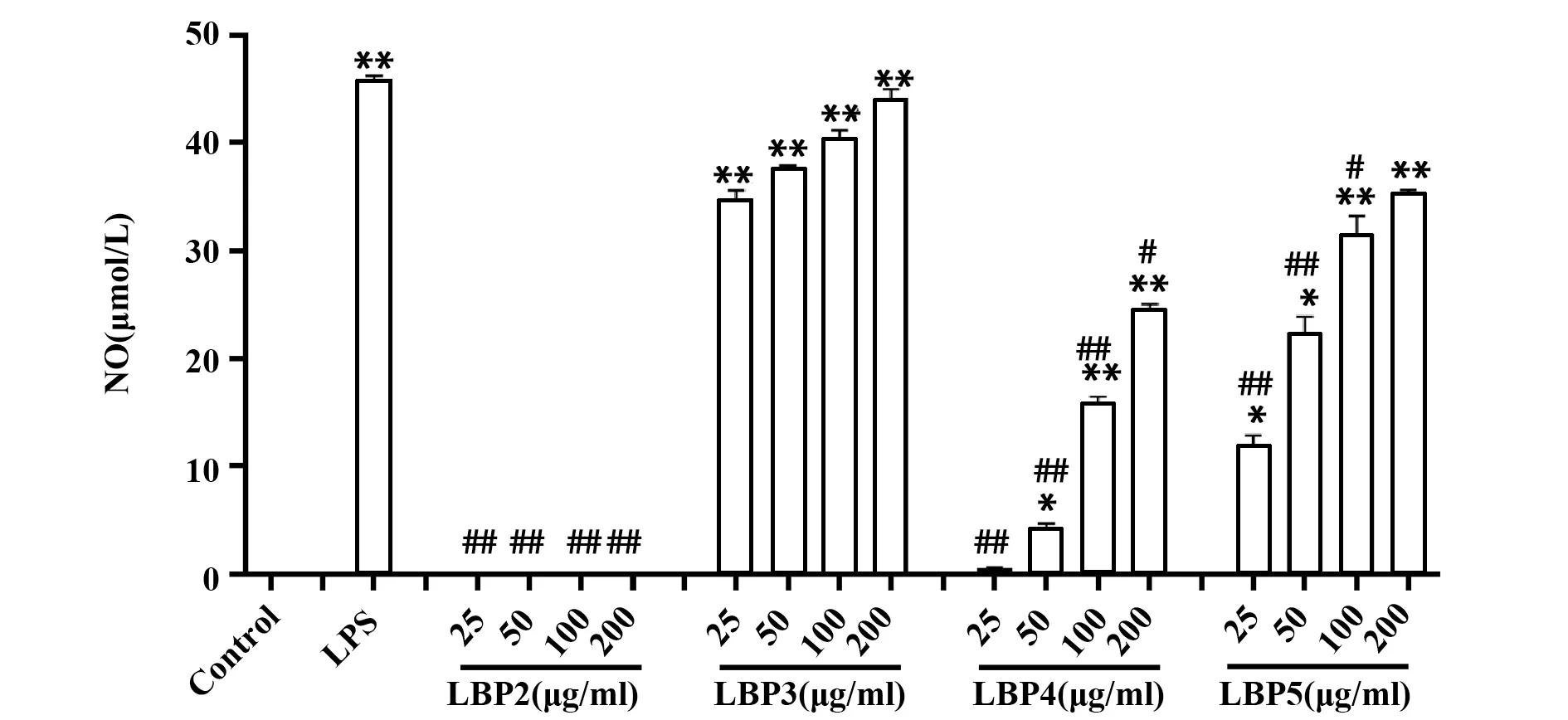
图2 LBPs不同分子组分对DCs分泌NO的影响Fig.2 Effects of different LBPs fractions on production of NO in culture supernatants of DCs

图3 LBPs不同组分对DCs分泌的细胞因子的影响Fig.3 Effects of different LBPs fractions on production of cytokines in culture supernatants of DCs
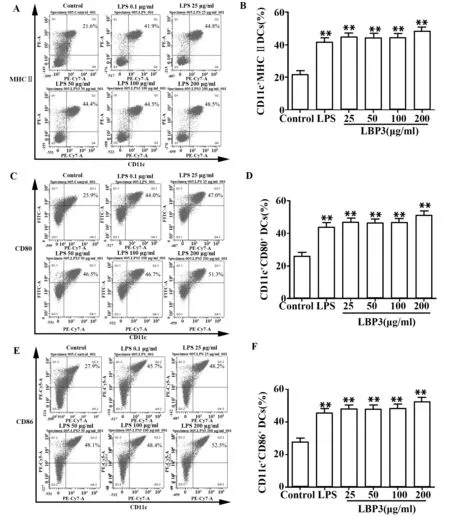
图4 LBP3对DCs表面分子表达的影响Fig.4 Effect of LBP3 on cell surface molecule expression on DCs

图5 LBP3对DCs表面分子MFI的影响Fig.5 Effects of LBP3 on MFI of cell surface molecule in DCs
2.4 流式细胞术检测LBP3对DCs表面分子表达的影响如图4所示,LBP3的各剂量均可有效提高CD11c+DCs中MHCⅡ+、CD80+、CD86+表达水平(P<0.01);与空白组相比,LBP3刺激后的DC表面分子CD11c、MHCⅡ、CD80和CD86的 平 均 荧 光 强 度(mean fluorescence intensity,MFI)均显著增强(P<0.05或P<0.01)。见图5。表明LBP3具有良好的诱导DCs成熟的活性。
3 讨论
研究证实,LBPs具有良好的免疫调节和抗肿瘤功能[14‐15]。在课题组前期分离得到的5种不同分子量LBPs组分中,由于LBP1含糖量偏低,且不易溶于水,故本研究只对余下的4种水溶性多糖组分LBP2、LBP3、LBP4和LBP5进行比较。
DCs是机体主要的抗原递呈细胞之一,通过递呈抗原激活T细胞,诱导适应性免疫应答。但DCs在体内数量极少,从体内分离DCs耗时较长且细胞产量极低,不利于开展相关研究。利用小鼠骨髓中的前体细胞加外源性细胞因子组合定向诱导培养,是目前体外获得大量DCs的主要方法,在研究DC的生物学功能方面具有重要的意义[16]。目前体外诱导DCs的培养条件尚无统一标准,本研究结果显示,10 ng/ml GM‐CSF联 合1 ng/ml IL‐4是 诱 导CD11c+DCs的最佳条件。
DCs的成熟与否是发挥生理功能的先决条件[17]。未成熟的DCs表面低表达MHCⅡ类分子和共刺激分子,具有较强的抗原摄取和加工能力;成熟的DCs具有较强的抗原递呈能力,可将抗原信息提呈给T细胞从而诱导T细胞产生特异性免疫应答[18]。有研究报道,在DCs被激活后由未成熟状态转变为成熟状态的过程中,伴随着NO的释放及IL‐1β、IL‐6、TNF‐α、IL‐12、IL‐10和MCP‐1等细胞因子的分泌增加[19‐20]。本研究中,经过不同分子量的枸杞多糖组分刺激后,DCs释放的NO及分泌的IL‐6、IL‐10、MCP‐1、IFN‐γ和TNF‐α含量显著增加,尤以LBP3作用明显,以上结果表明LBPs能诱导DCs成熟,且LBP3在这4种组分中活性最强。
成熟的DCs高表达MHCⅡ类分子和共刺激分子[21]。本研究中LBP3促进DCs表面分子CD11c、MHCⅡ、CD80和CD86表达,进一步证实LBP3可促进DCs成熟。
以上研究表明LBPs可明显促进DCs成熟,且其作用活性与分子量密切相关,以分子量为40~350 kD的LBPs组分(LBP3)为佳,但相关机制尚需进一步研究。