柚皮素通过ROS/P38‐MAPK信号通路调控肺癌A549细胞增殖及凋亡①
2021-05-26张悦姚宇梁玉灵王文军西南医科大学附属医院呼吸与危重症医学科泸州646000
张悦 姚宇 梁玉灵 王文军(西南医科大学附属医院呼吸与危重症医学科,泸州 646000)
肺癌是目前发病率和死亡率最高的恶性肿瘤,是癌症死亡的首要原因[1]。虽然目前肺癌有多种治疗手段,但肺癌的5年总体生存率仍很低,选择手术治疗、放化疗、靶向治疗等常规治疗方法的患者预期生存率依旧差强人意[2]。目前研究表明,由于细胞增殖与凋亡的平衡被扰乱而导致肿瘤的形成,细胞过度增殖的重要原因是细胞凋亡受阻,细胞凋亡在许多疾病的正常发展和病理过程中起着至关重要的作用,凋亡的研究对肿瘤的防治有重要意义[3]。抗肿瘤药物可通过促进肿瘤细胞凋亡进而抑制肿瘤恶化进展,同时还可影响肿瘤细胞放疗敏感性[4]。虽然化疗是目前临床上治疗肺癌的常用手段,但因其可产生耐药性和毒副作用[5],导致多数患者无法完成有效的放化疗周期,所以应致力于研究新的预防和治疗肺癌的天然药物[6]。研究表明,如紫杉醇等天然药物对于抗肿瘤的治疗有着很好的疗效,所以,寻找新型抗肿瘤的天然药物意义重大[7]。柚皮素是天然柑橘类水果中最丰富的类黄酮之一,具有抑制乳腺癌、结肠癌、胃癌和前列腺癌细胞生长的能力[8]。但是,目前柚皮素对肺癌细胞增殖及凋亡的相关研究较少,其调控机制尚不十分清楚,本研究旨在探讨柚皮素对A549细胞增殖及凋亡的影响,阐明其影响的可能机制,为柚皮素在临床上预防及治疗肺癌提供证据,现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂A549细胞来源于西南医科大学中心实验室;柚皮素(货号HY‐N0100)、p38丝裂原活化蛋白激酶抑制剂SB203580(SB)(货号HY‐10256)购自MCE;胎牛血清(FBS)(货号141215)购自杭州天杭生物科技有限公司,DMEM高糖培养基(货号SH30022)购自HyClone;总超氧化物歧化酶(T‐SOD)测试盒(羟胺法)(货号A001‐1‐1)、丙二醛(MDA)测定试剂盒(TBA法)(货号A003‐1)购自南京建成;CCK‐8试剂盒(货号C0038)、Annexin V‐FITC凋亡检测试剂盒(货号AO2001‐02P‐G)购自天津三箭生物技术有限公司;活性氧(ROS)检测试剂盒(货 号S0033)购 自Beyotime,GADPH(货 号ab37168)、Nrf2(货号#12721)、HO‐1(货号10701‐0‐AP)、NQO1(货号ab80588)、P‐P38(货号#4511)、P38(货号#8690)、Cleaved capase3(货号ab49822)购自Abcam;HRP‐Goat anti Rabbit(货 号AS1107)购 自ASPEN;RIPA总蛋白裂解液(货号AS1004)、BCA蛋白质浓度测定试剂盒(货号AS1086)、ECL化学发光检测试剂盒(货号AS1059)购自ASPEN。
1.1.2 主要仪器CO2恒温培养箱购自SHEL LAB,倒置显微镜购自OLYMPUS;酶标检测仪购自Diatek;流式细胞仪购自BD;离心机购自湖南湘仪实验室仪器开发有限公司;电泳仪购自北京市六一仪器厂。
1.2 方法
1.2.1 细胞培养将A549细胞置于含10%FBS的RPMI1640培养液中,孵育于37℃、5%CO2的培养箱,当细胞已长满培养瓶时,将培养瓶从培养箱中取出,用PBS洗涤2次。
1.2.2 CCK‐8法将细胞用胰蛋白酶消化,以10 000个/孔接种于96孔板中,孵育于37℃下CO2(5%)培养箱中24 h以贴壁,继续培养24 h后分别更换为100µl细胞样品分别对应的含有柚皮素(30、60、90、120µmol/L)的培养基,对照组更换为含溶剂的培养基,在每孔中加入10 µl CCK‐8溶液孵育2 h后使用酶标仪测定450 nm光吸收值以测定细胞活力。细胞存活率%=(实验组-空白组)/(对照组-空白组)×100%。
1.2.3 流式细胞术取对数生长期的A549细胞,在6孔板中培养,分别用(0、30、60、90、120µmol/L)柚皮素处理48 h后,再收集各组培养液于流式管中,用PBS洗涤1遍,然后加入胰酶消化细胞后再加入培养基终止消化;再收集各组细胞于上一步的流式管中,300 g离心5 min,弃去上清后加入1 ml PBS重新悬浮细胞,再300 g离心5 min,弃去上清,沉淀用300µl的Binding Buffer重悬,按照试剂盒操作说明检测细胞凋亡,采用流式细胞仪获得分析结果,实验重复3次。
细胞分组同上,按照1∶1 000用无血清培养液稀释DCFH‐DA,使终浓度为10µmol/L。用PBS洗3遍,加入1 ml稀释好的DCFH‐DA,37℃孵育20 min,充分去除未进入细胞内的DCFH‐DA后,再加入1 ml HG培养基,显微镜下观察拍照或流式上机以检测ROS含量。
1.2.4 WST‐8法、TBA法细胞分组同上,用旋涡混匀器充分混匀,置于37℃恒温水浴40 min,于波长550 nm处,1 cm光径比色,测各管吸光度值以检测SOD活性;用旋涡混匀器充分混匀,95℃沸水水浴40 min,取出后流水冷却,按3 500~4 000 r/min,离心10 min,于波长523 nm处测各管吸光度值以检测MDA含量,实验重复3次。
1.2.5 Western blot法取对数生长期的A549细胞,分别用(0、30、60、90、120µmol/L)柚皮素以及柚皮素120 µmol/L+SB(10 µmol/L)处理48 h后,收集各组细胞,用细胞总蛋白提取试剂(RIPA)裂解各组细胞提取总蛋白,使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度;将转好的膜加入封闭液,室温封闭1 h后,除去封闭液,加入用一抗稀释液稀释好的一抗4℃过夜,回收已稀释的一抗,用TBST洗3次,每次5 min加入二抗稀释液稀释好的二抗,室温孵育30 min,用TBST在室温下摇床上洗4次,每次5 min,然后化学发光检测,使用AlphaEaseFC软件处理系统分析目标带的光密度值。
1.3 统计学处理所有资料采用SPSS22.0软件对实验数据进行分析,所得到的数值以±s表示,多样本均数间比较采用单因素方差分析,其中两两比较采用LSD-t法,检验水准α=0.05。
2 结果
2.1 CCK‐8法检测结果与对照组相比,柚皮素组可抑制A549细胞增殖,且随浓度增加,增殖抑制作用更明显(P<0.05),方差分析显示5组的存活率差异具有统计学意义(F=70.782,P<0.001),见图1、表1。
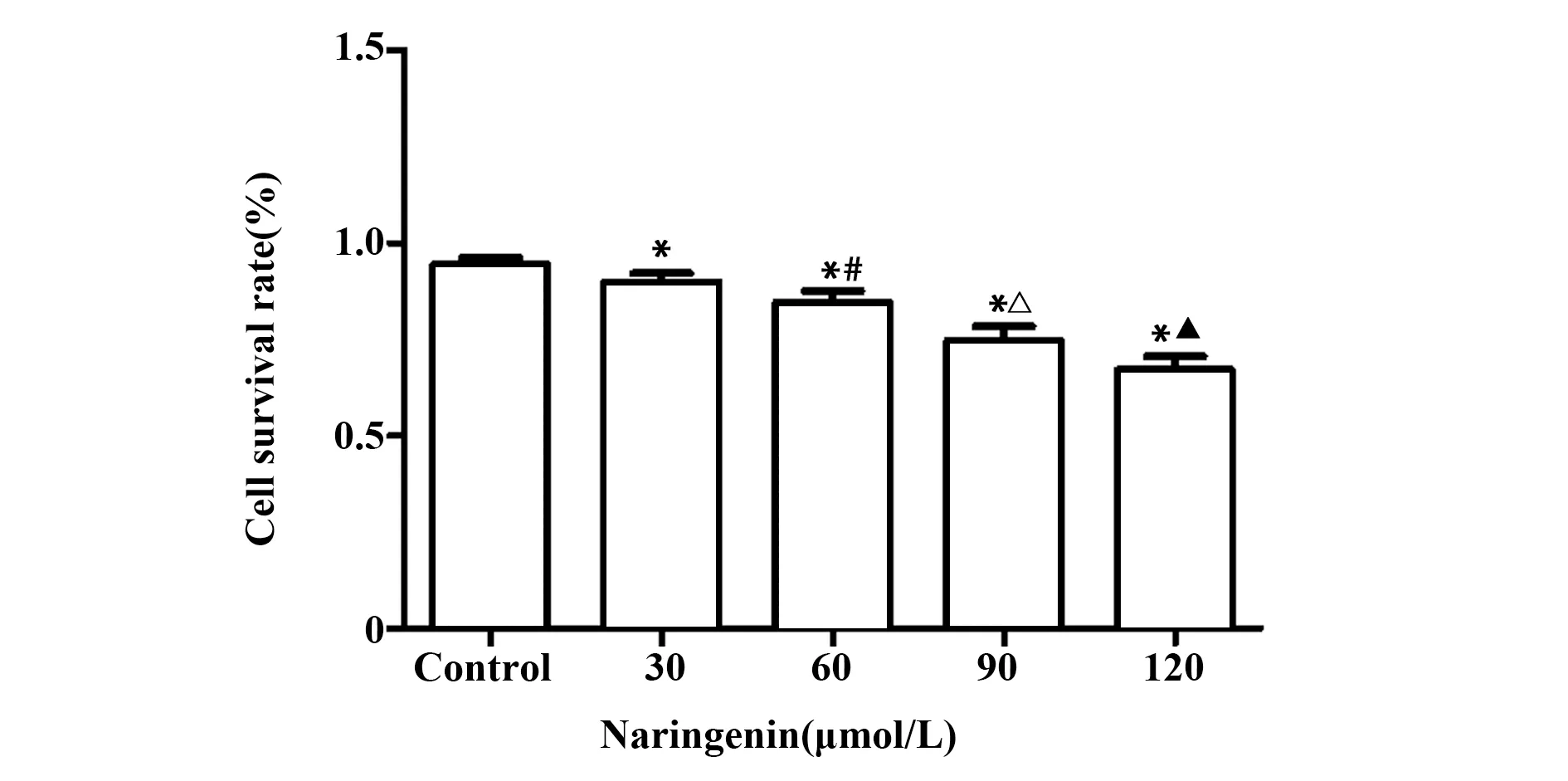
图1 不同浓度的柚皮素对A549的细胞增殖的影响Fig.1 Effect of Nar at different concentrations on prolif-eration of A549 cells

图2 不同浓度的柚皮素对A549的细胞凋亡的影响Fig.2 Effect of Nar on apoptosis of A549 cells
2.2 流式细胞仪检测结果与对照组相比,随着柚皮素浓度增加,A549细胞凋亡逐渐增加(P<0.001),方差分析显示5组差异具有统计学意义(P<0.001),见图2。与对照组相比,不同浓度柚皮素组MFI的表达升高(P<0.001),且随柚皮素浓度增加,MFI呈明显升高趋势,方差分析显示5组差异具有统计学意义(F=178.220,P<0.001),见图3。
表1 不同浓度柚皮素作用下细胞活力的比较(±s,%)Tab.1 Comparison of cell viability under different con-centrations of Nar(±s,%)

表1 不同浓度柚皮素作用下细胞活力的比较(±s,%)Tab.1 Comparison of cell viability under different con-centrations of Nar(±s,%)
Note:Compared with control group,1)P<0.05;compared with 30µmol/L Nar,2)P=0.010;compared with 60µmol/L Nar,3)P<0.001;compared with 90µmol/L Nar,4)P=0.001.
Cell viability 100.00±0.000 95.262±0.4781)89.855±0.4981)2)79.402±0.8061)3)70.264±0.7471)4)70.782 Groups Control 30µmol/L Nar 60µmol/L Nar 90µmol/L Nar 120µmol/L Nar F value n 3 3 3 3 3
2.3 WST‐8法、TBA法结果与对照组相比,不同浓度柚皮素组SOD活性均下降(P<0.05),且随柚皮素浓度增加,SOD活性呈明显下降趋势,方差分析5组差异具有统计学意义(F=76.847,P=0.000),与对照组相比,不同浓度柚皮素组MDA含量均升高(P<0.05),且随柚皮素浓度增加,MDA含量呈现明显升高趋势,方差分析显示5组差异具有统计学意义(F=50.589,P=0.000),见图4、5。
2.4 Western blot检测结果
2.4.1 实验结果显示,与对照组相比,柚皮素组Nrf2、NQO1和HO‐1表达水平随着柚皮素浓度(30、60、90、120µmol/L)的增加而显著降低,方差分析显示5组差异具有统计学意义(F值分别为55.063、93.609、192.155,P<0.001),见图6。

图4 柚皮素对A549细胞中SOD活性的影响Fig.4 Effect of Nar on SOD acitivity in A549 cells
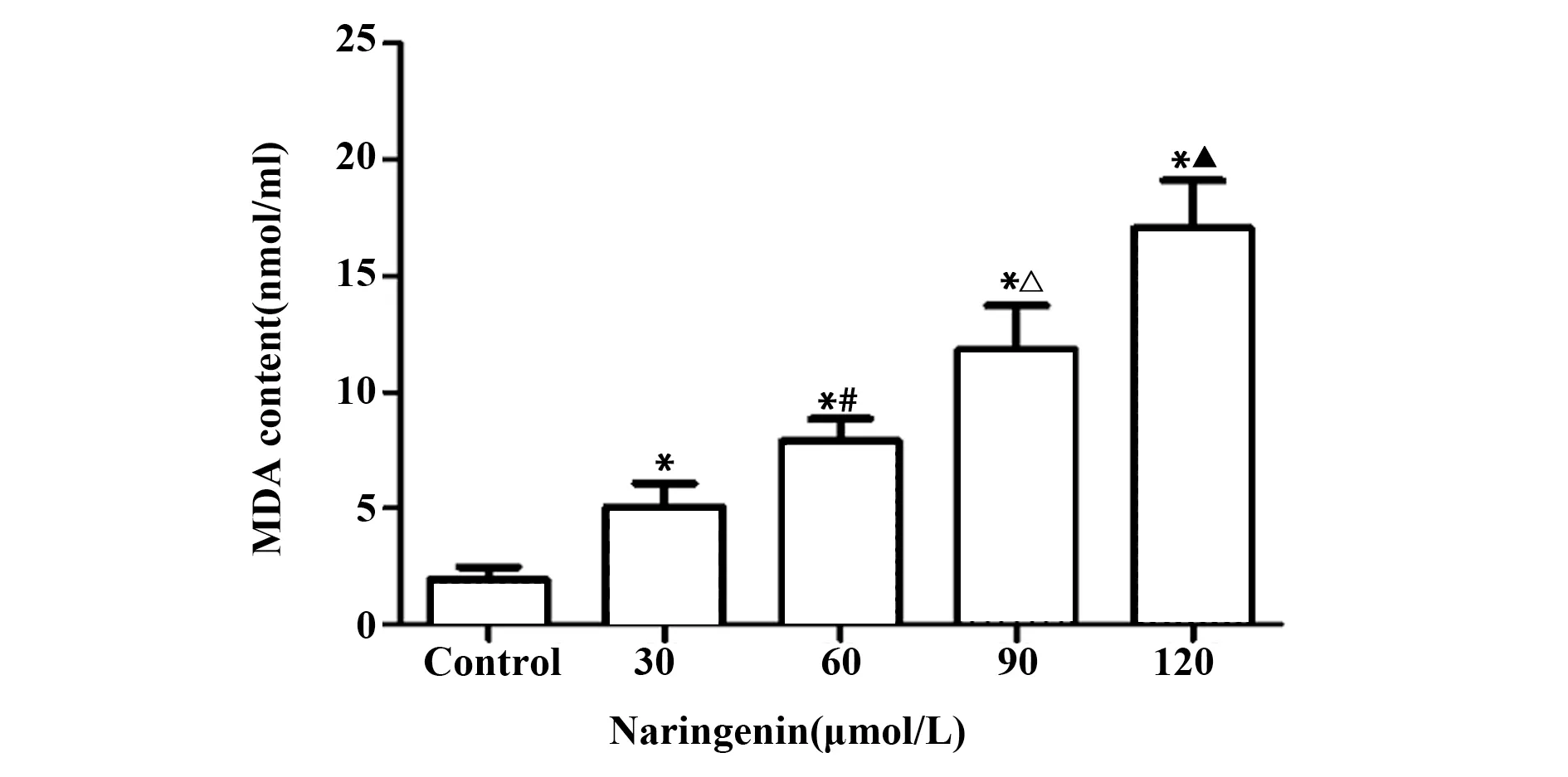
图5 柚皮素对A549细胞中MDA含量的影响Fig.5 Effects of Nar on MDA content in A549 cells
2.4.2 与对照组比较,柚皮素组P38 MAPK蛋白的磷酸化水平以及caspase‐3蛋白的活化水平随着柚皮素浓度(30、60、90、120 µmol/L)的增加而显著升高,方差分析5组差异具有统计学意义(F=108.073,P<0.001),两两比较显示,与90µmol/L、120µmol/L柚皮素组相比,抑制剂组P38 MAPK蛋白的磷酸化水平和caspase‐3蛋白活化水平降低(P<0.05),与30µmol/L、60µmol/L柚皮素组相比,差异无统计学意义(P>0.05),见图7。

图6 不同浓度的柚皮素对A549细胞中Nrf2、NQO1和HO‐1蛋白表达的影响Fig.6 Effects of Nar of different concentrations on expres-sion of Nrf2,NQO1 and HO‐1 in A549 cells

图7 不同浓度柚皮素对P‐P38 MAPK蛋白和caspase‐3蛋白表达的影响Fig.7 Effect of Nar in different concentrations on expres-sion of p‐p38 MAPK and caspase‐3 protein
3 讨论
柚皮素是黄酮类化合物家族的一员,富含于柑橘类水果和西红柿,具有多种预防性治疗特性[9]。已有研究表明,柚皮素在体内外对细胞有多种有益的作用,如抗病毒、抗癌、抗炎和心脏保护等[10]。最近研究发现,黄酮类化合物及其代谢物可发挥细胞内作用,包括直接调节细胞信号通路,包括丝裂原活化蛋白激酶(MAPK)级联反应[11]。研究发现,柚皮素可通过抑制PI3K/AKT通路中PI3K活性、降低含半胱氨酸的天冬氨酸蛋白水解酶(caspase)‐31的活性来促进乳腺癌的凋亡,阻断细胞周期并调节AKT及NF‐κB信号通路抑制乳腺癌细胞的增殖[12]。临床上,随着柚皮素摄入量的增加,癌症的总发病率显著降低[13]。本研究显示,柚皮素可呈浓度依赖性的抑制A549细胞增殖,并促使其凋亡。
研究表明,细胞膜脂质过氧化是高活性氧引起的主要氧化反应之一,导致丙二醛(MDA)的产生,活性氧(ROS)的产生与MDA水平的升高明显相关,超氧化物歧化酶(SOD)是一种重要的抗氧化酶,其活性反映了其清除氧自由基的能力[14‐15];本研究显示,柚皮素可使A549细胞中SOD活性降低,同时使A549细胞中ROS、MDA的含量升高,且均呈浓度依赖性,因此可能是由于A549细胞对ROS的清除能力下降,进而导致细胞氧化应激损伤,这显示柚皮素促使细胞凋亡的机制可能是氧化应激反应。ROS负责JNK和p38通路的激活,从而导致细胞中其他促凋亡分子水平的升高[16]。本研究探讨了柚皮素是否可以诱导细胞内ROS的生成,并检测了细胞内ROS的水平,结果显示,柚皮素可以升高细胞内ROS水平,并呈浓度依赖性,并且可促使A549细胞发生凋亡。
p38丝裂原活化蛋白激酶(P38 MAPK)是哺乳动物的MAPKs之一,在肿瘤的发生发展中起着关键作用,可调节细胞增殖、分化、凋亡等[17‐18]。研究表明,MAPKs可以调节Nrf2的激活和HO‐1基因的表达[19]。Nrf2是一种碱性亮氨酸拉链基因子集,通过结合抗氧化反应元件(ARE),激活靶基因表达,如HO‐1、NQO1、SOD,在 抗 氧 化 应 激 中 起 重 要 作用[20‐21]。HO‐1主要受Nrf2调控,是由Nrf2向细胞核的转移及其与HO‐1启动子的相互作用[22]。NQO1可以防止氧化应激,通常,NQO1表达较低,然而在氧化应激的情况下,细胞保护是通过激活ROS信号通路,导致多种下游因子的上调,包括NQO1,因此,NQO1是作为系统细胞氧化还原状态的重要标志[23]。本研究表明,柚皮素可浓度依赖地下调Nrf2、NQO1和HO‐1蛋白表达水平,这表明柚皮素可能通过P38 MAPK通路诱导A549细胞发生氧化应激反应。
ROS可通过激活MAPK激酶和抑制MAPK磷酸酶等多种途径导致p38 MAPK的持续活化[24],例如,研究显示,紫草素可导致细胞内ROS的积累增加,导致线粒体膜电位损失、氧化损伤以及JNK和P38 MAPK通路的激活,进而导致A549细胞凋亡,呋喃酮可通过ROS介导的JNK和P38 MAPK通路激活,诱 导 结 直 肠 癌 细 胞 凋 亡[25]。SHIN[26]显 示,p38 MAPK抑制剂SB可阻断ROS引发的A549细胞凋亡。本研究发现柚皮素能显著提高(p)‐p38 MAPK水平,激活p38 MAPK信号通路,活化A549细胞中p38 MAPK和caspase‐3,浓 度 依 赖 地 下 调Nrf2、NQO1和HO‐1蛋白表达水平,因此,柚皮素可能通过增加磷酸化(p)‐p38 MAPK的表达诱导A549细胞凋亡。此外,SB可抑制该信号通路传导途径,显著降低柚皮素诱导的A549细胞的Nrf2、NQO1和HO‐1表 达 水 平,也 证 明 了Nrf2、NQO1和HO‐1受p38 MAPK信号通路的调控,提示柚皮素可能通过ROS/p38 MAPK通路诱导A549细胞发生凋亡。
综上所述,本研究探讨了柚皮素可对A549细胞产生增殖抑制作用和凋亡促进作用,并呈浓度依赖性,主要作用机制可能与其抑制了SOD的活性,导致细胞内ROS、MDA的含量升高,并下调相关蛋白的表达,从而与激活p38 MAPK信号通路相关。