桃叶珊瑚苷通过调控miR‐30a‐5p表达对高糖诱导的肾小管上皮细胞损伤的影响
2021-05-26王殿云卢聪聪范国霞东营市人民医院中医科东营257091
王殿云 卢聪聪 范国霞(东营市人民医院中医科,东营 257091)
糖尿病是一种常见的代谢疾病,据报道大约30%~40%的糖尿病患者会发展为糖尿病肾病[1]。由于糖尿病患者人数众多,糖尿病肾病患者人数也相对较高[2]。糖尿病肾病是由于高血糖对肾脏功能的长期影响所致,是慢性肾脏病的主要原因,当前治疗(包括血糖控制和血压控制)效果并不令人满意[3]。众所周知,肾小管细胞损伤是糖尿病肾病的主要特征之一,肾小管细胞被证明是糖尿病肾病的主要靶标。糖尿病肾病表现为多阶段病理表现,探索高糖下肾小管损伤的潜在机制可能是阻断糖尿病肾病进程的有效治疗策略[4]。研究表明,桃叶珊瑚苷(aucubin,AU)通过抑制MAPKs炎症信号通路对脂多糖(lipopolysaccharide,LPS)所致人脐静脉血管内皮细胞损伤产生一定保护作用[5]。桃叶珊瑚苷可下调LPS诱导的小鼠肺组织中TNF‐α的表达,上调抗炎因子IL‐10表达,改善小鼠急性肺损伤[6]。桃叶珊瑚苷通过降低IL‐1β和核因子κB的表达,保护脑出血后的神经元损伤[7]。微小RNA(microRNA,miRNA)‐30a‐5p在缺氧复氧诱导的HK‐2细胞损伤中下调表达,上调其表达可抑制缺氧复氧诱导的HK‐2细胞氧化应激和细胞凋亡[8]。miR‐30a‐5p在脊髓损伤小鼠模型中低表达,过表达miR‐30a‐5p可抑制炎症反应[9]。桃叶珊瑚苷和miR‐30a‐5p对高糖诱导的肾小管上皮细胞损伤的影响以及桃叶珊瑚苷是否通过调控miR‐30a‐5p的表达影响高糖诱导的肾小管上皮细胞损伤目前还尚未可知。因此,本研究在体外培养人肾小管上皮细胞HK‐2,针对桃叶珊瑚苷在高糖诱导的肾小管上皮细胞凋亡和炎症中的作用与机制进行探讨,旨在为糖尿病肾病提供新的见解。
1 材料与方法
1.1 材料桃叶珊瑚苷(纯度≥95%)购自中国食品药品检定研究院;人肾小管上皮细胞HK‐2购自美国典型培养物保藏中心;胎牛血清购自美国Sigma公司;IL‐1β、肿瘤坏死因子‐α(TNF‐α)购自美国BD Bioscience;磷脂酰结合蛋白V‐FITC(Annexin V‐FITC)/碘化丙啶(propidium iodide,PI)检测试剂盒购自南京凯基生物技术有限公司;Taqman MicroR-NA Reverse Transcription Kit、二辛可宁酸(bicincho-ninic acid,BCA)蛋白测定试剂盒、增强的化学发光试剂购自美国Thermo Fisher Scientific;Taqman Uni-versal Master MixⅡ购自德国Roche Applied Sci-ence;Lipofectamine 2000购自美国Invitrogen;miR‐30a‐5p、miR‐NC、anti‐miR‐30a‐5p、anti‐miR‐NC购 自上海GenePharma公司。
1.2 方法
1.2.1 细胞培养与高糖损伤HK‐2细胞用含10%的胎牛血清RPMI1640培养基,于5% CO2的37℃恒温培养箱中培养。HK‐2细胞在96孔板中以5×104个/孔的密度孵育,在无血清培养基中饥饿24 h后,将HK‐2细胞用高葡萄糖(30 mmol/L)培养48 h,以诱导高糖损伤[10]。
1.2.2 细胞分组与处理HK‐2细胞被分为Con组(正常对照,5.5 mmol/L葡萄糖)、HG组(高糖,30 mmol/L葡萄糖)、HG+AU‐L、AU‐M、AU‐H组(30 mmol/L葡 萄 糖+25 µmol/L、50 µmol/L、100 µmol/L桃叶珊瑚苷[5])、HG+miR‐NC组(30 mmol/L葡萄糖+转染miR‐NC)、HG+miR‐30a‐5p组(30 mmol/L葡萄糖+转染miR‐30a‐5p)、HG+AU+anti‐miR‐NC组(30 mmol/L葡萄糖+100 µmol/L桃叶 珊 瑚 苷+转 染anti‐miR‐NC)、HG+AU+anti‐miR‐30a‐5p组(30 mmol/L葡萄糖+100µmol/L桃叶珊瑚苷+转染anti‐miR‐30a‐5p)。其中,葡萄糖和桃叶珊瑚苷作用时间为48 h。按照Lipofectamine 2000使用 说 明,将miR‐30a‐5p、miR‐NC、anti‐miR‐30a‐5p、anti‐miR‐NC转染HK‐2细胞。转 染24 h后,收 集HK‐2细胞,通过逆转录定量聚合酶链反应(Reverse transcription‐quantitative polymerase chain reaction,RT‐qPCR)检测转染效率。随后,将转染24 h的HK‐2细胞给予高糖和桃叶珊瑚苷处理,48 h后收集HK‐2细胞进行后续检测。
1.2.3 ELISA检测炎症因子IL‐1β、TNF‐α的表达收集每组HK‐2细胞上清液,使用ELISA试剂盒检测IL‐1β和TNF‐α水平。
1.2.4 Annexin V‐FITC/PI双染法检测细胞凋亡HK‐2细胞用胰蛋白酶消化,收集并在冰冷的PBS中洗涤,并在500 µl结合缓冲液中(含有5 µl PI和5 µl AnnexinV‐FITC)染色,在黑暗中保持20 min。流式细胞仪测定荧光信号,然后通过FlowJo软件进行凋亡分析。
1.2.5 Western blot分析Bcl‐2、Bax蛋白表达HK-2细胞的总蛋白使用RIPA裂解缓冲液(补充蛋白酶抑制剂混合物)提取,并使用BCA蛋白测定试剂盒定量。用SDS‐PAGE分离蛋白质(40 µg),转移到PVDF膜上。将膜在含有5%脱脂牛奶的Tris‐HCl‐Tween缓冲盐溶液中室温封闭1 h,然后与一抗Bcl‐2(1∶1 000)、Bax(1∶1 000)和GAPDH(1∶1 000)孵育,再与辣根过氧化物酶标记的二抗(1∶2 000)孵育。使用增强的化学发光试剂测定蛋白条带。GAPDH为上样对照。
1.2.6 RT‐qPCR测 定miR‐30a‐5p表 达使 用TRIzol试剂从各组的HK‐2细胞中提取总RNA,用Taqman microRNA逆转录试剂盒合成cDNA,并使用Taqman Universal Master MixⅡ进行RT‐qPCR。引物序 列 如 下:miR‐30a‐5p F 5'‐GGGCCTGTAAA-CATCCTCG‐3',R 5'‐GAATACCTCGGACCCTGC‐3';U6 F 5'‐GGTCGGGCAGGAAAGAGGGC‐3',R 5'‐GC-TAATCTTCTCTGTATCGTTCC‐3'。U6为miR‐30a‐5p的内部参考,使用2-ΔΔCt方法计算miR‐30a‐5p的相对表达水平。
1.3 统计学分析采用SPSS22.0软件对数据进行统计分析,以±s表示。独立样本t检验、单因素方差分析和LSD‐t检验用于数据差异比较,P<0.05为差异具有统计学意义。
2 结果
2.1 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2炎症因子表达的影响结果显示,与Con组比较,HG组肾小管上皮细胞HK‐2中IL‐1β、TNF‐α表达急剧增加;给予25µmol/L、50µmol/L、100µmol/L桃叶珊瑚苷后,相较于HG组,HG+AU‐L、HG+AU‐M、HG+AU‐H组 肾小管上 皮细胞HK‐2中IL‐1β、TNF‐α表达逐渐降低,并呈浓度依赖性;上述差异均具有统计学意义(P<0.05)。见表1。
2.2 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响结果显示,与Con组比较,HG组肾小管上皮细胞HK‐2凋亡率增加,Bcl‐2蛋白表达降低,Bax蛋白表达升高;给予25、50、100µmol/L桃叶珊瑚苷后,相较于HG组,HG+AU‐L、HG+AU‐M、HG+AU‐H组肾小管上皮细胞HK‐2凋亡率逐渐减少,Bcl‐2蛋白表达逐渐升高,Bax蛋白表达逐渐降低,且呈浓度依赖性;上述差异均具有统计学意义(P<0.05)。见图1、表2。
2.3 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2中miR‐30a‐5p表达的影响结果显示,HG组肾 小 管 上 皮 细 胞HK‐2中miR‐30a‐5p表 达 水 平(0.32±0.02)显著低于Con组(1.00±0.06);给予25、50、100 µmol/L桃叶珊瑚苷后,HG+AU‐L、HG+AU‐M、HG+AU‐H组肾小管上皮细胞HK‐2中miR‐30a‐5p表达水平逐渐高于HG组,且呈浓度依赖性;上述差异均具有统计学意义(P<0.05)。见表3。
2.4 miR‐30a‐5p过表达对高糖诱导的肾小管上皮细胞HK‐2炎症因子表达的影响结果显示,HG+miR‐30a‐5p组肾小管上皮细胞HK‐2中miR‐30a‐5p表达水平高于HG+miR‐NC组,IL‐1β和TNF‐α表达低于HG+miR‐NC组;上述差异均具有统计学意义(P<0.05)。见表4。
表1 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2炎症因子表达的影响(±s,n=9)Tab.1 Effect of aucubin on expression of inflammatory factors in renal tubular epithelial cells HK‐2 in-duced by high glucose(±s,n=9)
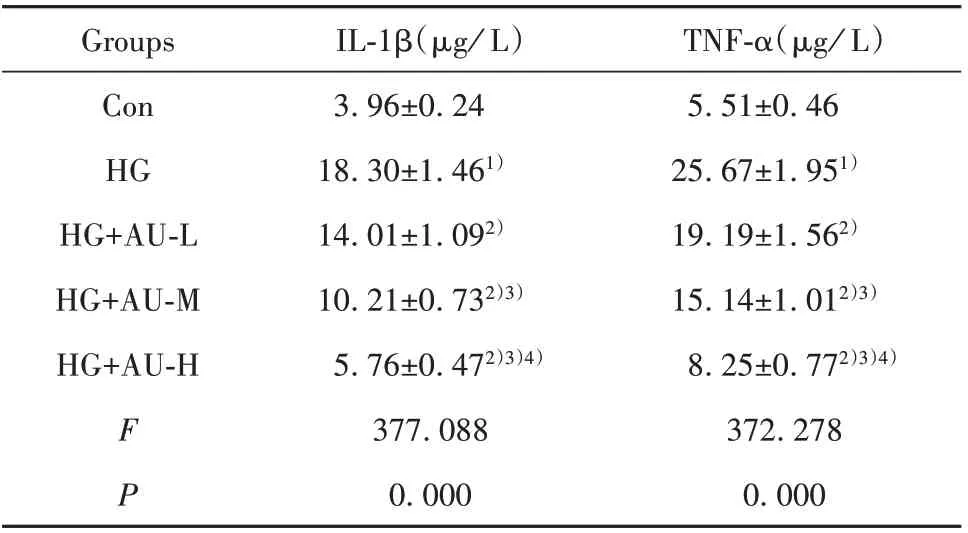
表1 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2炎症因子表达的影响(±s,n=9)Tab.1 Effect of aucubin on expression of inflammatory factors in renal tubular epithelial cells HK‐2 in-duced by high glucose(±s,n=9)
Note:Compared with Con group,1)P<0.05;compared with HG group,2)P<0.05;compared with HG+AU‐L group,3)P<0.05;com-pared with HG+AU‐M group,4)P<0.05.
?

图1 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响Fig.1 Effect of aucubin on apoptosis of renal tubular epi-thelial cells HK‐2 induced by high glucose
2.5 miR‐30a‐5p过表达对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响结果显示,HG+miR‐30a‐5p组肾小管上皮细胞HK‐2凋亡率比HG+miR‐NC组低,Bcl‐2蛋白表达水平比HG+miR‐NC组高,而Bax蛋白表达水平比HG+miR‐NC组低;上述差异均具有统计学意义(P<0.05)。见表5、图2。
表2 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响(±s,n=9)Tab.2 Effect of aucubin on apoptosis of renal tubular ep-ithelial cells HK‐2 induced by high glucose(±s,n=9)

表2 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响(±s,n=9)Tab.2 Effect of aucubin on apoptosis of renal tubular ep-ithelial cells HK‐2 induced by high glucose(±s,n=9)
Note:Compared with Con group,1)P<0.05;compared with HG group,2)P<0.05;compared with HG+AU‐L group,3)P<0.05;com-pared with HG+AU‐M group,4)P<0.05.
?
表3 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2中miR‐30a‐5p表达的影响(±s,n=9)Tab.3 Effect of aucubin on expression of miR‐30a‐5p in renal tubular epithelial cells HK‐2 induced by high glucose(±s,n=9)
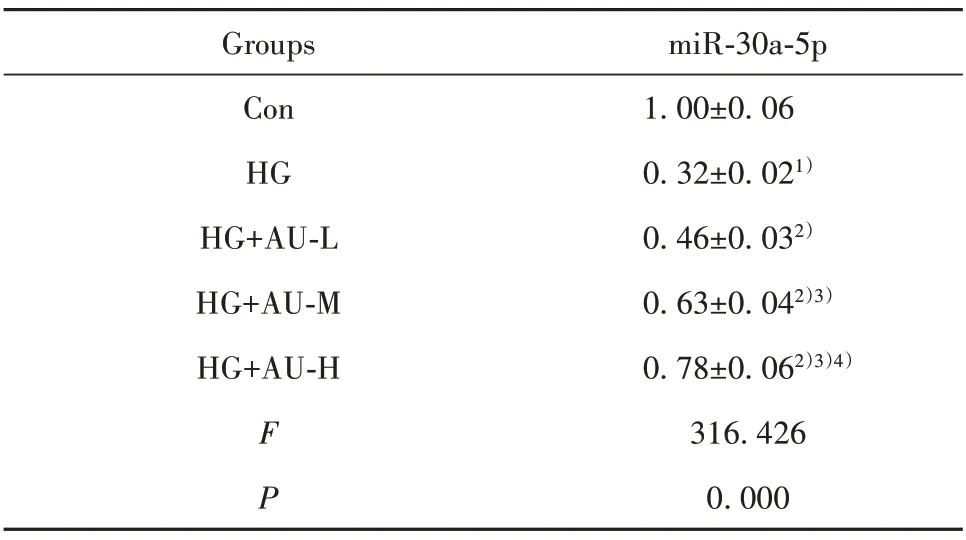
表3 桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2中miR‐30a‐5p表达的影响(±s,n=9)Tab.3 Effect of aucubin on expression of miR‐30a‐5p in renal tubular epithelial cells HK‐2 induced by high glucose(±s,n=9)
Note:Compared with Con group,1)P<0.05;compared with HG group,2)P<0.05;compared with HG+AU‐L group,3)P<0.05;com-pared with HG+AU‐M group,4)P<0.05.
?
2.6 抑 制miR‐30a‐5p表 达 逆 转 了 桃 叶 珊 瑚 苷(100 μmol/L)对高糖诱导的肾小管上皮细胞HK‐2损伤的作用与HG+AU+anti‐miR‐NC组比较,HG+AU+anti‐miR‐30a‐5p组 肾 小 管 上 皮 细 胞HK‐2中miR‐30a‐5p表达水平减少,IL‐1β、TNF‐α表达和细胞凋亡率均升高,Bcl‐2蛋白表达水平降低及Bax蛋白表达水平升高;上述差异均具有统计学意义(P<0.05)。见表6、图3。
表4 miR‐30a‐5p过表达对高糖诱导的肾小管上皮细胞HK‐2炎症因子表达的影响(±s,n=9)Tab.4 Effect of miR‐30a‐5p overexpression on expression of inflammatory factors in HK‐2 renal tubular epi-thelial cells induced by high glucose(±s,n=9)

表4 miR‐30a‐5p过表达对高糖诱导的肾小管上皮细胞HK‐2炎症因子表达的影响(±s,n=9)Tab.4 Effect of miR‐30a‐5p overexpression on expression of inflammatory factors in HK‐2 renal tubular epi-thelial cells induced by high glucose(±s,n=9)
Note:Compared with HG+miR‐NC group,1)P<0.05.
?
表5 miR‐30a‐5p过表达对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响(±s,n=9)Tab.5 Effects of miR‐30a‐5p overexpression on apopto-sis of renal tubular epithelial cells HK‐2 induced by high glucose(±s,n=9)
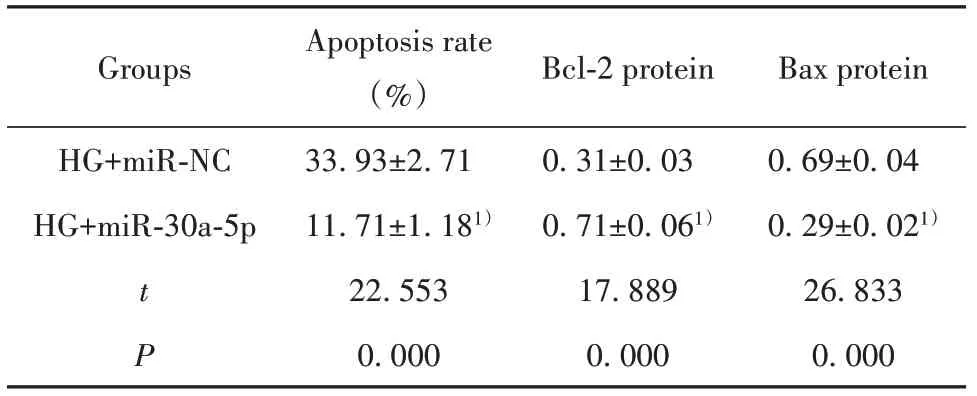
表5 miR‐30a‐5p过表达对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响(±s,n=9)Tab.5 Effects of miR‐30a‐5p overexpression on apopto-sis of renal tubular epithelial cells HK‐2 induced by high glucose(±s,n=9)
Note:Compared with HG+miR‐NC group,1)P<0.05.
?

图2 miR‐30a‐5p过表达对高糖诱导的肾小管上皮细胞HK‐2凋亡的影响Fig.2 Effect of overexpression of miR‐30a‐5p on apopto-sis of renal tubular epithelial cells HK‐2 induced by high glucose
表6 抑制miR‐30a‐5p表达逆转了桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2损伤的作用(±s,n=9)Tab.6 Inhibition of miR‐30a‐5p expression reversed effect of aucubin on HK‐2 injury of renal tubular epithelial cells in-duced by high glucose(±s,n=9)
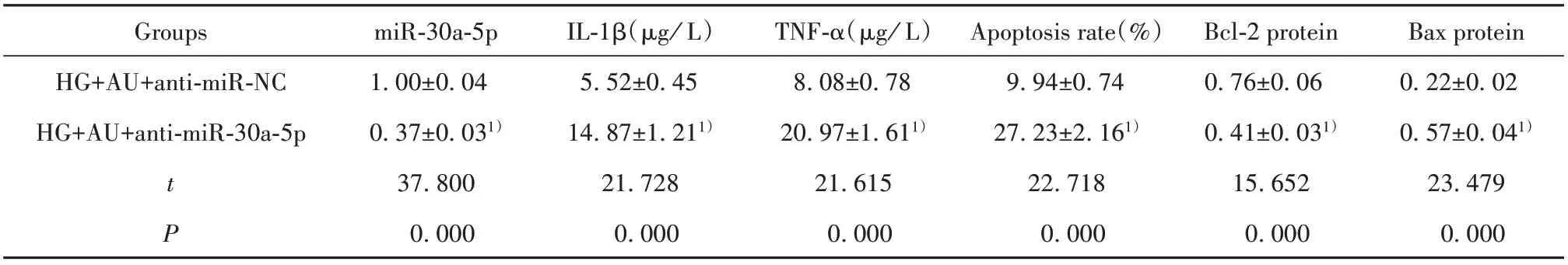
表6 抑制miR‐30a‐5p表达逆转了桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2损伤的作用(±s,n=9)Tab.6 Inhibition of miR‐30a‐5p expression reversed effect of aucubin on HK‐2 injury of renal tubular epithelial cells in-duced by high glucose(±s,n=9)
Note:Compared with HG+AU+anti‐miR‐NC group,1)P<0.05.
Bax protein 0.22±0.02 0.57±0.041)23.479 0.000 Groups HG+AU+anti‐miR‐NC HG+AU+anti‐miR‐30a‐5p t P miR‐30a‐5p 1.00±0.04 0.37±0.031)37.800 0.000 IL‐1β(µg/L)5.52±0.45 14.87±1.211)21.728 0.000 TNF‐α(µg/L)8.08±0.78 20.97±1.611)21.615 0.000 Apoptosis rate(%)9.94±0.74 27.23±2.161)22.718 0.000 Bcl‐2 protein 0.76±0.06 0.41±0.031)15.652 0.000
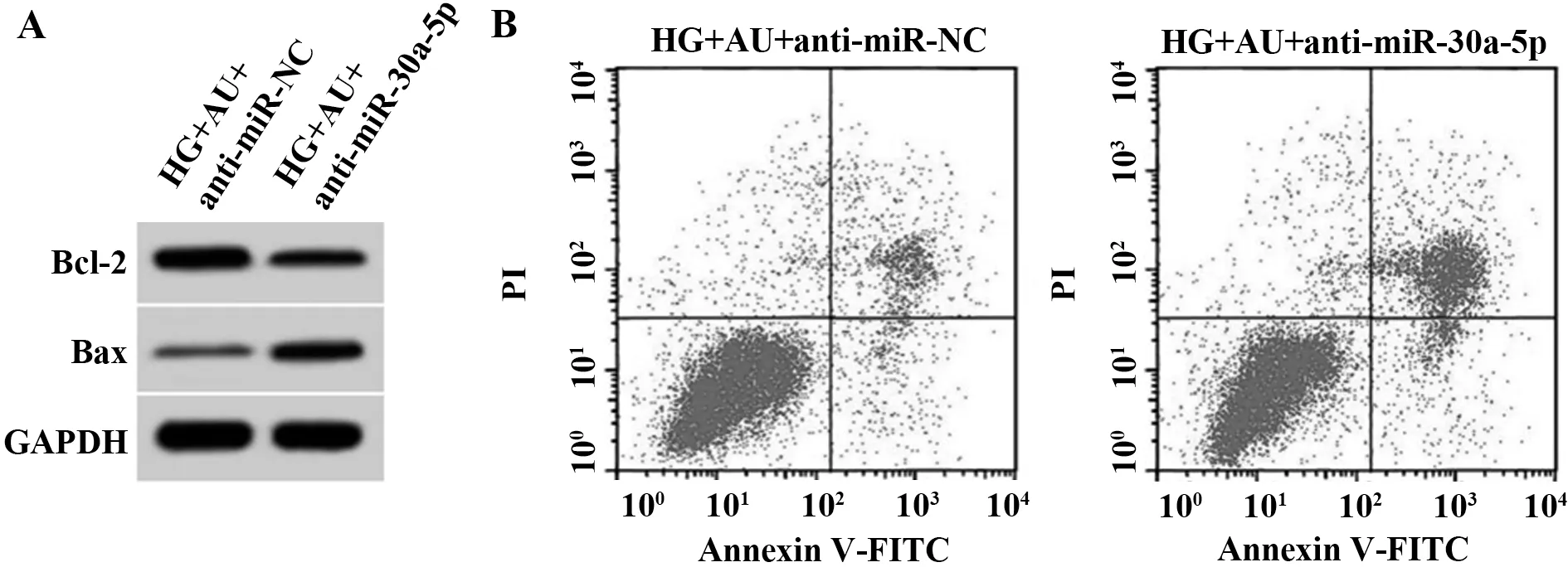
图3 抑制miR‐30a‐5p表达逆转了桃叶珊瑚苷对高糖诱导的肾小管上皮细胞HK‐2凋亡的作用Fig.3 Inhibition of miR‐30a‐5p expression reversed ef-fect of aucubin on apoptosis of renal tubular epi-thelial cells HK‐2 induced by high glucose
3 讨论
糖尿病肾病的早期表现为肾肥大、肾小球和肾小管基底膜增厚及其他明显的病理特征。随着疾病的进展,它逐渐演变为肾小管间质纤维化的肾小球细胞外基质积聚,并最终对肾脏结构造成不可逆的损害。研究表明,肾小管的变化可能先于肾小球,这表明肾小管可能是糖尿病肾病发展的关键因素[11]。近年来,肾小管细胞损伤已被认为是糖尿病肾病最关键的特征[12],但其潜在机制尚未明了。目前,炎症是糖尿病肾病的重要致病因素。糖尿病的高血糖环境可以诱导促炎反应,使大量的炎性细胞因子被释放,免疫细胞在肾组织中积聚和浸润,导致促炎性细胞因子的进一步合成[13]。例如,MA等[14]报告IL‐17A通过控制促炎性细胞因子(如TNF‐α、IL‐6、CCL2和CCL10)的表达参与高糖引起的肾损伤。细胞凋亡是正常细胞的死亡过程,其激活细胞反应以改变微环境,糖尿病肾病中不适当的细胞凋亡可能会触发病理过程[15]。ZHANG等[12]在人类糖尿病肾病中观察到了细胞凋亡。因此,抑制炎症损伤和凋亡可能是保护肾功能的有用策略。
桃叶珊瑚苷是一种高活性化合物,具有广泛的生物学作用,包括抗氧化、抗衰老、抗炎、抗纤维化、抗癌、保肝、神经保护和骨保护特性[16]。桃叶珊瑚苷可以抑制泰洛沙泊引起的小鼠中促炎细胞因子TNF‐α、IL‐1β和IL‐6释放,减少肝脏的炎症损害,显示出显著的抗炎活性[17]。桃叶珊瑚苷还可减弱IL‐1β诱导的软骨细胞凋亡,证明了其抗凋亡特性[18]。然而,桃叶珊瑚苷在高糖损伤肾小管上皮细胞中的有益作用还有待探索。在本研究中,高糖刺激人肾小管上皮细胞HK‐2在体外模拟糖尿病肾病,并伴有过度的炎症因子表达和细胞凋亡。此外,我们发现,25、50、100 µmol/L桃叶珊瑚苷治疗后,高糖诱导的HK‐2细胞的IL‐1β、TNF‐α表达、凋亡率、促凋亡蛋白Bax表达逐渐降低,而抗凋亡蛋白Bcl‐2表达逐渐升高,呈现浓度依赖性。表明桃叶珊瑚苷可以有效抑制高糖诱导的肾小管上皮细胞凋亡和炎症反应,对糖尿病肾病发挥一定的预防或治疗效果。
miRNA是长约21个核苷酸的单链非编码RNA,可通过与目标mRNA的3'UTR区碱基配对来诱导mRNA裂解或翻译抑制。研究表明,miRNA在糖尿病肾病病理生理中发挥作用,可能是糖尿病肾病治疗的有效靶标[19]。本研究检测到高糖诱导的肾小管上皮细胞miR‐30a‐5p表达被桃叶珊瑚苷显著上调,提示桃叶珊瑚苷保护高糖诱导下肾小管上皮细胞损伤的机制可能与miR‐30a‐5p有关。miR‐30a‐5p位于染色体区域6q13,既往研究报道,miR‐30a‐5p充当癌症的抑制剂,调节生长、迁移和各种肿瘤侵袭[20‐22]。此外,miR‐30a‐5p参与了由LPS介导的PC‐12细胞的炎症和凋亡过程[23]。在患有肾病综合征的儿童肾脏活检中,miR‐30a‐5p表达下调,可能与儿童肾病的发病机制有关[24]。然而,miR‐30a‐5p在糖尿病肾病中的作用尚未清楚。本研究中,miR‐30a‐5p被证明在高糖诱导的HK‐2细胞中被下调,这与其在肾病综合征中的下调相一致。miR‐30a‐5p过表达可保护肾小管上皮细胞免受高糖损伤,表现为细胞凋亡率、促凋亡蛋白Bax、IL‐1β、TNF‐α表达降低,抗凋亡蛋白Bcl‐2表达升高。此外,抑制miR-30a-5p表达后,桃叶珊瑚苷抑制高糖诱导的肾小管上皮细胞凋亡和炎症因子表达的作用被逆转。表明桃叶珊瑚苷通过miR-30a-5p,实现对高糖损伤肾小管上皮细胞的保护作用。
综上所述,桃叶珊瑚苷可能通过上调高糖诱导的肾小管上皮细胞中miR‐30a‐5p的表达,抑制细胞凋亡和炎症因子表达,从而保护高糖诱导的肾小管上皮细胞损伤。这些结果表明桃叶珊瑚苷在糖尿病肾病的治疗中具有潜在作用。