双齿围沙蚕(Perinereis aibuhitensis)主要器官的组织学观察及其生理功能研究*
2021-05-25宋静静刘天红刘洪军迟雯丹刘凯凯于道德
宋静静 刘天红 刘洪军 迟雯丹 刘凯凯 于道德
双齿围沙蚕()主要器官的组织学观察及其生理功能研究*
宋静静 刘天红 刘洪军 迟雯丹 刘凯凯 于道德①
(山东省海洋科学研究院 山东省海水养殖病害防治重点实验室 山东省海水健康养殖技术工程技术研究中心 青岛 266104)
采用组织学方法, 较系统地观察研究了双齿围沙蚕()主要器官的组织学特点。首次以组织学的形式表现出多毛类刚毛的细微结构——中空的短管状结构, 以及腹腔内主要器官组织学特性、位置关系及其可能的生理功能。结果表明: 双齿围沙蚕疣足拥有丰富的毛细血管网并着生刚毛; 循环系统发达, 由背腹大血管、环体节血管网和毛细血管网共同构成一个发达的循环系统, 这与其体节断裂存活、再生的进化机制相适应; 肌肉组织分为三种不同类型——环肌、纵肌和斜肌, 在三者协调配合下, 疣足、各体节及整个虫体的运动功能得以完善; 消化道由前向后的组织学变化, 主要体现为肌肉类型的变化以及肠道褶皱的逐渐丰富, 显示了形态与功能的高度适应性。本研究结果为更加系统掌握双齿围沙蚕的生物学特征奠定了基础, 并为其人工繁育、指示环境污染物情况提供了一定的科学依据。
双齿围沙蚕; 组织学特征; 刚毛; 疣足; 腹血管
双齿围沙蚕()隶属于环节动物门(Annelida)、多毛纲(Polychaeta)、游走目(Errantia)、沙蚕科(Nereidae)、围沙蚕属(), 是海洋底栖生物类群的主要物种之一。作为食物链中重要的一环, 沙蚕等多毛类发挥着重要的生态功能, 例如生物干扰作用(sediment bioturbation)(Scaps, 2002), 降解大型海藻碎屑(Kristensen, 2003), 分解有机物质, 释放营养物质回至环境中(Kristensen, 2001; Scaps, 2002; Batista, 2003), 疏松底质, 提高含氧量(Beesley, 2000)。由于沙蚕不易远距离迁徙, 酶活等生理指标较敏感, 可以很好地反映出其生活区域污染状况, 故近年来沙蚕等多毛类经常被用作反映环境健康程度的指示种(Bat, 2005; Dean, 2008; Bat, 2019)。
此外, 双齿围沙蚕具有丰富的营养成分, 在水产养殖和休闲渔业中被称为万能饵料。研究发现, 沙蚕类是各种对虾类亲体、亲鱼驯养和促熟不可缺少的饵料成分(Bray, 1992; Luis, 1995)。例如, 利用杂色刺沙蚕()作为生物饵料, 不仅能提高斑节对虾()亲虾的绝对产卵量, 还可大大提高卵子的质量和幼体的成活率(Briggs, 1994)。在欧鳎()亲鱼培育和繁殖实验中, 与紫贻贝()相比, 沙蚕不仅能够有效地诱导欧鳎亲鱼成熟, 还具有很好的诱食作用, 可显著提高亲鱼的摄食率(Cardinaletti, 2009)。
无论是选择双齿围沙蚕作为环境健康评价指示种, 通过观察其生理变化反应污染物情况, 还是进行人工繁育, 用于活体饵料, 这些研究均需建立在双齿围沙蚕生物学信息的基础之上。作为西太平洋区域的特有种, 双齿围沙蚕的形态学与组织学研究主要集中在国内。早在1983年, 范广钻等学者针对双齿围沙蚕雌性生殖腺发育开展了组织学观察(范广钻等, 1983), 可惜没有具体图片参考; 1992年陈灿忠等介绍了双齿围沙蚕繁殖过程中的生态特征(陈灿忠等, 1992); 柳敏海等(2005)较为详细地分析了双齿围沙蚕正常态形态参数; 直至2010年, 杨大佐等(2010)和宋贞坪等(2010)针对双齿围沙蚕配子发生过程以及消化系统等主要器官进行了组织学研究; 何润端等(2020)则进一步较为完整地阐述了双齿围沙蚕生活史过程及各时期发育特征。
本文在前人的研究基础上, 更加系统完善地从器官水平及系统水平分析了双齿围沙蚕组织学的结构特点, 尤其是作为多毛类运动的主要附属结构——刚毛的组织学特征, 以及沙蚕类发达循环系统特点与断裂、再生功能的适应性协同进化, 为沙蚕等多毛类的进一步研究提供结构和功能偶联的参考依据。同时探讨了不同固定方法对组织学观察的影响, 并围绕沙蚕的循环系统、肌肉组织、消化系统等器官的功能性展开讨论。
1 材料与方法
1.1 材料
本文所用双齿围沙蚕取自东营养殖基地。采集后进行筛选, 去除断裂、局部受伤等个体, 进行实验室暂养。暂养容器为长方形玻璃缸(长×宽×高: 50 cm× 40 cm×30 cm), 缸底铺细沙, 实验用水为青岛沙子口过滤海水, 盐度为31, 温度为(27±1) °C, 水体积为16 L。光暗周期为14 h : 10 h。
1.2 方法
挑选活力好的健康沙蚕个体, 分别利用Bouin’s液或10%中性甲醛两种方法固定48 h后, 流水冲洗10 min, 70%乙醇长期保存, 以横切为主进行常规石蜡切片(厚5—7 μm), H.E染色, 光学显微镜NikonYS-100观察, 使用显微镜目微尺测量组织结构大小, 并拍照存档。
2 结果与分析
2.1 外部器官结构组织学
2.1.1 体色与体壁 双齿围沙蚕的体壁相对较薄, 不透明, 表皮层含有黑色素颗粒(图1c, 黑框所示), 是构成沙蚕体色的主要色素物质之一。体壁由外及内分别为角质层、表皮层、肌肉层和壁体腔膜。
薄角质层与表皮层连接不紧密(图1d, 箭头所示), 在组织切片脱水及透明等处理过程中, 薄角质层常脱落而无法显示。角质层向内连接的表皮层为沙蚕体壁最为复杂的结构, 含有多种类型的细胞, 除柱形上皮细胞外(图1c, 黑框所示), 还包括杯状细胞(图1c, 箭头所示)、大量嗜碱性颗粒(图1b, 箭头所示)和特殊组织结构(图1d, 黑框所示)。其中, 嗜碱性颗粒深染为蓝色, 不具有细胞结构。特殊组织结构类似于双齿围沙蚕腹神经索结构, 但是细胞核形态与腹神经索内不同, 目前二者具体作用尚不清楚, 亟待进一步研究。
2.1.2 疣足(parapodium) 除了第一、第二体节属于单叶型疣足外, 双齿围沙蚕的疣足属于典型的双叶型疣足(biramous parapodium): 即具有背足刺和腹足刺(图2a, 箭头所示)支持的, 背(足)叶(图2a, ④—⑥所示)和腹(足)叶结构(图2a, ①—③所示)的疣足。如图2a, 背足刺和腹足刺为较粗的实心几丁质结构, 位于刚毛叶内部的刚毛囊形态为中空的短管状结构, 彼此分离、排列均一, 内具有毛原细胞(图2b, 箭头所示)。
疣足作为沙蚕运动和呼吸的器官, 富含血管和肌肉。疣足内毛细血管发达(图2c, 箭头所示)。肌肉主要以足刺肌为主, 作为支持疣足形态和运动的肌肉, 疣足肌主要分布于含有刚毛的背腹叶内, 在横切条件下, 疣足肌显示为环肌(图2d, 箭头所示), 与体壁的环肌相连接, 支持着足刺、疣足和刚毛的运动(图1a, 黑框所示)。
2.2 内部器官结构组织学
双齿围沙蚕的内部器官相对较少, 结构简单。从图3可以看到几乎所有的组织器官, 该图左侧为背部, 右侧为腹部。从图中可以看出, 背部纵肌的含量远远大于腹部。双齿围沙蚕背部纵肌发达, 其体积为腹部纵肌的二倍以上, 强大的背部肌肉对于机体能够起到很好的机械保护作用。此外, 背部纵肌在蠕动收缩过程中会对背部血管产生压力, 这也是沙蚕循环系统动力的来源(Reiber, 2009)。相对小体积的腹部纵肌则为其他内部组织器官, 如消化道、腹血管以及神经索留有足够的空间。背血管位于背部纵肌的中间, 受纵肌保护, 避免了受伤后大量失血; 腹血管下面紧贴着的是神经索, 二者受到腹部纵肌的保护, 处于体节最为安全的部位, 同时神经索能与腹血管以最快最近的方式发生联系, 后者为前者供给充足的营养物质和氧气等。
2.2.1 循环(血管)系统组织学 双齿围沙蚕等多毛类具有发达的开放式循环系统, 主要包括背血管、腹血管(图3)和连接两者的环状血管。在疣足以及其他组织器官中(包括肠道、肾管、神经索)还存在发达的毛细血管网络。
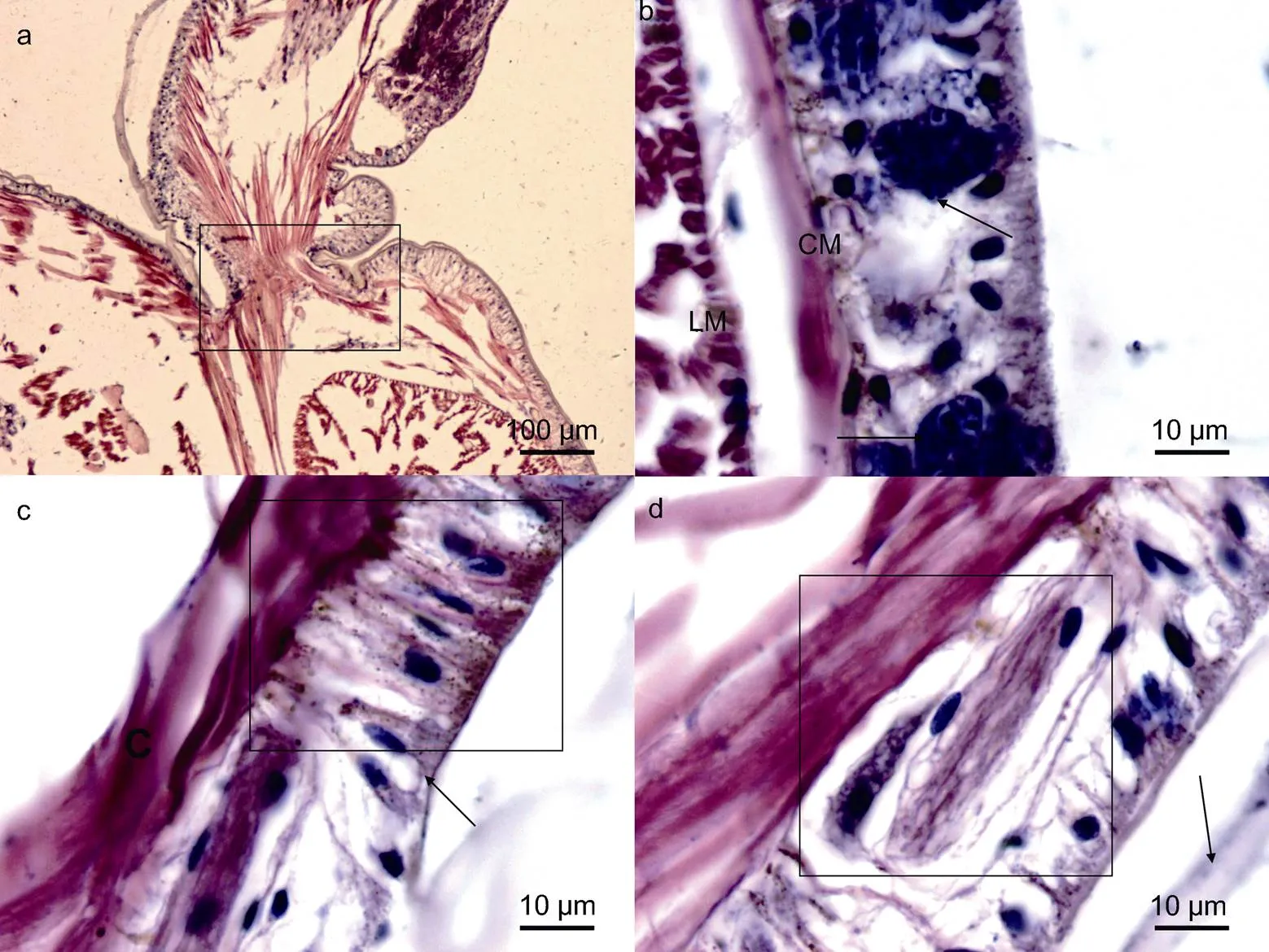
图1 双齿围沙蚕体壁的组织学结构
注: a. 示疣足内斜肌与体壁斜肌、环肌的关系, 黑框内示三者连续性, 无断裂; b. 示体壁上皮细胞内含有的嗜碱性颗粒(具体作用尚不清楚), 占据上皮层的大部分, 而将上皮细胞挤到周围, LM: 纵肌(longitudinal muscle), CM: 环肌(circular muscle); c. 黑框内示典型的体壁上皮结构——柱状上皮细胞, 细胞核中上位, 在靠近肌肉层和角质层分布有大量的小黑色素颗粒, 箭头示杯状细胞(分泌细胞); d. 黑框内示体壁上皮层中的特殊结构物质(与神经索结构类似, 细胞核梭型), 箭头示角质层
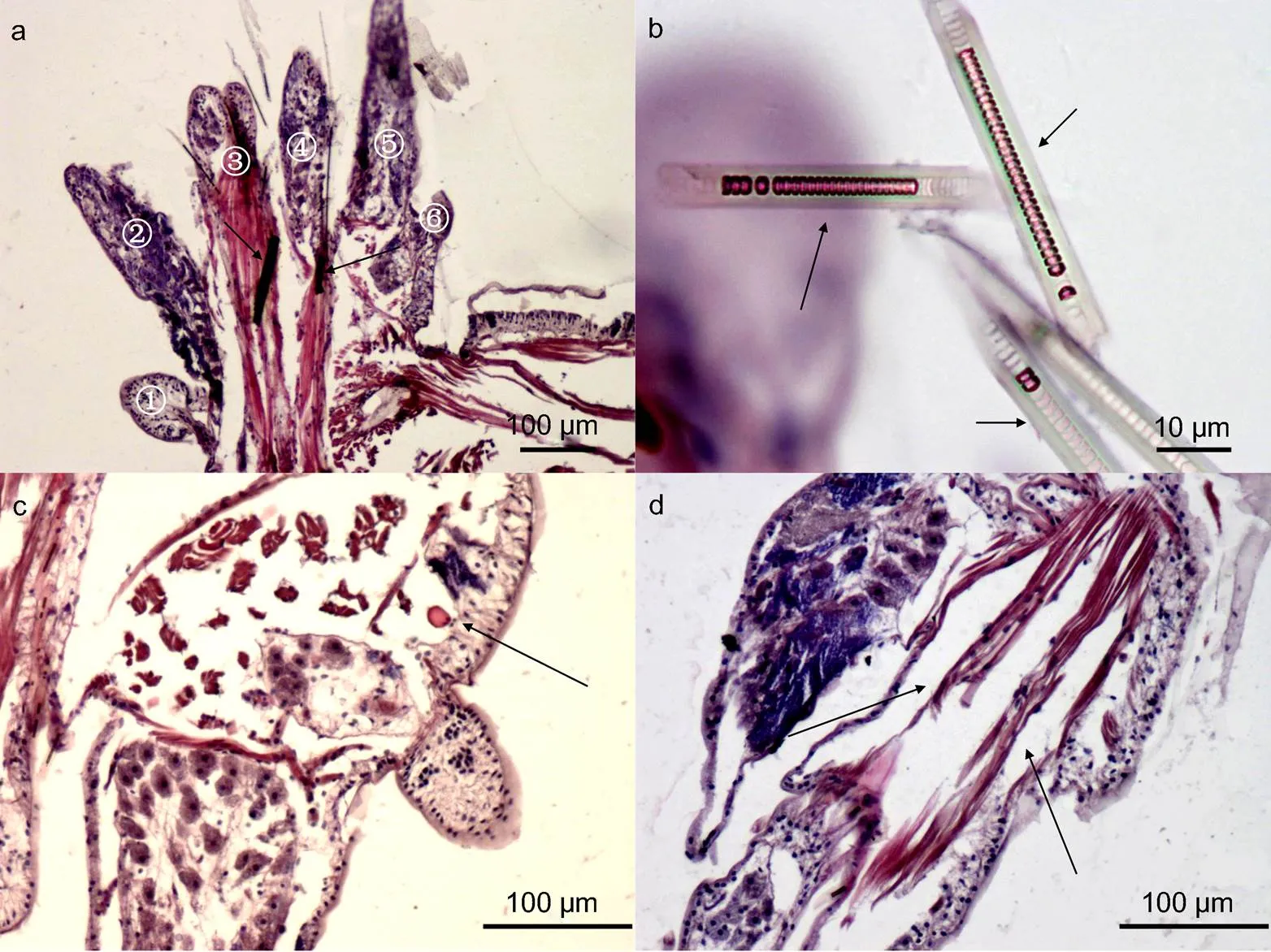
图2 双齿围沙蚕疣足的组织学结构
注: a. 示非繁殖态疣足组织学结构, ①—③为腹叶, ④—⑥为背叶, 箭头所指为足刺; b. 示疣足刚毛囊及内刚毛结构, 典型的圆环连接的管状; c. 示疣足内毛细血管, 可见纵肌的存在; d. 示疣足内斜肌, 为足刺肌
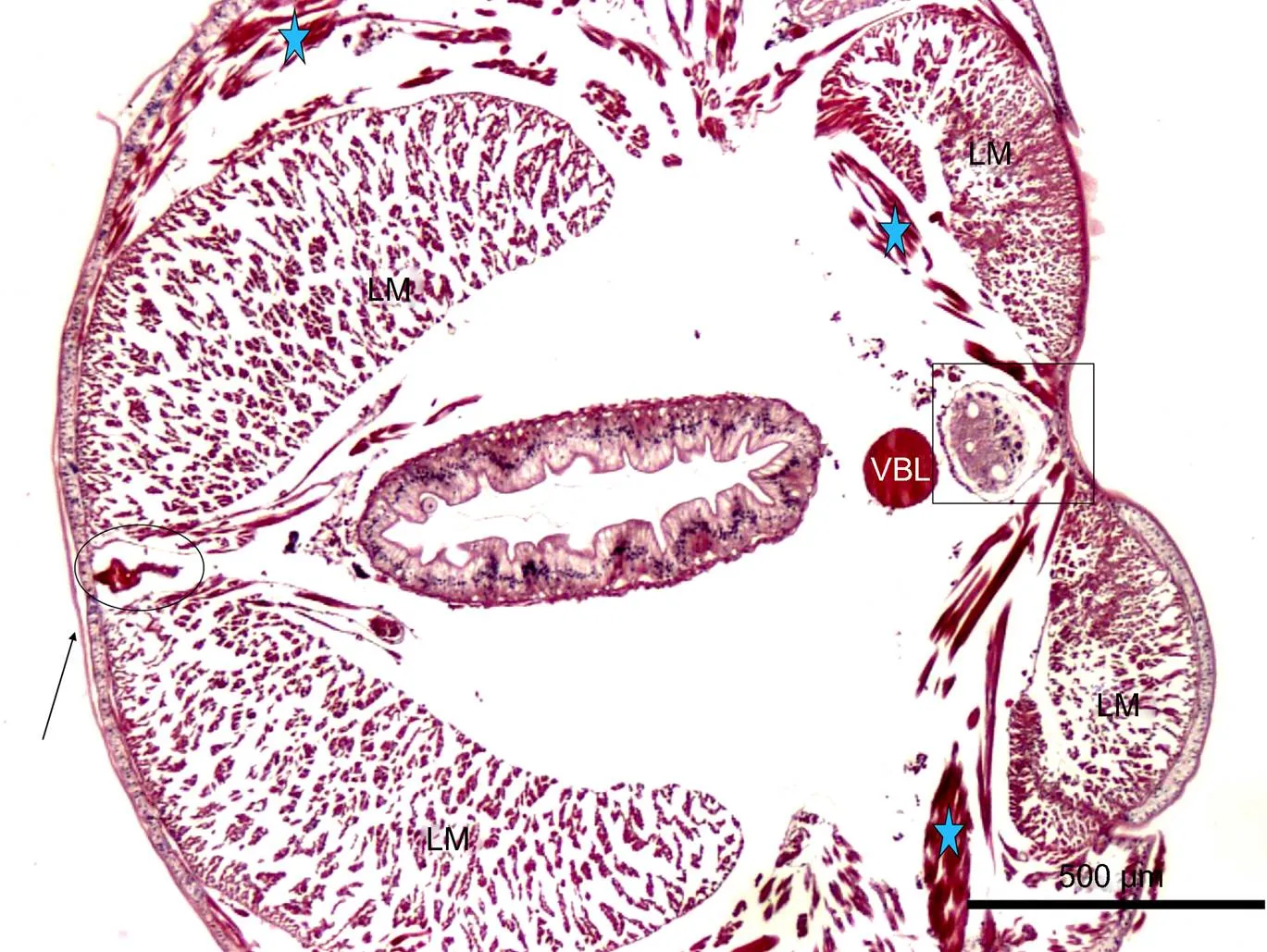
图3 双齿围沙蚕的内部器官结构
注: 箭头: 薄角质层; 椭圆: 内为背血管; VBL: 腹血管; 黑框: 内为腹神经索; 五角星: 为斜肌所在的位置; LM: 纵肌肉
双齿围沙蚕的腹血管最为发达(图3, 图4a), 由于血细胞较少且流动性差, 几乎不含有呼吸色素(即无血红蛋白), 很难观察到血细胞, 偶尔集中出现于腹血管内(图4e), 因此组织学表现多为均一性的淡红色(源于血管内游离的血红蛋白)(图3, 图4a, 4b)。在腹血管与腹神经索间有系膜连接(图4b), 同时神经索的外围由一薄层的纵行肌肉组织包裹(图4c)。循环(血管)系统还包括腹神经索下血管(图4c, 4f)、肌肉组织间的毛细血管网(图4d)、围绕肾脏组织的毛细血管网(图4i)、疣足内毛细血管网(图4j)。在肾脏附近不仅具有环状血管网, 肾间组织内亦含有大量的血细胞(图4g, 4h), 染色后主要表现细胞质红色, 细胞核蓝色(圆形, 中位) (图4h)。消化道的毛细血管网最为发达, 位于肌肉层与小肠上皮之间(图6f)。
2.2.2 肌肉组织学 双齿围沙蚕大部分肌肉组织分布在体壁的肌肉层, 最外侧为环肌、较薄, 位于表皮层下方(图5a), 收缩时导致身体变长。向内为背腹纵肌(图3), 纵肌共分四部分, 沿着背中线和腹中线, 分别为背、腹左右纵肌。其中背纵肌较发达, 背、腹纵肌之间分布有大量斜肌, 斜肌延伸至疣足内, 可统一协调虫体及疣足运动。消化道外层亦分布有肌肉层, 尤其是食道附近肌肉层含有发达的纵肌(内为环肌)(图5d), 这可大大增加食道的蠕动能力, 有助于食物向肠道推进。
2.2.3 消化道组织学 双齿围沙蚕的消化道包括口、咽、食道、小肠与肛门, 消化腺仅仅具有食道腺, 图6为其消化道组织学特征。双齿围沙蚕吻部的颚齿多为圆锥状(图6a), 利于快速杀死大型猎物。由于平时不摄食状态下, 吻部及内卷颚齿藏在咽部, 口、咽亦可看成是一个复合体。咽部上皮细胞较薄、无褶皱而环肌组织发达, 强大的肌肉组织利于摄食的食物快速沿消化道向肠道推进; 食道前段消化腔处开始出现肠道褶皱(图6b), 纵行肌肉仍发达, 而环肌较薄; 至食道后段消化腔处, 环肌逐渐加厚, 而纵肌逐渐变薄。食道纵肌、环肌的变化以及褶皱的出现体现了其磨碎、消化、吸收的多功能性和由消化逐步转为吸收的过渡性。在小肠前段消化腔处, 环肌发达, 而纵肌几乎消失, 除了肠道褶皱逐渐丰富外, 大量的肠道杯状细胞(分泌细胞)开始出现(图6d), 说明肠道是以消化吸收为主要功能; 近尾部前段消化腔处, 褶皱变平缓, 肌肉层逐渐消失(图6e), 但消化道内微血管开始丰富(图6f)。双齿围沙蚕的食道腺在靠近食道的位置(图6g), 在组织学构成上与小肠结构类似(图6h)。功能上推断, 可能类似于鱼类的幽门盲囊, 用于扩大消化吸收面积。
3 讨论
3.1 固定方法探讨
不同的固定液对于切片后期的染色效果会有一定的影响, 在实验动物中, 如大鼠(赵玉琼等, 2014)、小鼠的特定器官——角膜(高洪彬等, 2017)等都会有不同固定液的对比试验。而水产动物中, 不同固定液对比组织学报道很少, 学者们一般仅使用一种固定液, 如Bouin’s液, 尤其是用于早期发育过程的连续切片观察, 例如条斑星鲽()(肖志忠等, 2008)。在早期双齿围沙蚕的组织学观察中, 宋贞坪等(2010)同样是使用的Bouin’s固定液。
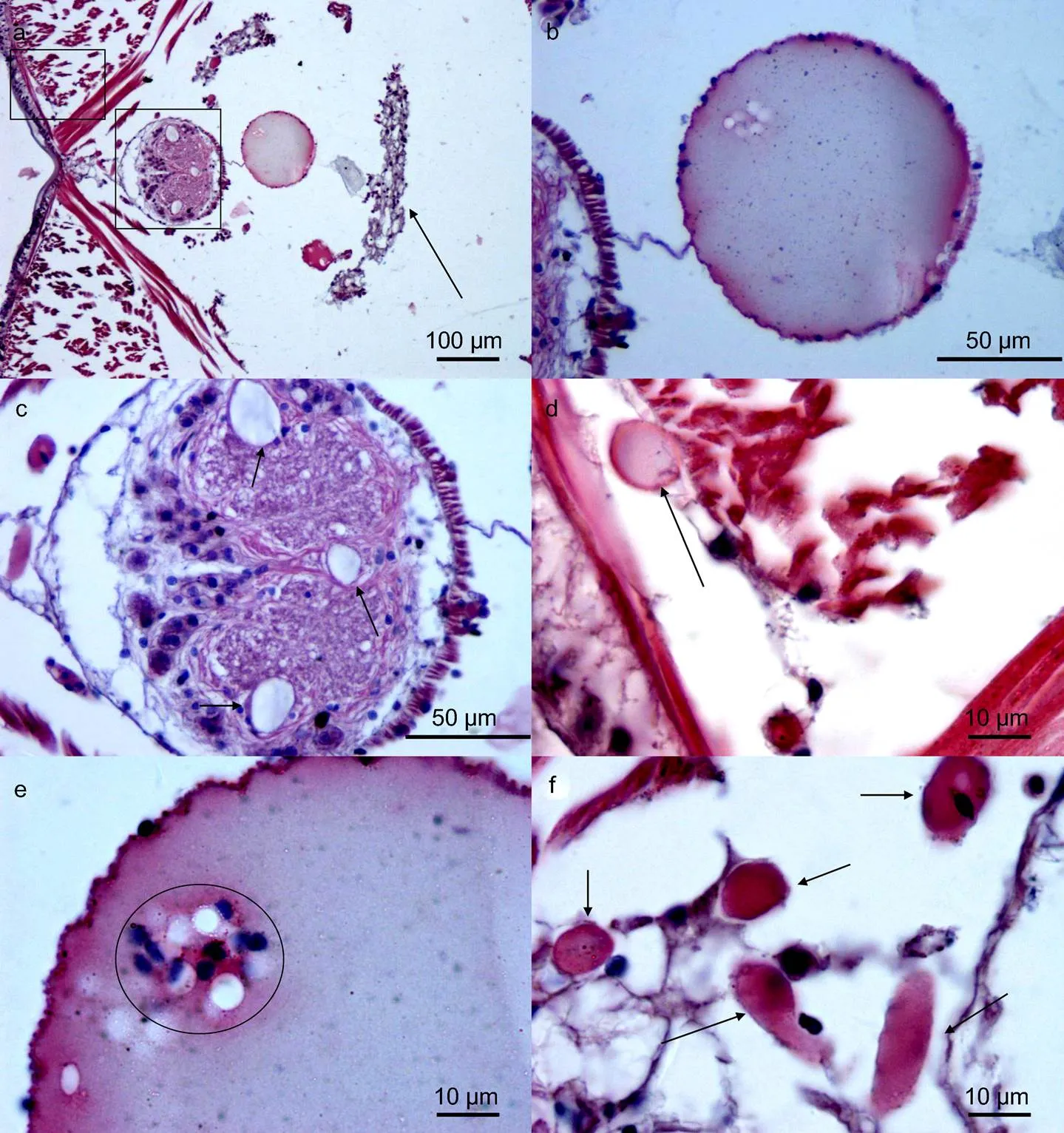
注: a. 展示沙蚕腹部中线处, 腹神经索和腹血管的位置关系, 左上角方框示斜肌、环肌和纵肌的关系(放大图为4d), 右下角方框内为腹神经索, 箭头示肾脏组织; b. 展示腹血管的均一性质, 以及与腹神经索的系膜联系; c. 示腹神经索的细微结构, 典型的三个; d. 图4a左上角方框的放大图, 可见环、纵肌间的微血管; e. 腹血管内偶尔存在的无色具核的血细胞, 细胞核深染为蓝色; f. 肾脏组织间的丰富的微血管; g. 肾脏与腹血管距离较近; h. 肾脏组织内的血细胞, 形态多以圆形为主; i. 近疣足处肾脏组织内的微血管, 可见大量深染蓝色的细胞; j. 疣足腹叶(无刚毛分布)的微血管
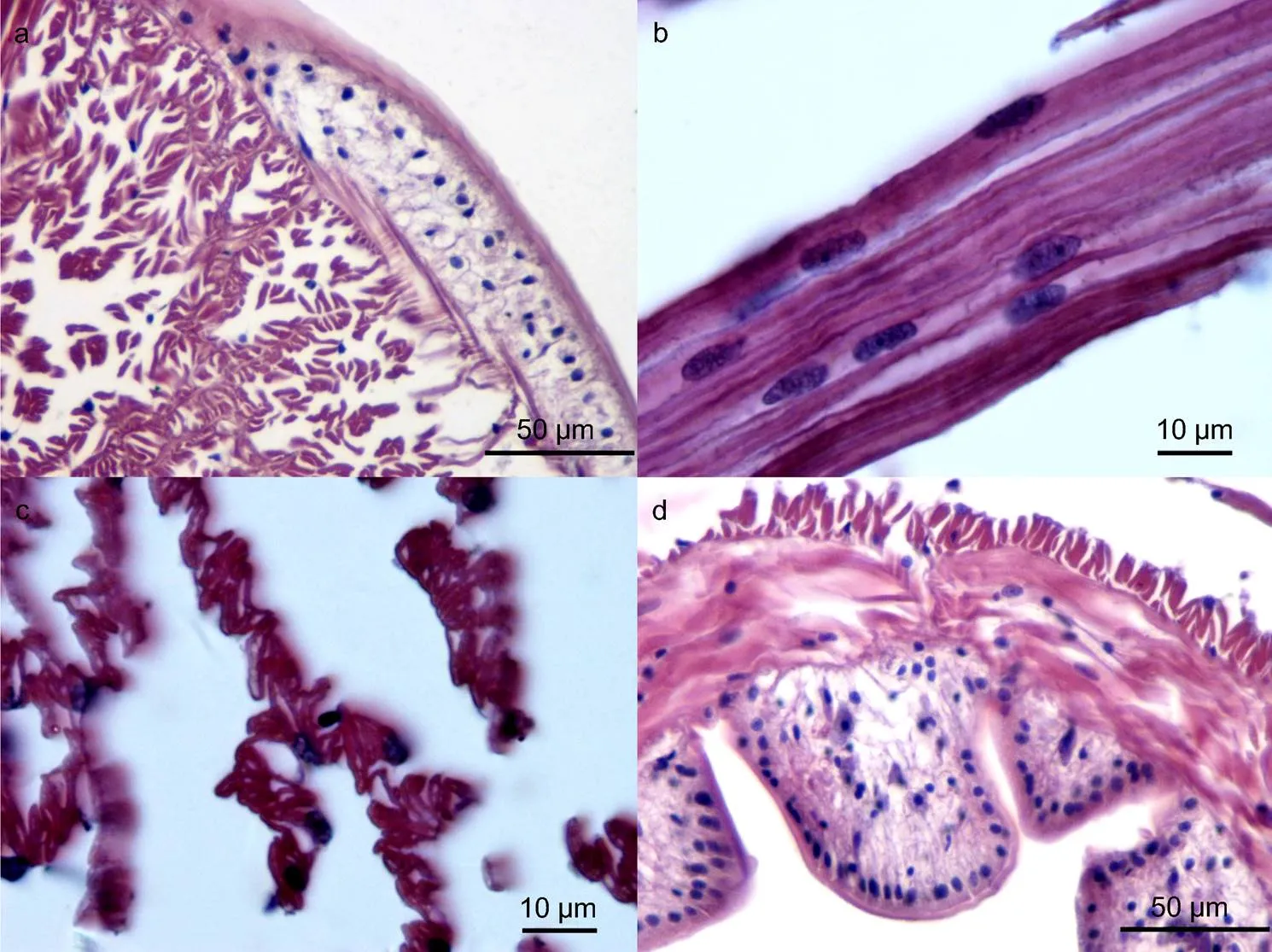
图5 双齿围沙蚕的肌肉组织
注: a. 展示沙蚕背体壁的纵肌, 体壁的多层上皮以及外部的角质层; b. 展示斜肌的微细结构, 可见长椭圆型的细胞核; c. 展示沙蚕背体壁的纵肌的微细结构, 细胞核较斜肌的短圆; d. 展示消化道的肌肉层, 详见图6
本研究过程中沙蚕的固定采用了两种传统的方式, 即10%甲醛溶液和Bouin’s液。在后期切片和染色过程中, 发现Bouin’s液固定的样品容易过染, 因此本文所用的照片均为10%甲醛溶液固定样品, 这与某些鱼类组织学观察中Bouin’s液的效果要好于10%甲醛溶液结果相反。可能的原因是: 相对鱼类而言, 沙蚕结缔组织和肌肉组织较少, Bouin’s液中的醋酸具有较强的穿透性, 导致最终过染现象。
国内很多学者偏好使用体积分数为30%的酒精对双齿围沙蚕、疣吻沙蚕()等进行麻醉处理(宋贞坪等, 2010; 杨威等, 2012; 马定昌等, 2014)。本研究在使用30%酒精进行麻醉时发现, 沙蚕出现明显的不适应性, 剧烈扭动, 导致身体呈现S型, 影响后期的切片观察, 因此本研究并未进行前期麻醉处理, 而是直接快速投入固定液中, 并在10 min内, 沙蚕已死亡后更换一次固定液, 此方法更有利于后期组织切片操作。
国外文献报道, 7.5%氯化镁可以作为无脊椎动物常用的麻醉剂应用于多毛类、刺细胞动物(cnidarians)、苔藓虫类(bryozoans)以及其他水生软体动物上。本研究使用不同浓度氯化镁进行双齿围沙蚕的麻醉实验, 结果显示30%氯化镁(MgCl2·6H2O)的麻醉效果最好, 2 min内所有沙蚕个体均深度麻醉, 加海水15 min内沙蚕全部复苏(待发表数据)。故, 在开展沙蚕等生物活体形态学观察研究中可采用此类麻醉方法。
3.2 循环系统
沙蚕的循环系统十分发达, 但是缺乏源于中胚层的内皮细胞, 不具有真正意义上的血管, 因此, 从组织学的观点来看, 双齿围沙蚕仍然属于开放式循环系统(Reiber, 2009)。血浆内含有大量游离的血红蛋白(hemoglobin)(Weber, 1977), 故其组织学结构显示淡淡的红色(图4b, 4d), 同时也是其在自然环境中能够耐受低氧的原因之一(Mangum, 1992; Lamont, 2000)。孙瑞平等(2006)在书中也提到沙蚕血浆内存在无色具核的血细胞, 与本文观察的结果一致(图4e)。本文观察发现, 双齿围沙蚕同时还具有含血红蛋白的血细胞(表现为红色细胞质), 且该血细胞大部分游离于循环系统, 主要存在于体腔内, 亦可分布在肾脏、神经索等组织中或附近(图4h, 图7b)。

注: a. 为咽部组织学, 上皮细胞较薄、无褶皱而环肌组织发达(黑线部分), 箭头示咽喉齿; b. 示食道前段处消化腔, 开始出现肠道褶皱(增加吸收面积), 纵行肌肉发达, 而环肌较薄; c. 示食道后段处消化腔, 环肌逐渐加厚, 而纵肌逐渐变薄; d. 示小肠前段处消化腔, 环肌发达, 而纵肌几乎消失, 除了肠道褶皱逐渐丰富外, 大量的肠道杯状细胞(分泌细胞)开始出现, 核基底位; e. 近尾部前段处消化腔, 褶皱变平缓, 肌肉层逐渐消失; f. 近尾部后段处消化腔, 褶皱无规则, 肌肉层逐渐消失而消化道内微血管开始丰富; g. 示消化腺与食道的位置关系, 黑框内为食道腺; h. 示食道腺的细微结构, 薄层肌肉组织, 核基底位, 内褶皱丰富
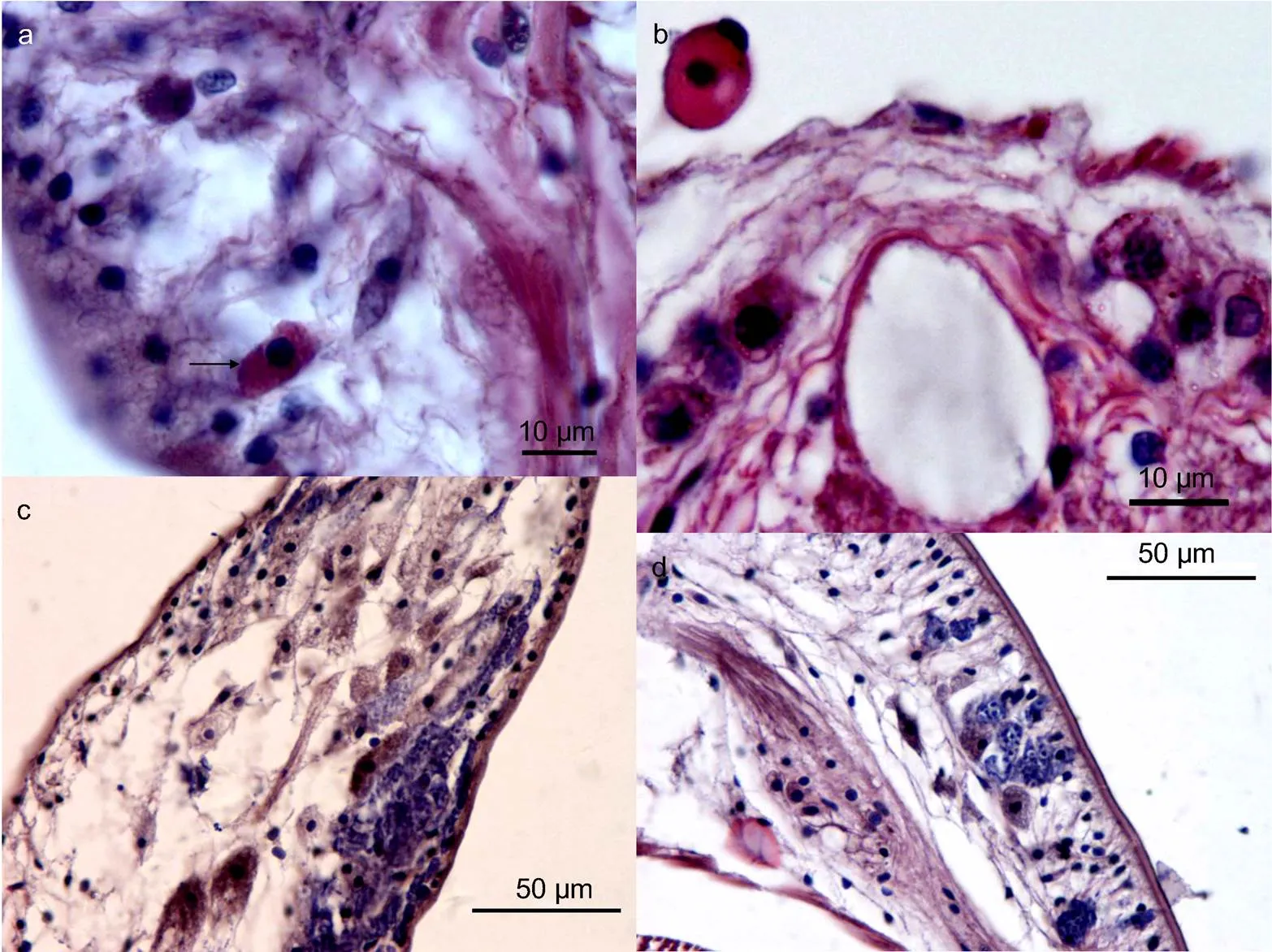
图7 双齿围沙蚕特殊组织学结构
注: a. 箭头示肠道上皮中发现的类血细胞(含有小颗粒物质); b. 示神经索内特殊细胞类型及外部游离的血细胞; c. 示疣足腹叶内特殊结构及嗜碱性颗粒物; d. 示疣足背叶内特殊结构及嗜碱性颗粒物
沙蚕类作为潮间带重要的物种, 对于食物网营养的上行传递(bottom-up)具有重要的作用, 其循环系统进化出了几种适应性机制, 包括为加强体节内部的对流输送形成发达复杂的疣足血管循环系统(图8)。沙蚕类生物的血液循环主要是在背血管和腹血管之间进行, 背血管中血液流动方向是由尾部向头部, 腹血管的血液流动方向则相反, 二者形成闭合回路。此外, 沙蚕类生物每个体节都拥有独立的血液循环网, 血液从腹血管流向体侧的疣足血管网, 经疣足腹叶到疣足背叶, 最终回到背血管(Reiber, 2009)。体节独立的血液循环网, 为沙蚕类生物断裂存活提供了充足的可能性(Lindsay, 2007; Bakalenko, 2017)。
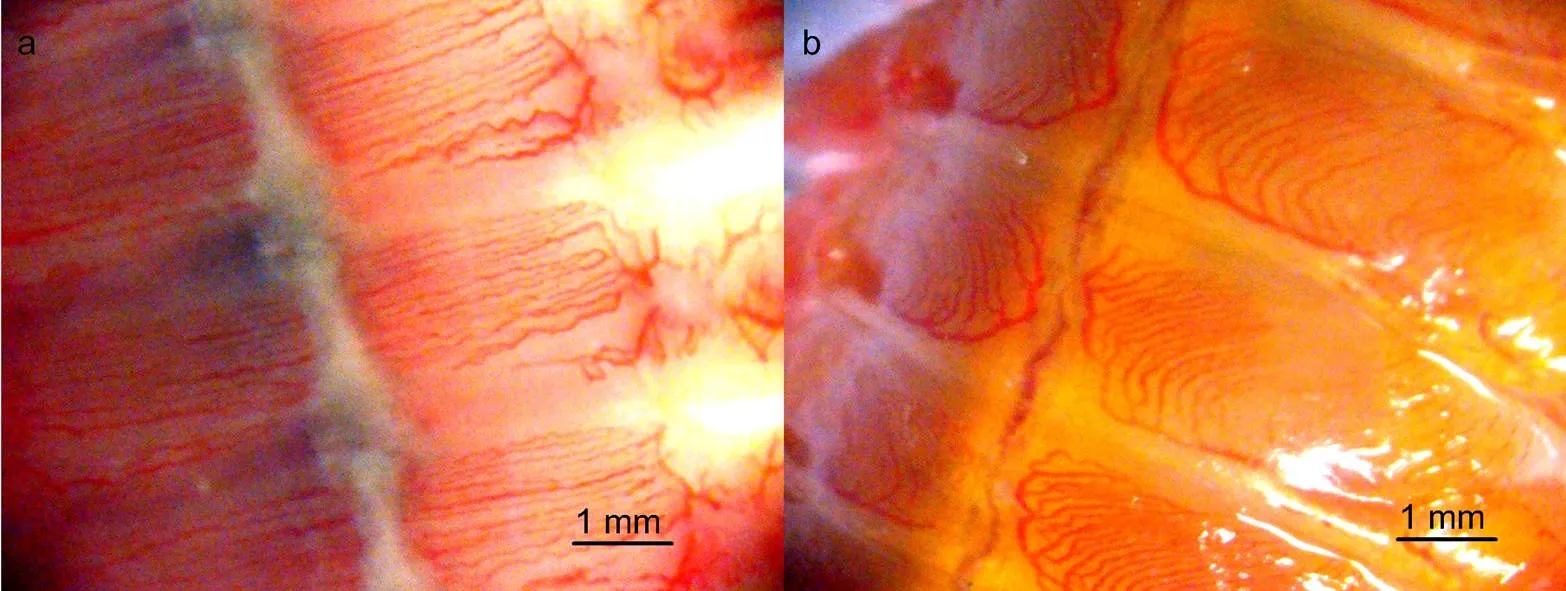
图8 双齿围沙蚕背腹血管
注: a. 腹部血管网; b. 背部血管网
3.3 肌肉系统
沙蚕类肌肉分为环、纵和斜三种类型。本文研究发现, 双齿围齿沙蚕的环肌层并非完整的环绕体节肌肉层, 在背腹中线两侧, 背腹纵肌与上皮层紧密连接处缺乏环肌肉(图3), 这一特征与疣吻沙蚕类似(马定昌等, 2014)。非完整的环肌层现象在大型底栖生物、小型底栖生物中十分常见, 例如Aphroditidae、Nephtyidae、Nerillidae、Opheliidae、Spionidae、Oweniidae、Chrysopetalidae等(Tzetlin, 2005)。环肌对穴居动物十分重要, 但对已经进化出疣足或纤毛的穴居动物而言, 这些特定运动器官分担了环肌的部分运动功能, 所以会出现非完整的环肌层现象。有学者推断这与多毛类长期进化的生态位相关(Kraan, 2013), 多毛类生物为弱势物种, 被摄食的风险性极高, 非完整的环肌层更有利于其体节的断裂与逃生(Bely, 2006; Brockes, 2008)。
此外, 环肌、斜肌在与疣足肌肉连接处, 并无任何断裂(图2a)。因此, 很多学者认为环肌与斜肌实际上为一种类型, 应该统称为支撑肌(bracing muscle)。支撑肌亦可视为疣足肌肉组织复合体(parapodial muscle complex)的一部分, 保证了沙蚕虫体与疣足肌肉组织之间的连续性, 使得沙蚕运动功能更加协调。不同物种之间的疣足肌肉组织复合体数量和大小差异很大, 可作为物种鉴定的依据之一。有趣的是, 疣足肌肉组织复合体数量并不与机体运动能力成正比, 研究发现的疣足肌肉组织复合体数量是sp.的两倍, 但前者的运动力远远低于后者(Mettam, 1967, 1971)。
3.4 消化系统
双齿围沙蚕的消化系统贯穿整个身体, 与其并行的还包括有背腹血管以及腹神经索。其消化道特点主要体现在肌肉组织结构、上皮层细胞数量和形态的变化、尾部血管的密集程度等方面。食道与肠道无明显的分界线, 前半部分(即食道)主要作为食物的通道, 具有较厚的肌肉层, 以机械消化为主; 后半部分(肠道)褶皱和杯状细胞丰富, 主要以消化和吸收为主; 肠道最后段具有大量丰富的肠道血管, 是营养物质的交换场所。由此可见, 沙蚕的消化系统由头部向尾部肌肉组织逐渐减少, 微血管逐渐丰富, 前肠厚且多褶皱, 利于碾磨食物, 后肠薄且富含腺体, 这些特征均与机体从摄食、消化向吸收过渡相适应。
解剖发现, 双齿围沙蚕食道靠近尾部有一对食道腺, 外部形态上可观察到明显的褶皱。从组织学(H.E)的角度来看, 食道腺上皮的组织学结构与食道上皮类似(图6h), 其是否具有分泌消化酶的腺细胞, 还需要特殊的染色方法来确定。可以确定的是, 食道腺的出现首先增加了吸收面积, 其作用与其他环节动物(蚯蚓)的盲道(typhlosole)以及高等生物鱼类的幽门盲囊(Patil, 2019)相似。此外, 在肠道上皮中发现含有小颗粒物质的细胞(图7a), 形态与血细胞相似。Rodrigo等(2015)研究发现一种环节动物()肠道上皮主要由消化细胞和排泄细胞形成, 前者在消化过程中会发生显著变化, 起初会分泌黏液物质, 随后分泌合成酶。而本研究所发现的含有小颗粒物质的细胞是否具有酶活作用, 仍需要进一步证明。
4 结论
本研究采用组织学观察手段, 较系统完善地展现了双齿围沙蚕主要器官和系统的结构特点。首次以组织切片的形式展示了其刚毛的中空短管状形态。围绕双齿围沙蚕的组织学特点与生理功能进化机制展开分析讨论, 发现并提出了沙蚕类的血液循环系统组织特征与体节易断裂及再生的进化机制、肌肉组织与运动功能、消化系统形态及其功能之间相适应的有力证据。为更加系统掌握多毛类生物学特征提供了基础资料, 同时为其人工繁育、指示环境污染物情况提供一定的科学依据。
马定昌, 叶柳荷, 许爱娱等, 2014. 疣吻沙蚕组织切片的观察研究. 南方水产科学, 10(4): 58—63
孙瑞平, 黄 猛, 杨德渐等, 2006. 沙蚕养殖与开发. 青岛: 中国海洋大学出版社, 15
杨 威, 陈 康, 李 活等, 2012. 以江蓠为栖息环境养殖的双齿围沙蚕性腺发育. 广东海洋大学学报, 32(1): 17—23
杨大佐, 周一兵, 寇 娜, 2010. 双齿围沙蚕配子发生的组织学观察. 大连水产学院学报, 25(1): 29—33
肖志忠, 于道德, 辛 梅等, 2008. 条斑星鲽消化系统个体发生的组织学观察. 海洋科学, 32(6): 13—16
何润端, 曹伏君, 朱国萍, 2020. 双齿围沙蚕的生活史. 大连海洋大学学报, 35(3): 347—354
宋贞坪, 李 霞, 王福景等, 2010. 双齿围沙蚕主要器官组织学的研究. 大连海洋大学学报, 25(4): 320—323
陈灿忠, 叶永健, 蔡郁兰等, 1992. 双齿围沙蚕繁殖的生态. 台湾海峡, 11(1): 54—60
范广钻, 郑佩玉, 钟惠英等, 1983. 双齿围沙蚕Grube雌性生殖腺发育的组织学研究. 浙江水产学院学报, 2(2): 105—113
赵玉琼, 陈 华, 2014. 不同固定液对大鼠肝脏组织石蜡切片质量的影响. 实验动物与比较医学, 34(6): 486—489
柳敏海, 蒋霞敏, 张永靖等, 2005. 双齿围沙蚕形态参数关系的分析. 水利渔业, 25(6): 40—41, 59
高洪彬, 林 英, 宋向荣等, 2017. 六种固定液对小鼠角膜固定效果的比较. 中国比较医学杂志, 27(6): 49—52
Bakalenko N I, Poznyak A V, Novikova E L, 2017. Effect of retinoids ongene expression in nereid polychaetes. Russian Journal of Developmental Biology, 48(3): 211—218
Bat L, 2005. A review of sediment toxicity bioassays using the amphipods and polychaetes. Turkish Journal of Fisheries and Aquatic Sciences, 5: 119—139
Bat L, Şahin F, Öztekin A, 2019. Assessment of heavy metals pollution in water and sediments and polychaetes in Sinop Shores of the Black Sea. KSÜ Tarım ve Doğa Derg, 22(5): 806—816
Batista F M, Costa P F E, Matias D, 2003. Preliminary results on the growth and survival of the polychaete(O. F. Müller, 1776), when fed with faeces from the carpet shell clam(L., 1758). Boletin Instituto Espanol de Oceanografia, 19(1—4): 443—446
Beesley P L, Ross G J B, Glasby C J, 2000. Polychaetes & Allies: the Southern Synthesis. Fauna of Australia. Melbourne: CSIRO Publishing, 465
Bely A E, 2006. Distribution of segment regeneration ability in the Annelida. Integrative and Comparative Biology, 46(4): 508—518
Bray W A, Lawrence A L, 1992. Reproduction of Penaeus species in captivity. In: Fast A W, Lester L J eds. Marine Shrimp Culture: Principles and Practices. Amsterdam: Elsevier, 93—170
Briggs M R P, Brown J H, Fox C J, 1994. The effect of dietary lipid and lecithin levels on the growth, survival, feeding efficiency, production and carcass composition of post-larvalFabricius. Aquaculture Research, 25(3): 279—294
Brockes J P, Kumar A, 2008. Comparative aspects of animal regeneration. Annual Review of Cell and Developmental Biology, 24: 525—549
Cardinaletti G, Mosconi G, Salvatori R, 2009. Effect of dietary supplements of mussel and polychaetes on spawning performance of captive sole,(Linnaeus, 1758). Animal Reproduction Science, 113(1—4): 167—176
Dean H K, 2008. The use of polychaetes (Annelida) as indicator species of marine pollution: a review. Revista de Biologia Tropical, 56(4): 11—38
Kraan C, Aarts G, Piersma T, 2013. Temporal variability of ecological niches: a study on intertidal macrobenthic fauna. Oikos, 122(5): 754—760
Kristensen E, 2001. Impact of polychaetes (spp. and) on carbon biogeochemistry in coastal marine sediments. Geochemical Transactions, 2(1): 92
Kristensen E, Mikkelsen O L, 2003. Impact of the burrow-dwelling polychaeteon the degradation of fresh and aged macroalgal detritus in a coastal marine sediment. Marine Ecology Progress Series, 265: 141—153
Lamont P A, Gage J D, 2000. Morphological responses of macrobenthic polychaetes to low oxygen on the Oman continental slope, NW Arabian Sea. Deep sea Research Part II: Topical Studies in Oceanography, 47(1—2): 9—24
Lindsay S M, Jackson J L, He S Q, 2007. Anterior regeneration in the spionid polychaetesand. Marine Biology, 150(6): 1161—1172
Luis O J, Passos A M, 1995. Seasonal changes in lipid content and composition of the polychaete(). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 111(4): 579—586
Mangum C P, Colacino J M, Grassle J P, 1992. Red blood cell oxygen binding in capitellid polychaetes. The Biological Bulletin, 182(1): 129—134
Mettam C, 1967. Segmental musculature and parapodial movement ofand(Annelida: Polychaeta). Journal of Zoology, 153(2): 245—275
Mettam C, 1971. Functional design and evolution of the polychaete. Journal of Zoology, 163(4): 489—514
Patil U, Benjakul S, 2019. Comparative study on extraction of virgin coconut oil with the aid of partially purified protease from seabass pyloric caeca and commercial trypsin. Journal of Food Biochemistry, 43(11): e13024
Reiber C L, McGaw I J, 2009. A review of the “open” and “closed”circulatory systems: new terminology for complex invertebrate circulatory systems in light of current findings. International Journal of Zoology, 2009: 301284
Rodrigo A P, Costa M H, Costa P M, 2015. Microanatomical alterations in the gut of an marine polychaete (, Errantia: Phyllodocidae) during the digestive process. Microscopy and Microanalysis, 21(Suppl 6): 12—13
Scaps P, 2002. A review of the biology, ecology and potential use of the common ragworm(O. F. Müller) (Annelida: Polychaeta). Hydrobiologia, 470(1—3): 203—218
Tzetlin A B, Filippova A V, 2005. Muscular system in polychaetes (Annelida). Hydrobiologia, 535—536(1): 113—126
Weber R E, Mangum C, Steinman H, 1977. Hemoglobins of two terebellid polychaetes:and. Comparative Biochemistry and Physiology Part A: Physiology, 56(2): 179—187
HISTOLOGICAL OBSERVATION ON PHYSIOLOGIC FUNCTION OF
SONG Jing-Jing, LIU Tian-Hong, LIU Hong-Jun, CHI Wen-Dan, LIU Kai-Kai, YU Dao-De
(Key Laboratory of Disease Control for Aquaculture in Shandong Province, Marine Aquaculture Technology Engineering Research Center in Shandong Province, Marine Science Research Institute of Shandong Province, Qingdao 266104, China)
The main organs ofwas observed in histology using dissection under light microscope. For the first time, the fine structure of chaeta, the histological characteristics of main organs, and the spatial arrangement in the abdomen cavity were studied. By histological staining, abundant capillaries in each pair of parapodia with several setae were revealed. The circulatory system is well-developed, containing a dorsal vessel, ventral vessel, and circular vessel, which is consistent with its evolutionary mechanism. Three types of muscle tissue (ring muscle, longitudinal muscle and oblique muscle) were classified and they cooperated with each other to realize the movement among wart feet, various body segments, and the entire body. The histological characteristics of digestive tract from front to back show the changes of muscle tissue and intestinal folds, indicating its evolutionary adaption in structure and function. The results of this study laid a foundation for more detail and systematic understanding of the biological characteristics of., and provided a certain scientific basis for its artificial breeding and for environmental pollution monitoring.
; histological characteristics; chatea; parapodium; ventral vessel
* 山东省现代农业产业技术体系虾蟹类创新团队项目, 创新团队SDAIT-13-1号; 山东省2018年度农业重大应用技术创新项目(南非斑节对虾绿色健康养殖模式研究与示范); 烟台市科技计划项目, 2018SFBF084号。宋静静, 博士, E-mail: songjjiocas@163.com
于道德, 博士, E-mail: wensentte@163.com
2020-07-31,
2020-11-11
Q174
10.11693/hyhz20200700223
