阿塔卡马海沟深渊和非深渊站位的沉积脂肪酸对比研究*
2021-05-25王亚松肖文杰韩露露许云平
项 羽 王亚松 肖文杰 韩露露 许云平
阿塔卡马海沟深渊和非深渊站位的沉积脂肪酸对比研究*
项 羽 王亚松 肖文杰 韩露露 许云平①
(上海海洋大学海洋科学学院深渊科学与技术研究中心 上海 201306)
深渊海沟作为海洋的最深处, 是最不被人了解的地球生态环境之一。有机质的输入、含量和活性对于维持深渊生态系统和深渊生物地球化学循环至关重要。本文利用脂肪酸生物标志物方法, 研究了来自阿塔卡马海沟的4个沉积物柱状样(长度为15—35 cm), 比较了水深2560—7770 m的深渊(A5, A10)和非深渊(A1, A9)站位的脂肪酸含量、来源和保存状况。本研究共检测到50种脂肪酸化合物, 包括来自陆源有机质的长链饱和脂肪酸, 来自海源浮游植物的短链饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸, 以及来自细菌的甲基支链脂肪酸。总脂肪酸的平均含量在非深渊站位A1最高[(13.4±2.9)mg/g dws], 而深渊站位A5最低[(5.4±2.2) μg/g dws], 这可能与各站位的初级生产力和水深有关。在所有站位中, 海源脂肪酸均处于主导地位(61.6%±9.2%), 其比例显著高于陆源脂肪酸(33.6%±10.7%)和细菌脂肪酸(4.9%±2.3%), 表明在阿塔卡马海沟沉积物中脂肪酸主要是海源有机质的贡献。在每个站位, 随着沉积物深度的增大, 陆源脂肪酸的比例均明显增加, 而海源脂肪酸的比例则减少, 该结果与脂肪酸指数FA-Index的结果一致, 表明短链脂肪酸和不饱和脂肪酸相比于长链饱和脂肪酸更易被降解。最后, 非深渊站位的脂肪酸含量随着深度的增加表现出明显的降低, 展现出稳定沉积环境中典型的有机质成岩作用, 而深渊站位的脂肪酸含量尽管出现波动, 但随深度无明显的下降趋势, 这可能归结于地震、浊流作用下形成的不稳定沉积环境, 有助于有机质从非深渊区向深渊区的快速输入和埋藏。
深渊海沟; 脂肪酸; 阿塔卡马海沟; 生物标志物; 有机碳
深渊区是指水深超过6000 m的海域, 主要由位于俯冲带的海沟组成(李栋等, 2018; Xu, 2018)。深渊海沟具有独特的生态系统和生物地球化学过程, 很可能蕴藏了丰富的生物、基因和矿产资源(Xu, 2018)。然而, 深渊极大的深度和超高的静水压力使得在深渊观测和采样都极为困难, 这也使得深渊区目前仍然是最不被人类了解的地球生态环境之一。少量研究发现深渊区的底栖生物量(Itoh, 2011)、有机碳埋藏通量(Danovaro, 2003)和微生物活性(Glud, 2013)都要高于临近的深海平原。这些特点可能与深渊海沟独特的V形地貌、频繁的地震活动以及潮汐引起的流体活动有关(Jamieson, 2010; Turnewitsch, 2014; Ichino, 2015)。全球分布着30多条深渊海沟, 它们在最大水深、面积、初级生产力、陆地影响以及地震发生频率和强度等方面都存在显著的差异(Stewart, 2018; Li, 2020; Xu, 2020)。作为一个缺乏光合作用的深海环境, 深渊生态系统和生物地球化学循环均强烈依赖于外来有机质的输入。因此, 开展深渊海沟有机质的含量、来源和活性研究具有重要的意义。
秘鲁-智利海沟是全球面积最大的海沟, 位于东太平洋南美洲秘鲁、智利沿岸西侧, 其海沟主轴走向与安第斯山脉走向一致。由于该海沟所在海域受到强烈的上升流影响, 因而具有非常高的初级生产力。前人曾利用脂肪酸等生物标志物, 评估了智利海域水体(Espinosa, 2009)和沉积物(Seguel, 2001)中有机质来源、微型和微微型浮游植物对鳕鱼的食物贡献(Escribano, 2010), 以及上升流对沉积有机质的影响(Gutiérrez, 2012)。然而需要指出的是, 前人的研究多集中于浅海和半深海区域, 还未涉及到深渊区。在智利海域, 随着离岸距离的增加, 非深渊区和深渊区在上升流强度、陆地输入贡献以及有机质输入方式上具有明显的差异, 因此开展深渊区和非深渊区的比较研究就显得十分必要。
脂肪酸是一类重要的生物标志物, 它占海洋生物干重的比例约为10%—50% (Budge, 2006)。脂肪酸的碳链长度、不饱和度以及甲基支链位置往往与其来源生物和环境条件密切相关, 因而具有良好的指示意义(张前前等, 2006; 张海生等, 2007; De Carvalho, 2018), 如软脂酸16:0及硬脂酸18:0等在海洋环境中普遍存在且含量高(Hu, 2006), 而长链多不饱和脂肪酸如二十碳五烯酸(EPA, 20:5ω3)、二十二碳六烯酸(DHA, 22:6ω3)主要由浮游生物合成(Pruski, 2015)。此外, 含有甲基支链的奇数碳脂肪酸化合物(含15或17个碳原子)在细菌中具有格外高的含量, 可以作为细菌良好的生物标志物(Kaneda, 1991; Mrozik, 2014)。脂肪酸已经被成功用于指示海洋中有机物的来源(Wakeham, 2007; Loh, 2008), 生物的营养级关系(Kelly, 2012)以及有机质的早期成岩过程(Canuel, 1996; Camacho-Ibar, 2003)。来自德国马普海洋微生物研究所的Niggemann和 Schubert分析了来自秘鲁-智利海沟近海上升流区域(水深126—1350 m)的沉积物, 发现活泼的脂肪酸化合物(如不饱和脂肪酸)会在成岩过程中快速降解, 导致脂肪酸的组成和丰度随埋藏深度发生变化, 并基于脂肪酸的组成提出一个脂肪酸降解指数(fatty acid index, FA-Index)(Niggemann, 2006)。然而, 目前还未见关于阿塔卡马海沟深渊区脂肪酸的报道。
在本研究中, 我们选取了来自阿塔卡马海沟的4个沉积物柱状样, 分析了脂肪酸的组成和含量。我们的主要研究目标包括两方面: (1) 确定深渊和非深渊站位沉积物中脂肪酸的含量、来源和组成特征, 并探讨影响因素; (2) 研究非深渊站位和深渊站位脂肪酸的埋藏和降解过程, 并基于脂肪酸指数FA-Index评估脂肪酸的保存状况。本研究将为评估深渊沉积有机质的活性, 理解深渊极端环境的底栖生态环境提供基础数据。
1 材料与方法
1.1 研究区域与样品采集
阿塔卡马海沟位于东太平洋最南端, 属于秘鲁-智利海沟系统。秘鲁-智利海沟全长约5900 km, 平均宽度约100 km, 最深处超过8050 m, 是世界上面积最大的海沟(Danovaro, 2003)。本次研究的区域位于20°—24°S之间(图1), 属于秘鲁-智利海沟的最深部分, 由南美洲板块下方的纳兹卡板块俯冲形成。阿塔卡马海沟所处的海域由于离岸风引起的上升流, 具有非常高的初级生产力, 在全球海沟中仅次于班达海沟和瓜哇海沟(Jamieson, 2015)。阿塔卡马海沟毗邻世界上最干旱的沙漠-阿塔卡马沙漠, 这也使得该海区陆源物质的输入主要依赖风力输送, 而不是河流输送(Houston, 2006)。
2018年3—4月间, 我们的合作者、来自南丹麦大学的Ronnie Glud教授搭乘德国太阳号科考船(R/V SONNE), 在阿塔卡马海沟采集了一系列沉积物样本, 包括本次研究所用的4个柱状沉积物(A1、A5、A9、A10)。这4个采样点的水深范围在2560—7770 m。根据Behrenfeld等(1997)基于遥感数据的模拟, 各站位的平均净初级生产力(net primary productivity, NPP)范围为306—449 g C/(m2·a)(数据下载链接: http://sites. science.oregonstate.edu/ocean.productivity/)。采样点的具体位置、水深、柱状样长度以及NPP信息见表1。柱状样A5和A10来自深渊区, 水深均为7700 m, 柱长分别为30 cm和35 cm; 柱状样A1和A9则来自靠近陆地一侧的非深渊站位, 水深分别为2560 m和4050 m, 柱长分别为20 cm和15 cm。沉积物取样方式为箱式取样。沉积物在甲板上利用插管获取柱状样, 并立即在船上进行切片, 分样间隔分别为1 cm(最上部10 cm)、2.5 cm (10—20 cm深度)和5 cm(大于20 cm深度)。分割后的样品立即装入自封袋并于−80 °C的冰柜保存, 待科考船靠港后用干冰保存运回上海海洋大学实验室, 并于−20 °C保存直至进一步的化学分析。

图1 阿塔卡马海沟沉积物采样点位置图
表1 阿塔卡马海沟沉积物采样信息

Tab.1 Sampling information of sediment cores from the Atacama Trench
注: 净初级生产力的估算基于2009年1月至2018年12月间的平均值(Behrenfeld, 1997)。数据下载网址: http://sites.science.oregonstate. edu/ocean.productivity
1.2 脂肪酸的提取及分析
样品经冷冻干燥后研磨均匀, 称取约3 g干重的沉积物样品, 加入已知量的正脂肪酸甲酯(C19:0)作为回标。二氯甲烷/甲醇(体积分数为3:1)超声萃取15 min, 随后在3000 r/min条件下离心15 min, 将上清液转移至已编号的干净圆底烧瓶中。重复提取三次。用旋转蒸发仪将提取液进行浓缩至5 mL左右, 并用氮吹仪进一步吹干。向已吹干的样品中加入2 mL氢氧化钾的甲醇溶液(2 mol/L), 混合均匀后在80 °C下进行皂化反应90 min。待反应液冷却后, 加入2 mL的超纯水, 并转移至分液漏斗中, 用5 mL二氯甲烷分4次萃取水相, 得到有机相(此部分为中性组分); 向剩余的水相中滴入2—3滴6 mol/L的浓盐酸, 调节pH<1。再用5 mL二氯甲烷分4次萃取水相, 合并于样品瓶中得到脂肪酸组分。
脂肪酸组分经氮吹仪吹干后, 加入1 mL 14%三氟化硼的甲醇溶液, 于70 °C反应90 min。待反应冷却后加入1 mL超纯水, 随后加入2 mL正己烷振荡萃取, 并于3500 r/min离心5 min, 将上层有机相转入新的样品瓶中并氮吹浓缩至近干。用二氯甲烷将有机相转移至2 mL的样品瓶中, 并加入一定量的正十八酸乙酯(Ethyl Stearate, 内标), 吹干后用正己烷定容至200 μL, 涡旋均匀后使用气相色谱质谱仪器进行分析。
使用安捷伦气相色谱质谱仪(7890B GC-5977A MSD, Agilent)对脂肪酸组分进行定性及定量分析, 分析所用色谱柱型号为HP-5MS (30 m×0.32 mm× 0.25 μm, Agilent), 载气为高纯氦气, 离子源为EI。进样口温度为300 °C。升温程序设定为: 初始温度70 °C, 保持1 min, 随后以20 °C/min的速度上升3 min, 待温度升至130 °C后, 再以4 °C/min速度升温至300 °C,并保持10 min。根据扫描得出的质谱图识别化合物的特征离子峰, 根据特征离子峰对化合物进行定性。所用质谱库为NIST14。另外, 使用相同气相色谱质谱条件对含有40种脂肪酸甲酯的混合标样(NU-CHEK PREP INC. USA)进行分析, 通过比较以进一步确定样品中脂肪酸的结构。根据扫描的色谱图对已定性的化合物峰进行积分, 峰面积与内标的峰面积之比可以计算相应化合物的含量, 最后将其换算成在单位沉积物的含量。由于部分脂肪酸化合物缺乏标准品, 本研究假定所有脂肪酸化合物具有相同的响应因子, 因此所得的脂肪酸含量属于半定量分析结果。
1.3 统计分析
本研究在阿塔卡马海沟沉积物中共检测出50种脂肪酸。为了评估影响脂肪酸分布的主要因素, 我们使用SPSS软件对脂肪酸指标进行主成分分析(principal component analysis, PCA)、单因子方差分析(ANOVA)以及皮尔逊相关性分析()。为消除沉积物稀释效应的影响, 我们将脂肪酸浓度首先转化为总脂肪酸百分比后, 再运用SPSS软件进行统计分析。主成分分析不仅可以反映影响脂肪酸分布的主要因素(Hu, 2006), 而且还能帮助评估脂肪酸的降解程度(Niggemann, 2006)。
1.4 脂肪酸命名, 分类和指数计算
本文采用文献常用的脂肪酸命名方法: 正构脂肪酸表示为:ω, 其中碳链长度由数字表示, 不饱和程度由数字表示, 双键位置由数字表示。如20:5ω3表示多不饱和脂肪酸, 它含有20个碳原子, 5个共轭双键, 其中第一个双键出现在主链甲基一端的第三个碳原子, 而16:0则表示含有16个碳原子的饱和脂肪酸。此外, 对于支链脂肪酸, 我们命名为异构(iso; 即主链甲基一端的第二个碳原子上)和反异构(anteiso; 主链甲基一端的第三个碳原子上), 如i15:0和a15:0分别表示含有15碳的异构和反异构支链脂肪酸(Volkman , 2007)。
按照脂肪酸的碳链长度、不饱和度以及是否带有甲基支链等特点, 本研究将脂肪酸分为五组: (1) 碳原子数≤20的短链饱和脂肪酸(short chain saturated fatty acids, SCFAs); (2) 碳原子数>20的长链饱和脂肪酸(long chain saturated fatty acids, LCFAs); (3) 只含有一个碳碳双键的单不饱和脂肪酸(monounsaturated fatty acids, MUFAs); (4) 含有甲基支链的饱和脂肪酸(branched chain saturated fatty acids, BrFAs); (5) 含有多个碳碳双键的多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)(Kaneda, 1991)。
根据脂肪酸的来源差异, 本研究将其分为三类, 即海源脂肪酸, 陆源脂肪酸和细菌来源脂肪酸(Meyers, 1997)。其中海源脂肪酸主要包括SCFAs、MUFAs和PUFAs, 这类脂肪酸的碳链较短, 或含有一个或多个双键, 它们的分子结构不稳定, 在环境中较易降解(Wakeham, 1997, 2007; Parrish, 2013)。陆源脂肪酸仅包括长链饱和脂肪酸(LCFAs), 该类脂肪酸由于碳链较长, 且无碳碳双键, 因此分子结构稳定(Meyers, 1997; Diefendorf, 2017)。随着早期成岩作用的发生, LCFAs在总脂肪酸中的比例会逐渐增大(Wakeham, 1997; Camacho-Ibar, 2003)。此外, 支链饱和脂肪酸(BrFAs)是经典的细菌生物标志物, 它们在环境中也较为稳定(Wakeham, 1997; Yunker, 2005)。
为了评估沉积物柱状样中降解因素对脂肪酸成分的影响, 我们计算了脂肪酸指数(FA-Index) (Niggemann, 2006)。该指数考虑了所有的脂肪酸化合物, 根据化合物的相对含量进行主成分分析后, 计算得到:

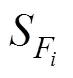
2 结果
2.1 脂肪酸的组成及含量
阿塔卡马海沟沉积物柱状样中共检测到50种脂肪酸, 包括SCFAs、LCFAs、MUFAs、PUFAs和BrFAs。其中SCFAs的碳链范围为14—20, LCFAs的碳链范围为21—32, MUFAs主要包括16:1ω7、18:1ω7和22:1ω9等13种化合物, PUFAs含有20:4ω6、20:5ω3和22:6ω3等9种化合物, 而BrFAs主要为i15:0和a15:0。在阿塔卡马海沟4个柱状样中, SCFAs、LCFAs、MUFAs、PUFAs和BrFAs的平均占比分别为42.1%±7.2%、33.6%±10.7%、18.8%±10.4%、0.7%±1.4%和4.9%± 2.3% (表2)。其中, 16:0和18:0在所有站位中的相对含量普遍很高, 分别占总脂肪酸的18.8%±3.3%和14.0%±5.6%; 此外, 在所有样品中偶数碳脂肪酸的相对含量均明显高于奇数碳脂肪酸, 证明这些脂肪酸属于典型的生物成因。三种主要的单不饱和脂肪酸, 即16:1ω7、18:1ω7和22:1ω9分别占总脂肪酸的1.9%±1.8%、2.5%±2.5%和8.7%±4.6% (表2)。
表2 阿塔卡马海沟柱状沉积物中脂肪酸的相对含量(单位: %)
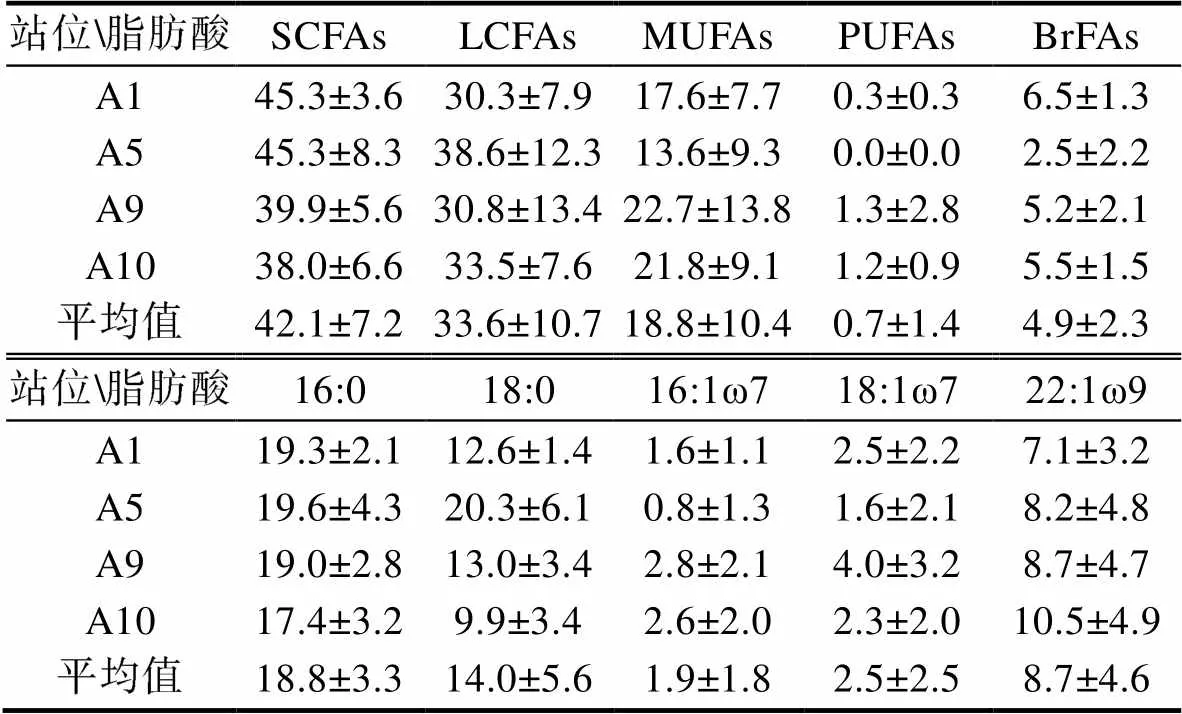
Tab.2 Relative abundance of fatty acids in sediment cores of the Atacama Trench (unit: %)
我们将总脂肪酸含量(total fatty acid, TFA)基于沉积物干重(dry weight sediment, dws)进行归一化, 得到其浓度变化范围为3.0—26.2mg/g dws。其中, 位于非深渊区的A1站位具有最高的TFA含量[平均值为(13.4±2.9)mg/g dws], 而位于深渊区的A5站位TFA含量最低, 平均值仅有(5.4±2.2)mg/g dws。对于所有站位不同类型的脂肪酸而言, SCFAs、LCFAs和MUFAs的含量分别为(4.1±1.8)、(3.1±1.1)和(2.1±1.9)mg/g dws; 而PUFAs和BrFAs的含量较低, 分别为(0.1±0.3)和(0.5±0.4)mg/g dws (表3)。
表3 阿塔卡马海沟柱状沉积物中脂肪酸含量(单位:mg/g dws)

Tab.3 Fatty acid concentration in sediment cores of the Atacama Trench (unit: mg/g dws)
2.2 不同来源脂肪酸的分类结果
按照脂肪酸来源差异的分类方法, 我们绘制出阿塔卡马4个站位不同来源脂肪酸相对含量随深度变化图, 如图2所示。海源脂肪酸在所有站位中的相对含量最高(43.5%—84.2%), 且随着深度的增加而降低; 其次为陆源脂肪酸(11.6%—54.7%), 其百分比随着深度增加而增加; 细菌来源脂肪酸相对贡献不高(0—9.9%), 随深度增加略有上升。

图2 四个沉积柱中不同来源脂肪酸的比例随沉积物深度变化图
2.3 主成分分析和脂肪酸指数
本研究基于50种脂肪酸化合物的组成对四个柱状样进行了主成分分析, 结果如图3所示。前两个主成分解释了55%—71%的总变量, 其中A9站位最高, 主成分1 (轴; 51%)和2 (轴; 20%), 然后是A1站位(61.7%)和A5(59.4%), 最低为A10站位(55.2%)。所有站位均显示, 主成分1的正轴主要是不饱和脂肪酸(MUFAs和PUFAs), 负轴则主要是饱和脂肪酸(SCFAs和LCFAs), 两则分离明显。沿主成分2, 所有的多不饱和脂肪酸都在正轴上(PUFAs), 而一些甲基支链脂肪酸(如11-me C18:0和10-me C16:0)都位于负轴上甲基支链脂肪酸, 但另外一些甲基支链脂肪酸如异构脂肪酸(isoC15:0)和反异构脂肪酸(anteisoC15:0), 则分散于主成分2的正负轴。此外, 单不饱和脂肪酸(MUFAs)和饱和脂肪酸(SCFAs和LCFAs)在主成分2上分离效果也不明显。
根据脂肪酸降解指数公式计算出4个站位FA-Index值在-1.1—2.5之间, 如图4所示, 非深渊站位A1和A9站位FA-Index值分别在-1.1—2.5和-1.0—1.6范围内变动, 深渊站位A5和A10站位FA-Index值分别在-1.1—1.8和-1.1—2.0之间, 且脂肪酸指数在每个站位中都随着深度的增加而降低。
3 讨论
3.1 基于脂肪酸组成的有机质来源解析
3.1.1 海源脂肪酸的分布及影响因素 海源脂肪酸在所有站位中都占主导地位(43.5%—84.2%), 且其含量与总脂肪酸含量呈现出显著的正相关(=0.95), 说明海源有机质的输入强度是决定阿塔卡马海沟沉积物中总脂肪酸含量的决定性因素。这也与该海域受到秘鲁-智利沿岸上升流的强烈影响, 初级生产力高一致(Daneri, 2000)。
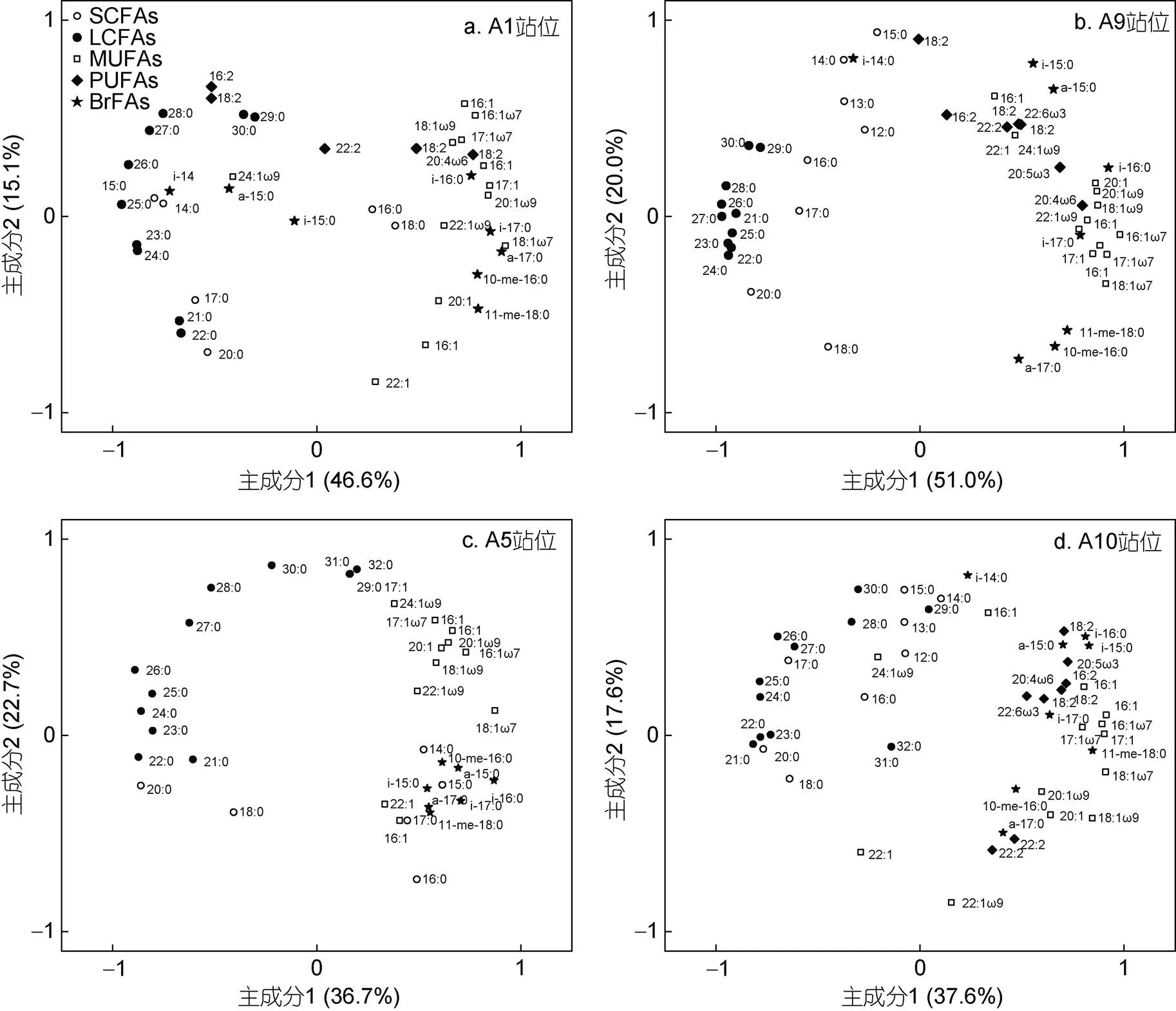
图3 基于脂肪酸组成的第一和第二主成分分析图
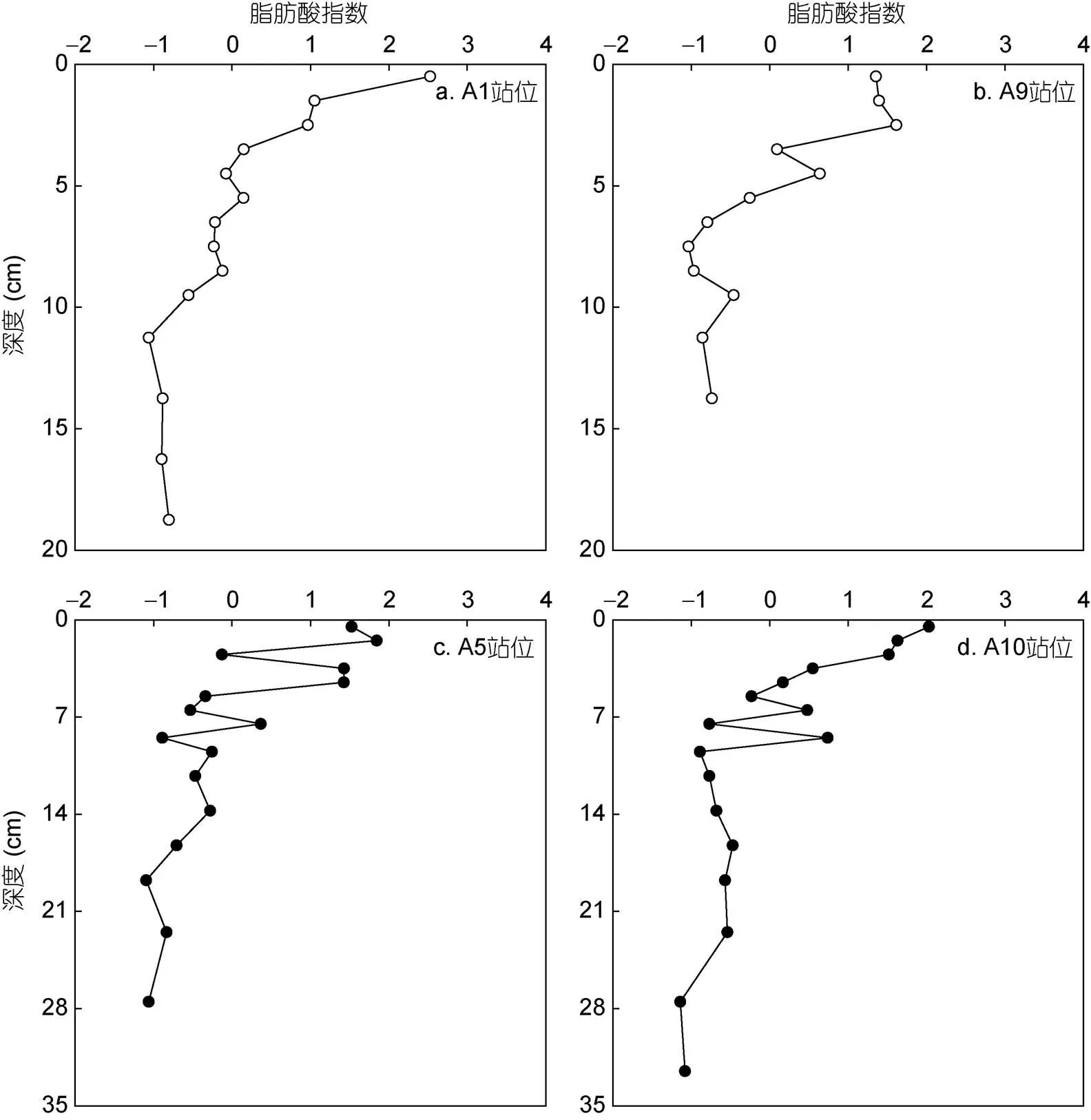
图4 阿塔卡马海沟四个沉积柱中脂肪酸指数(FA-index)随沉积物深度的变化图
对比两个位于同一纬度但分别来自陆向非深渊区(A1)和深渊区(A5)的站位后发现, A1站位的海源脂肪酸含量[(8.6±2.9)mg/g dws]明显高于A5站位[(3.3±1.8)mg/g dws]。我们推测可能的原因包括: (1) 生产力的差异。A1站位更靠近陆地, 年平均净初级生产力为449 g C/(m2·a), 明显高于A5站位的年平均净初级生产力[341 g C/(m2·a)](Behrenfeld, 1997; Xu, 2020)。(2) 水深的影响。A5站位的水深超过7000 m, 属于深渊区, 而A1站位的水深仅为2560 m, 属于半深海区。新鲜的海源有机质在从海洋表层沉降到海底的过程中会经历明显的降解, 而且随着水深的增加降解程度也增大(Wakeham, 1993; Wakeham, 1997), 因此深渊站位极大的水深不利于有机质的垂向沉降。
相比A1和A5站位, 另外一组深渊和非深渊站位(A9和A10)的海源脂肪酸含量差异并不大, 分别为(6.6±4.9)和(6.9±1.9)mg/g dws。导致这两组对比站位出现不同分布特征的原因并不完全清楚, 推测可能与A1和A9这两个非深渊站位的地理位置有关。A9站位水深为4050 m, 明显大于A1站位(2560 m), 且A9站位离岸线更远(图1), 这使得A9站位的年平均净初级生产力[342 g C/(m2·a)]明显低于A1站位[449 g C/(m2·a)], 近似于A10深渊站位的年平均净初级生产能力[306 g C/(m2·a)](Behrenfeld, 1997; Xu, 2020)。
与绝对含量不同, 海源脂肪酸的相对含量并未表现出显著的深渊和非深渊差异(> 0.05)。在A1和A5站位, 海源脂肪酸的比例分别为总脂肪酸的63.2%±7.2%和58.9%±11.1%。这一比例在A9和A10站位分别为64.0%±11.5%和61.0%±6.9%。这表明深渊沉积物中的海洋有机质比例与附近半深海/深海相比, 并没有明显减少, 该结果与马里亚纳海沟区域的分布特征一致(Glud, 2013)。Danovaro等(2003)通过比较阿塔卡马海沟深渊站位(7800 m)和附近浅海站位(1000—1500 m)的表层沉积物后发现, 两者之间具有含量相近的活泼有机质(叶绿素、植物碎屑、易降解有机碳)。考虑到有机质垂向沉降的降解程度通常随着水深的增加而增大(Wakeham, 1993), 本文研究结果支持深渊区的有机质主要来自侧向输运而非垂向沉降的观点。阿塔卡马海沟及邻近海域具有狭窄的陆架、陡峭的海沟斜坡以及频发的地震活动, 这非常有利于浅水区的沉积物(包括脂肪酸)向深渊区的水平输送(Ichino, 2015; Kioka, 2019)。这种输送方式与垂向沉降方式相比, 是更加快速有效的。
海源脂肪酸的比例尽管在4个站位中均较高, 但随着沉积物深度增加均呈现降低的趋势(图2)。在A1、A5、A9和A10柱状样中, 海源脂肪酸的比例从表层到底层分别从80%降至~60%, 69%降至~50%, 81%降至<60%以及64%降至53%。造成这种变化的原因主要是由于海洋来源的短链和不饱和脂肪酸, 与长链和饱和脂肪酸相比化学性质更加活泼, 因此在埋藏后会被选择性降解(Sun, 1997)。此外, 随着沉积物深度的增加, 底栖生物丰度显著下降, 因此原位产生对海源脂肪酸的贡献也会大幅度降低。这与Danovaro等(2002)对阿塔卡马海沟底栖动物的丰度研究结果一致, 即底栖动物的总密度和生物量随着沉积物深度的增加而降低。
我们基于脂肪酸组分得到的结果也得到了其他生物标志物数据的支持。2020年, Xu等(2020)分析了阿塔卡马海沟表层沉积物中来自海洋浮游古菌和土壤细菌的甘油二烷基甘油四醚(GDGTs)化合物。结果显示, 在所有的沉积物样品中, 来自海洋古菌的类异戊二烯GDGTs的含量要明显高于来自陆地细菌的支链GDGTs化合物, 同时指示土壤有机碳输入的BIT指标低于0.1 (Xu, 2020)。因此脂肪酸和GDGTs数据均支持海源有机质在阿塔卡马海沟沉积物的主导地位。
3.1.2 陆源脂肪酸的分布及影响因素 陆源脂肪酸在所有站位中的占比仅次于海源脂肪酸, 其含量[(3.1±1.1)mg/g dws]约为海源脂肪酸[(6.3±3.5)mg/g dws]的一半, 表明在研究区域陆源有机质的贡献要明显低于海源有机质。一个原因可能是由于研究海域临近阿塔卡马沙漠, 其极端干旱的气候一方面限制了陆地植被的发育, 另一方面无法形成大型河流, 限制了陆地物质向海洋的输送。陆源有机质对脂肪酸的贡献还可通过同位素(13C)和碳氮元素比值(C/N)来评估。海源有机质的13C值在–22‰到–20‰之间, 其C/N比值一般为4—10; 而以C3植物为主的陆源有机质具有明显偏负的13C值, 范围为–27‰到–25‰, C/N比值则高于20 (Meyers, 1997)。Quade等(2007)对阿塔卡马沙漠地区的土壤和植被进行了调查, 发现该地区存在C3和C4植被共存的现象, 土壤有机质的13C在–26.5‰到–21.6‰之间, 平均值为–24.1‰。本研究的4个站位中, 沉积有机质的13C在–22.8‰到–21.0‰, C/N比在6.8—11.1之间, 都支持了阿塔卡马海沟沉积有机碳主要来自海源贡献, 而不是陆源有机质的贡献。
比较各站位的陆源脂肪酸后发现, 非深渊海沟站位的陆源脂肪酸相对含量(A1: 30.3%±7.9%; A9: 30.8%±13.4%)要略低于深渊海沟(A5: 38.6%±12.3%; A10: 33.5%±7.6%), 但两者之间无显著性差异(> 0.05)。这种差异可能与有机质在向深渊的搬运过程中, 海源脂肪酸相对于陆源脂肪酸优先降解有关(Sun, 1997)。此外, 在所有站位的柱状样中, 陆源脂肪酸的比例均出现随深度增加而增大的趋势(图2), 反映出长链饱和脂肪酸在早期降解过程中的选择性保存。
3.1.3 细菌脂肪酸的分布及影响因素 细菌脂肪酸代表着细菌等微生物对有机质的贡献, 可指示细菌分解活动的强弱。在本研究涉及的4个站位中, 细菌脂肪酸的平均浓度为(0.5±0.4)mg/g dws, 仅占总脂肪酸的4.9%±2.3%。该结果显著低于中国近岸海域细菌脂肪酸比例和含量, 如东海、南海表层沉积物中细菌脂肪酸比例可到20%以上(李凤等, 2016; 杨义等, 2018), 反映了深渊极大的压力和接近冰点的温度可能抑制了细菌脂肪酸的合成。
在所有的沉积物柱状样中, 细菌脂肪酸的比例都随着深度的增加呈现下降的趋势, 但其幅度要明显小于海源脂肪酸, 说明细菌来源的支链脂肪酸具有比短链脂肪酸和不饱和脂肪酸更强的抗降解能力。此外, 前人的研究发现微生物能够生活在海底2500 m深的沉积物中(Inagaki, 2015), 因此深层沉积物中细菌的原位生产也可能在一定程度上抵消了细菌脂肪酸随深度的下降幅度。
3.2 脂肪酸指示深渊和非深渊区不同的有机质搬运机制
在非深渊区站位(A1和A9), 表层总脂肪酸的含量较高(表1), 表明由于上升流带来的营养盐使得表层浮游植物勃发, 增加了颗粒有机质的沉降。此外, 如图5所示, 非深渊区站位的总脂肪酸含量基本随着深度呈现出负指数变化, 表现出典型的有机质早期成岩特征(Camacho-Ibar, 2003), 其中在最上部0—2cm表现出大幅度的下降, 下部随着深度增加缓慢下降, 尽管A9站位在10 cm以深又出现一定程度的上升。因此我们推测非深渊区站位的沉积环境是相对稳定的, 其沉积有机质主要来自上部水体颗粒物的垂向输入。
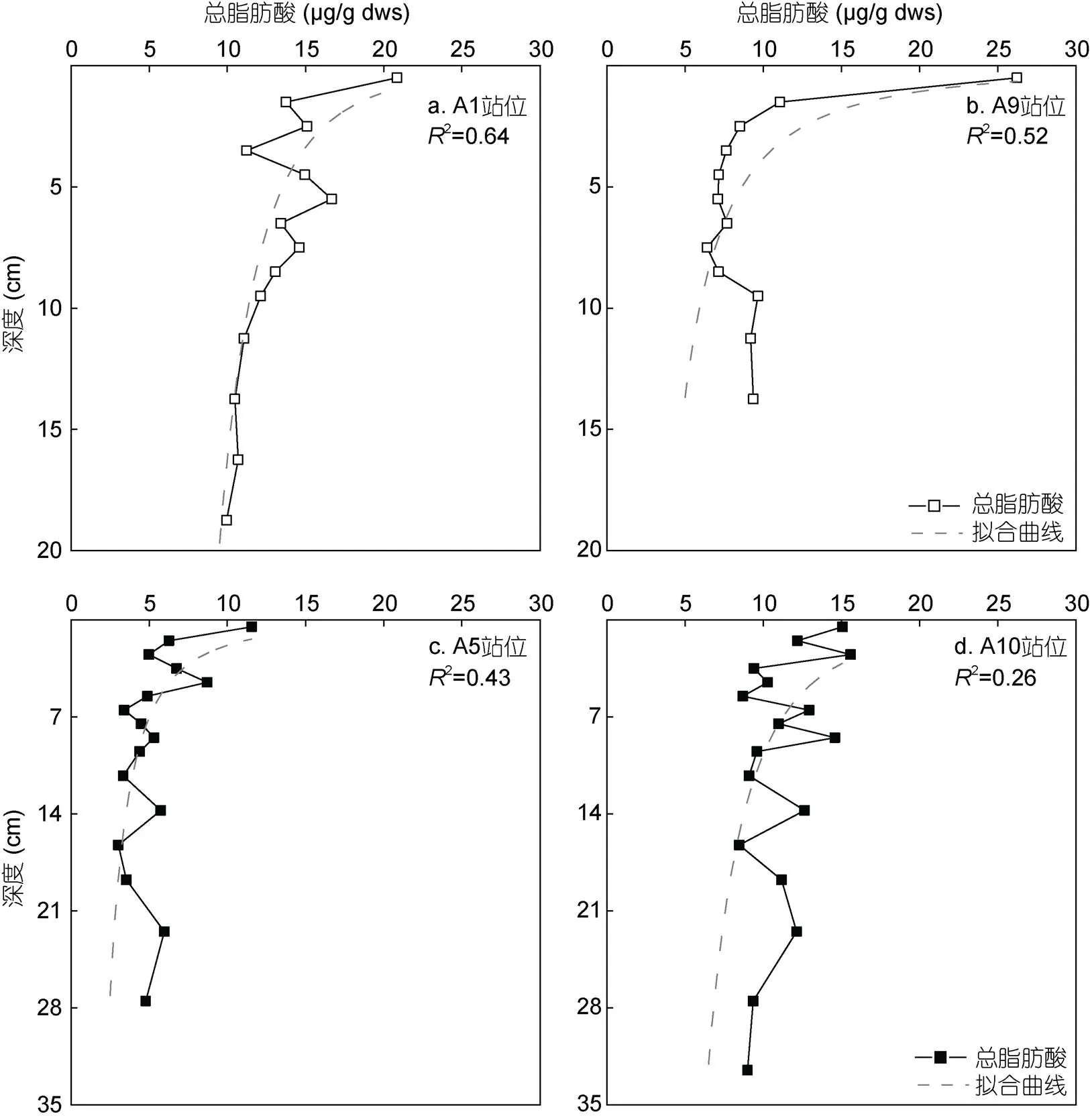
图5 阿塔卡马海沟四个沉积柱中总脂肪酸含量随沉积物深度的变化图
在两个水深大于6000 m的深渊站位(A5和A10), 脂肪酸的分布难以用传统的“生物泵”来解释, 因为随着水深的增加, 有机质在沉降过程中经历的矿化作用也会加大, 最终将导致绝大部分有机质在到达深渊之前就被降解了(De La Rocha, 2007)。然而A5和A10站位虽然总脂肪酸含量低于非深渊站位, 但并未显示出明显的随深度下降的趋势。这说明两个深渊站位可能并不是稳定的沉积环境, 而是由于突发地质事件(如地震)引起的海底浊流等导致沉积物和有机质输入的突变。这种推测也得到了我们尚未发表的放射性碳同位素数据(14C)的支持, 即随着沉积深度的增大,14C年龄出现倒转现象。Bao等(2018)在日本海沟也发现了类似的结果, 即地震会导致沉积柱状物中14C年龄的突变。因此, 我们推测侧向搬运可能对深渊物质输入起着关键作用。这可能包含两种机制。一种机制是在海流和潮波等作用下, 细颗粒沉积物以深部或底部雾状层形式向深处搬运, 途中经历多次悬浮-沉降过程, 最终抵达海沟底部; 另一种机制是由于地震等突发事件造成海沟斜坡沉积物的大面积塌方, 形成浊流向海沟底部快速搬运(Nittrouer, 1994; Turnewitsch, 2014)。值得注意的是, Von Huene (1989)和Völker等(2008)曾在阿塔卡马海沟发现了浊流的印记。历史资料也显示, 阿塔卡马海沟所属的智利海域曾多次发生七级以上的大地震, 加上海沟两侧陡峭的斜坡非常有助于浅水区沉积物向海沟底部的搬运, 从而提高有机质向深渊区的输运效率。一个典型的例子是日本2011年发生的“311大地震”, 一次性向日本海沟深渊区输送了超过100万吨的有机碳(Kioka, 2019)。基于上述分析, 我们推测深渊海沟有机质的输运主要是侧向输入而不是垂向输运, 海沟两侧的坡度和地震强度是影响有机质侧向输运的重要因素。
3.3 阿塔卡马海沟沉积有机质的保存评估
由于沉积有机质在来源和化学结构上非常复杂, 利用单一生物标志物指示有机质的保存往往存在局限性。因此, 本研究考虑了所有可检测到的脂肪酸化合物, 通过主成分分析的结果来计算FA-Index, 进而评估阿塔卡马海沟脂肪酸的降解情况。如图6所示, 我们分别将长链饱和脂肪酸摩尔百分比和单不饱和脂肪酸摩尔百分比与FA-Index作相关性分析后发现, 沉积物的深度越深, FA-Index值越低, 长链饱和脂肪酸摩尔百分比越高, 单不饱和脂肪酸摩尔百分比越低。这种变化趋势与第一主成分有很好的对应, 即第一主成分的正轴和负轴分别受控于单不饱和脂肪酸和长链饱和脂肪酸的变化。因此, FA-Index值可以表征阿塔卡马海沟有机质的降解程度, 即FA-Index随着有机质新鲜程度的降低而降低。
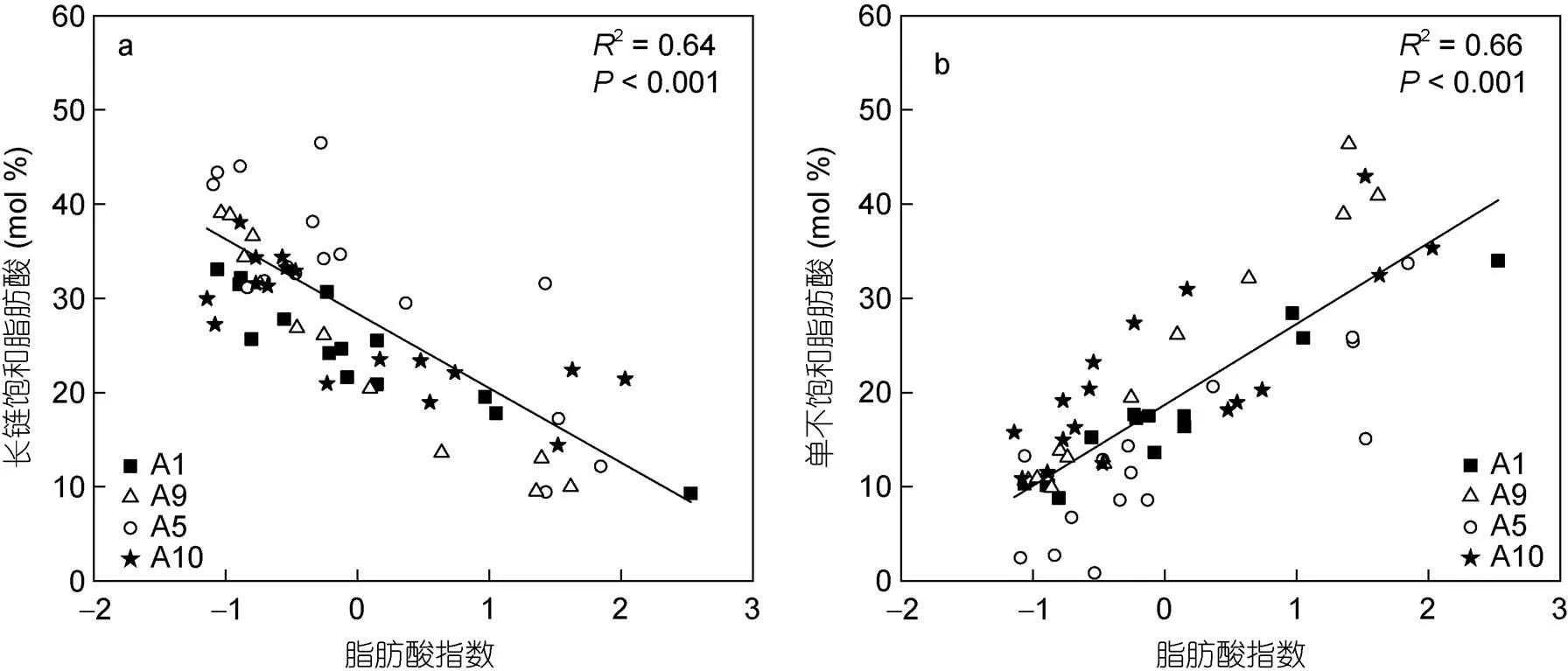
图6 长链饱和脂肪酸(LCFAs, a)及单不饱和脂肪酸(MUFAs, b)的摩尔百分比与脂肪酸指数的线性关系图
如图4a, 4c所示, 表层A1站位的FA-Index值高于A5站位, 表明在非深渊A1站位, 表层沉积有机质的新鲜程度更高, 这可能归功于A1站位更高的生产力, 而更浅的水深也降低了水柱中有机质的分解。然而A1站位的FA-Index值随深度的降幅却要大于A5站位, 即脂肪酸在A1站位降解更为显著, 这表明相较于非深渊站位, 深渊海沟的有机质具有更高的保存程度。出现这种现象的原因一方面与海沟独特的地形有关, 其“V”形断面有助于有机质的汇聚, 甚至会沿着轴线向更深处搬运并埋藏(Ichino, 2015)。图4c还显示, 在A5深渊站位, FA-Index值在多个层位发生了较大幅度的突变, 这很可能与该区域曾发生过大规模的地质活动有关。
尽管A9站位的表层总脂肪酸含量(26.2mg/g dws)高于A10站位(15.1mg/g dws), 但如图4b, 4d所示, A9站位对应的FA-Index值却低于A10站位, 说明非深渊站位的表层沉积有机质具有更大程度的降解。这种情况的出现是由于在A9站位, 表层沉积物与A10站位(9.8mg/g dws)相比, 含有更高含量的短链饱和脂肪酸和不饱和脂肪酸(21.5mg/g dws), 而这些高活性的化合物随深度增加出现了快速降解。因此在柱状样中, A9站位的降解速度高于A10站位。但就FA-Index值随深度的变化来看, A10站位FA-Index值随深度变化幅度大于A9站位, 即新鲜脂肪酸在深渊海沟中的埋藏量少。从图4d中也可以发现, A10站位FA-Index值在5—10 cm处发生较大的波动, 很可能意味着偶尔发生的地质活动(如地震)会带来含量更低或惰性更强的有机质, 使本来就有限的海源新鲜有机质的占比在惰性有机质的稀释作用下变得更低。
以上结果表明, 有机质在深渊和非深渊环境中的保存不仅与上层水体的初级生产力密切相关, 还受到海沟独特的地形、不可预测的地质活动以及有机质侧向输运的影响。
4 结论
本研究通过分析阿塔卡马海沟沉积脂肪酸的含量及组成, 评估了深渊和非深渊区沉积有机质的来源、输运及保存特征, 得出以下4个结论。
(1) 阿塔卡马海沟无论是深渊还是非深渊站位, 沉积有机质均以海洋来源为主, 这可能与该海域上升流引起的高生产力以及邻近陆地极度干旱、植被稀疏和缺乏大河有关。
(2) 在每一站位, 脂肪酸组成随着沉积深度表现出明显的变化, 其中长链饱和脂肪酸逐渐增加, 而短链饱和脂肪酸和不饱和脂肪酸则显著降低, 表现出不同脂肪酸化合物在抗降解性上的差异。
(3) 深渊和非深渊站位的总脂肪酸含量随沉积深度表现出不同的分布趋势, 其中前者基本稳定, 而后者随深度明显降低, 表明非深渊站位具有较稳定的沉积环境, 而深渊站位由于频繁的地震活动和独特的V形海底地貌, 使得物质输入以偶发事件引起的侧向输送为主。
基于脂肪酸指数(FA-Index)可以有效地表征沉积物中脂肪酸的降解。阿塔卡马海沟中有机质的保存及埋藏不仅与其生物量及初级生产力有重要关系, 也与深渊海沟独特的地形环境、不可预测的各种地质活动以及有机质的侧向输运等相关。
致谢 感谢德国太阳号科考船(RV SONNE)261航次的全体船员和航次科学家在采样过程中提供的帮助, 特别感谢南丹麦大学的Ronnie Glud教授和Anni Glud女士在航次准备、样品分割和运输过程中的辛苦劳动。
李 凤, 贺行良, 徐 刚等, 2016. 东海近岸表层沉积物中脂肪酸与脂肪醇的组成以及分布与来源. 海洋地质与第四纪地质, 36(4): 13—18
李 栋, 赵 军, 刘诚刚等, 2018. 超深渊生境特征及生物地球化学过程研究进展. 地球科学, 43(S2): 162—178
杨 义, 郝宇昕, 阮小燕等, 2018. 南海不同水深表层沉积物脂肪酸分布特征及其生物源的空间变化. 地球科学, 43(11): 4027—4035
张前前, 唐晓静, 王修林等, 2006. 脂类生物标志物在海洋环境中的应用与研究进展. 中国海洋大学学报, 36(3): 381—385
张海生, 潘建明, 陈建芳等, 2007. 楚科奇海和白令海沉积物中的生物标志物及其生态环境响应. 海洋地质与第四纪地质, 27(2): 41—49
Behrenfeld M J, Falkowski, P G, 1997. Photosynthetic rates derived from satellite-based chlorophyll concentration. Limnology Oceanography, 42(1): 1—20
Budge S M, Iverson S J, Koopman H N, 2006. Studying trophic ecology in marine ecosystems using fatty acids: A primer on analysis and interpretation. Marine Mammal Science, 22(4): 759—801
Camacho-Ibar V F, Aveytua-Alcázar L, Carriquiry J D, 2003. Fatty acid reactivities in sediment cores from the northern Gulf of California. Organic Geochemistry, 34(3): 425—439
Canuel E A, Martens C S, 1996. Reactivity of recently deposited organic matter: Degradation of lipid compounds near the sediment-water interface. Geochimica et Cosmochimica Acta, 60(10): 1793—1806
Daneri G, Dellarossa V, Quiñones R, 2000. Primary production and community respiration in the Humboldt Current System off Chile and associated oceanic areas. Marine Ecology Progress Series, 197: 41—49
Danovaro R, Croce N D, Dell’Anno A, 2003. A depocenter of organic matter at 7800 m depth in the SE Pacific Ocean. Deep Sea Research Part I: Oceanographic Research Papers, 50(12): 1411—1420
Danovaro R, Gambi C, Croce N D, 2002. Meiofauna hotspot in the Atacama Trench, eastern South Pacific Ocean. Deep Sea Research Part I: Oceanographic Research Papers, 49(5): 843—857
De Carvalho C C C R, Caramujo M J, 2018. The various roles of fatty acids. Molecules, 23(10): 2583
De La Rocha C L, Passow U, 2007. Factors influencing the sinking of POC and the efficiency of the biological carbon pump. Deep Sea Research Part II: Topical Studies in Oceanography, 54(5—7): 639—658
Diefendorf A F, Freimuth E J, 2017. Extracting the most from terrestrial plant-derived-alkyl lipids and their carbon isotopes from the sedimentary record: a review. Organic Geochemistry, 103: 1—21
Escribano R, Pérez C S, 2010. Variability in fatty acids of two marine copepods upon changing food supply in the coastal upwelling zone off Chile: importance of the picoplankton and nanoplankton fractions. Journal of the Marine Biological Association of the United Kingdom, 90(2): 301—313
Espinosa L F, Pantoja S, Pinto L A, 2009. Water column distribution of phospholipid-derived fatty acids of marine microorganisms in the Humboldt Current system off northern Chile. Deep Sea Research Part II: Topical Studies in Oceanography, 56(16): 1063—1072
Glud R N, Wenzhöfer F, Middelboe M, 2013. High rates of microbial carbon turnover in sediments in the deepest oceanic trench on Earth. Nature Geoscience, 6(4): 284—288
Gutiérrez M H, Pantoja S, Lange C B, 2012. Biogeochemical significance of fatty acid distribution in the coastal upwelling ecosystem off Concepción (36°S): Chile. Organic Geochemistry, 49: 56—67
Houston J, 2006. Variability of precipitation in the Atacama Desert: its causes and hydrological impact. International Journal of Climatology, 26(15): 2181—2198
Hu J F, Zhang H B, Peng P A, 2006. Fatty acid composition of surface sediments in the subtropical Pearl River estuary and adjacent shelf, Southern China. Estuarine, Coastal and Shelf Science, 66(1—2): 346—356
Ichino M C, Clark M R, Drazen J C, 2015. The distribution of benthic biomass in hadal trenches: a modelling approach to investigate the effect of vertical and lateral organic matter transport to the seafloor. Deep Sea Research Part I: Oceanographic Research Papers, 100: 21—33
Inagaki F, Hinrichs K U, Kubo Y, 2015. Exploring deep microbial life in coal-bearing sediment down to ~2.5 km below the ocean floor. Science, 349(6246): 420—424
Itoh M, Kawamura K, Kitahashi T, 2011. Bathymetric patterns of meiofaunal abundance and biomass associated with the Kuril and Ryukyu trenches, western North Pacific Ocean. Deep Sea Research Part I: Oceanographic Research Papers, 58(1): 86—97
Jamieson A, 2015. The Hadal Zone: Life in the Deepest Oceans. Cambridge, USA: Cambridge University Press
Jamieson A J, Fujii T, Mayor D J, 2010. Hadal trenches: the ecology of the deepest places on Earth. Trends in Ecology & Evolution, 25(3): 190—197
Kaneda T, 1991. Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. Microbiological Reviews, 55(2): 288—302
Kelly J R, Scheibling R E, 2012. Fatty acids as dietary tracers in benthic food webs. Marine Ecology Progress Series, 446: 1—22
Kioka A, Schwestermann T, Moernaut J, 2019. Megathrust earthquake drives drastic organic carbon supply to the hadal trench. Scientific Reports, 9(1): 1553
Li D, Zhao J, Yao P, 2020. Spatial heterogeneity of organic carbon cycling in sediments of the northern Yap Trench: Implications for organic carbon burial. Marine Chemistry, 223: 103813
Loh A N, Canuel E A, Bauer J E, 2008. Potential source and diagenetic signatures of oceanic dissolved and particulate organic matter as distinguished by lipid biomarker distributions. Marine Chemistry, 112(3—4): 189—202
Meyers P A, 1997. Organic geochemical proxies of paleoceanographic, paleolimnologic, and paleoclimatic processes. Organic Geochemistry, 27(5—6): 213—250
Mrozik A, Nowak A, Piotrowska-Seget Z, 2014. Microbial diversity in waters, sediments and microbial mats evaluated using fatty acid-based methods. International Journal of Environmental Science and Technology, 11(5): 1487—1496
Niggemann J, Schubert C J, 2006. Fatty acid biogeochemistry of sediments from the Chilean coastal upwelling region: Sources and diagenetic changes. Organic Geochemistry, 37(5): 626—647
Nittrouer C A, Wright L D, 1994. Transport of particles across continental shelves. Reviews of Geophysics, 32(1): 85—113
Parrish C C, 2013. Lipids in marine ecosystems. ISRN Oceanography, 2013: 604045
Pruski A M, Buscail R, Bourgeois S, 2015. Biogeochemistry of fatty acids in a river-dominated Mediterranean ecosystem (Rhône River prodelta, Gulf of Lions, France): Origins and diagenesis. Organic Geochemistry, 83—84: 227—240
Quade J, Rech J A, Latorre C, 2007. Soils at the hyperarid margin: the isotopic composition of soil carbonate from the Atacama Desert, Northern Chile. Geochimica et Cosmochimica Acta, 71(15): 3772—3795
Bao R, Strasser M, McNichol A P, 2018.Tectonically- triggered sediment and carbon export to the Hadal zone. Nature communications, 9(1): 121—418
Seguel C G, Mudge S M, Salgado C, 2001. Tracing sewage in the marine environment: altered signatures in Concepción Bay, Chile. Water Research, 35(17): 4166—4174
Stewart H A, Jamieson A J, 2018. Habitat heterogeneity of hadal trenches: Considerations and implications for future studies. Progress in Oceanography, 161: 47—65
Sun M Y, Wakeham S G, Lee C, 1997. Rates and mechanisms of fatty acid degradation in oxic and anoxic coastal marine sediments of Long Island Sound, New York, USA. Geochimica et Cosmochimica Acta, 61(2): 341—355
Turnewitsch R, Falahat S, Stehlikova J, 2014. Recent sediment dynamics in hadal trenches: Evidence for the influence of higher-frequency (tidal, near-inertial) fluid dynamics. Deep Sea Research Part I: Oceanographic Research Papers, 90: 125—138
Völker D, Reichel T, Wiedicke M, 2008. Turbidites deposited on Southern Central Chilean seamounts: Evidence for energetic turbidity currents. Marine Geology, 251(1—2): 15—31
Volkman J K, 2007. Lipid markers for marine organic matter. In: Volkman J K ed. Marine Organic Matter: Biomarkers, Isotopes and DNA. Berlin, Heidelberg: Springer, 27—70
Von Huene R, Bourgois J, Miller J, 1989. A large tsunamogenic landslide and debris flow along the Peru Trench. Journal of Geophysical Research, 94(B2): 1703—1714
Wakeham S G, Amann R, Freeman K H, 2007. Microbial ecology of the stratified water column of the Black Sea as revealed by a comprehensive biomarker study. Organic Geochemistry, 38(12): 2070—2097
Wakeham S G, Hedges J I, Lee C, 1997. Compositions and transport of lipid biomarkers through the water column and surficial sediments of the equatorial Pacific Ocean. Deep Sea Research Part II: Topical Studies in Oceanography, 44(9—10): 2131—2162
Wakeham S G, Lee C, 1993. Production, transport, and alteration of particulate organic matter in the marine water column. In: Engel M H, Macko S A eds. Organic Geochemistry: Principles and Applications. Boston: Springer, 145—169
Xu Y P, Ge H M, Fang J S, 2018. Biogeochemistry of hadal trenches: recent developments and future perspectives. Deep Sea Research Part II: Topical Studies in Oceanography, 155: 19—26
Xu Y P, Jia Z H, Xiao WJ, 2020. Glycerol dialkyl glycerol tetraethers in surface sediments from three Pacific trenches: distribution, source and environmental implications. Organic Geochemistry, 147: 104079
Yunker M B, Belicka L L, Harvey H R, 2005. Tracing the inputs and fate of marine and terrigenous organic matter in Arctic Ocean sediments: a multivariate analysis of lipid biomarkers. Deep Sea Research Part II: Topical Studies in Oceanography, 52(24—26): 3478—3508
COMPARISON OF FATTY ACIDS IN SEDIMENTS FROM HADAL AND NON-HADAL SITES OF THE ATACAMA TRENCH
XIANG Yu, WANG Ya-Song, XIAO Wen-Jie, HAN Lu-Lu, XU Yun-Ping
(Shanghai Engineering Research Center of Hadal Science & Technology, College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China)
The hadal trenches, as the deepest ocean realm, are one of the least explored habitats on the Earth. The input, abundance and bioavailability of organic matter play a key role in sustaining hadal ecosystem and hadal biogeochemical cycle. In this study, fatty acid (FA) biomarkers were used to investigate four sediment cores (15—35 cm long) from the Atacama Trench region (2560—7770 m) water depth), and FA concentration, source and distribution between hadal sites (A5, A10) and non-hadal sites (A1, A9) were compared. A total of 50 FA compounds were identified, including terrestrially derived long chain saturated FAs, marine plankton derived short chain saturated FAs, monounsaturated FAs and polyunsaturated FAs, and bacteria derived branched FAs. The concentration of total FAs was the highest at the non-hadal site A1 [(13.4±2.9)mg/g dws], and the lowest at the hadal site A5 [(5.4±2.2) μg/g dws], which was likely related to primary productivity and water depth at each site. The fractional abundance of marine derived FAs (61.6%±9.2%) is higher than that of terrestrial FAs (33.6%±10.7%) and bacterial FAs (4.9%±2.3%) at all sites, suggesting the predominance of marine organic carbon in the Atacama Trench region. In addition, downward profiles were shown with an increasing trend of terrestrial FAs at the expense of marine derived FAs in all cores, suggesting the selected degradation of short chain and unsaturated FAs from long chain and saturated FAs. In addition, the concentrations of total FAs at the non-hadal sites substantially decrease with increasing sediment depth, presenting a typical early diagenesis of organic matter under steady depositional conditions. However, such a trend was not observed at the hadal sites, suggesting that disturbed depositional conditions were likely due to earthquake-induced turbidity current that contributed to efficient transport of organic carbon from non-hadal to hadal environments and burial in the deepest ocean.
hadal trench; fatty acid; Atacama Trench; biomarker; organic carbon
* 国家自然科学基金, 41976030号; 欧盟HADES-ERC, 669947号。项 羽, 硕士研究生, 2407502948@qq.com
许云平, 教授, 博士生导师, E-mail: ypxu@shou.edu.cn
2020-09-07,
2020-11-14
P734.5
10.11693/hyhz20200900249
