钆贝葡胺核磁共振增强与CT多期增强扫描对肝硬化伴小肝癌诊断的对比研究*
2021-05-25王德志胡海洋郭长华
王德志 胡海洋 郭长华 宋 磊
1.华润辽健集团本钢总医院放射科 (辽宁 本溪, 117000) 2.大连医科大学
肝硬化不仅可导致肝功能异常,还可能诱发肝癌[1]。据文献统计,80%~90%的肝细胞癌(HCC)患者都合并有肝硬化[2]。因此肝癌病灶的早期发现与及时治疗对改善患者预后意义重大。钆贝葡胺(Gd-BOPTA)MRI增强与CT多期增强扫描(MDCT)作为一项准确评价肝硬化伴小肝癌的影像学检测技术已广泛应用于临床。Gd-BOPTA是一种具有肝细胞特异性的新型对比剂,经胆道排泄,对小肝癌有较高的检出率[3]。目前,Gd-BOPTA增强MRI与MDCT对于肝硬化伴小肝癌的诊断效能、主要征象有何差异尚不明确。笔者旨在对肝硬化伴≤3 cm的小肝癌(SHCC)在Gd-BOPTA增强MRI与MDCT的影像学表现进行对比分析,探讨这两种检测方法对小肝癌检出的优劣,评估LAVA序列诊断SHCC的临床价值。
1 资料与方法
1.1 一般资料 选取2018年1月至2019年1月在我院诊治的96例肝硬化伴小肝癌患者为研究对象,其中男70例,女26例,年龄27~71岁,平均(47.32±4.88)岁;Child-pugh分级:A级51例,B级35例,C级10例;AFP水平:<7 ng/ml 51例,≥7 ng/ml 45例。
1.2 诊断标准 诊断依据中国抗癌协会病理专业委员会制定的《原发性肝癌规范化病理诊疗指南》中的标准[4]。
1.3 纳入与排除标准 纳入标准:①均为肝硬化伴肝癌患者,均经病理学证实;②肝癌直径≤3 cm的小肝癌患者;③穿刺或手术前未经有创性治疗。排除标准:①无肝硬化背景的小肝癌患者;②MDCT或Gd-BOPTA增强MRI图像差,无法满足诊断要求者。
1.4 方法 所有患者于术前接受CT扫描、MRI平扫、LAVA增强序列扫描,两种检查5 d<间隔时间<1个月,检查顺序不分先后。CT检查:采用64排螺旋CT(GE Lightspeed VCT)对患者进行扫描,参数:准直器宽度=0.625 mm,层间距=5 mm,层厚=5 mm,管电压为120 kV,管电流280~370 mA。增强扫描:经肘静脉用高压注射器注射碘佛醇对比剂,以速度为3.5 ml/s做3期动态扫描,动脉期、门静脉期、平衡期,分别为30 s、65 s、150 s。将初始图像传送至ADW4.4工作站。
MRI检查:行3.0 T超导磁共振成像仪(荷兰飞利浦公司,In genia)进行检查,配8通道相控阵线圈。患者仰卧位,扫描时嘱患者呼气末屏气。MRI扫描序列:T2WI脂肪抑制快速恢复自旋回波,参数:TR 6000 ms,TE 103.9 ms,FOV 42 cm×31.5 cm,层厚8 mm,层间距2 mm;T1WI双回波扰相梯度回波(同相位),参数:TR 230 ms,TE 2.4 ms,FOV 42 cm×37.8 cm,层厚8 mm,层间距2 mm;当b=1 000时的DWI序列,参数:TR 7 500 ms,TE 62.1 ms,FOV 42 cm×31.5 cm,层厚8 mm,层间距2 mm;增强动态期扫描采用LAVA序列行全肝扫描,参数:①LAVA(轴位):TR 3.6 ms,TE 1.5 ms,FOV 40 cm×40 cm,层厚4.4 mm,接收带宽125 KHz,翻转角12°;②LAVA(冠状位):TR 3.7 ms,TE 1.7 ms,FOV 44 cm×41.8 cm,层厚3.2 mm,接收带宽83.3 KHz,翻转角12°;③LAVA(矢状位):TR 4 ms,TE 1.9 ms,FOV 44 cm×41.8 cm,层厚3.2 mm,接收带宽83.3 KHz,翻转角12°。经肘前静脉用高压注射器注射Gd-BOPTA对比剂,一次屏气动脉期扫描3期、门静脉期扫描3期、平衡期扫描1期、肝胆扫描1期,图像采用动脉期早期注入0.2 mmol/kg Gd-BOPTA 21 s后的图像,动脉期28 s,门静脉期65 s,平衡期180 s,肝胆期2 h。
1.5 图像分析 由两位10年以上肝脏疾病影像学诊断经验的医生采用双盲法进行CT、MRI图像分析,阅片双向一致时为最终的结果。主要观察病灶的数目、大小、强化特点、假包膜等。①对两位医生的诊断信心按5分制进行评分[5]:1分:毫无信心;2分:信心很低;3分:信心中等;4分:信心很高;5分:非常确信。②计算病灶体积[V=abc/2(a:横轴位最大径线;b:冠状位最大径线;c:矢状位最大径线),CT未显示病灶径线的记为0]、准确率。
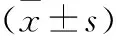
2 结果
2.1 两种检测方法病灶检出情况 见表1。96例患者检出病灶142个,形状为圆形或椭圆形。病灶位于S2、S3、S4a、S4b、S5、S6、S7、S8的数目依次为:10、15、15、12、8、26、26、30个。MRI对病灶体积大小测量的准确性、病灶检出率均要高于CT。
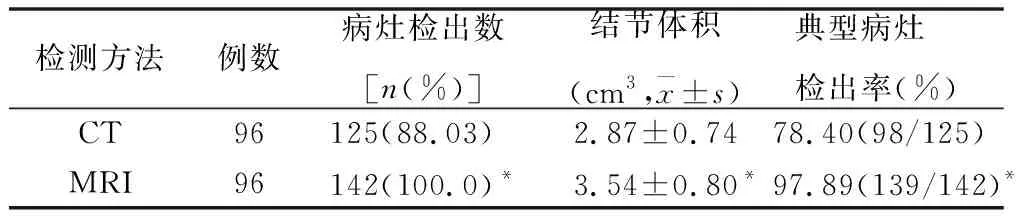
表1 CT、MRI检出病灶比较
2.2 肝硬化伴小肝癌的CT、MRI影像学表现 CT影像学表现:CT动脉期检出98个病灶,其中呈低密度10个,等密度2个,高密度86个,检出率是69.01%;门静脉期检出96个病灶,其中呈低密度51个,等密度40个,高密度5个,检出率是67.60%;平衡期检出125个病灶,其中呈低密度101个,等密度19个,高密度5个,检出率是88.73%。在平衡期的检出率明显高于动脉期、门静脉期。CT增强扫描时肝动期病灶呈高密度表现,门静脉期、平衡期为低密度或等密度表现。
MRI影像学表现:T1WI检出106个病灶,呈高、低或混杂信号;T2WI检出116个病灶,呈高或混杂信号;DWI检出121个病灶,呈高信号。LAVA增强扫描发现动脉早期116个病灶,动脉晚期132个病灶,均以高信号或稍高信号为主;门静脉期、平衡期、肝胆期分别检出病灶122、117、127个,均以低信号或稍低信号为主,呈现快进快出的特征。
2.3 CT、MRI检测对SHCC包膜边缘强化特点 见表2。CT对SHCC假包膜显示率为64.78%(92/142),MRI对SHCC假包膜显示率为83.10%(118/142)。两者比较差异有统计学意义(χ2=12.354,P=0.000)。

表2 CT、MRI对SHCC包膜边缘强化特点比较 (n)
2.4 医生对两种检测方法诊断信心评分情况 见表3。
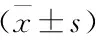
表3 医生对两种检测方法诊断信心评分比较
3 讨论
肝硬化背景下肝癌的发生经历了再生结节-低级别不典型增生结节-高级别不典型增生结节-部分癌变结节-完全癌变结节的病理改变过程。MRI及CT多期增强扫描是目前临床上无创性诊断原发性肝癌的最佳检查方法。
本研究结果发现,针对≤3 cm的肝癌,MRI较CT有更好的诊断效能。原因是:①CT多期增强扫描虽有很高的空间及时间分辨率,但对小肝癌检出具有一定的局限性,因肝硬化背景下的肝癌病灶密度不均,差异大,没有典型的强化方式等[6,7];②Gd-BOPTA对比剂因特殊的生物学及药代动力学特征,使MRI动脉期对细胞外信号强度产生较大影响,且3%~5%的注射剂量会被正常肝脏摄取,因摄取量小和价格低廉而被临床广泛应用[8];③3.0 T MRI具有更高的空间及时间分辨率,尤其是并行采集技术的应用[9];④LAVA序列是一种全新的脂肪抑制技术和K空间填充物,可以对各时相数据进行采集,还能将病灶在动脉期、门静脉期、平衡期、肝胆期的强化特点及假包膜化特点很好地呈现出来。另外,LAVA序列层厚达2 mm,对血供丰富的小病灶边缘及细节显示的很好,有利于小肝癌的发现[10]。本研究结果显示,病灶检出率MRI明显高于CT,提示MRI中的LAVA序列对肝硬化伴小肝癌敏感,检出率高。原因是:①CT强化动脉期为20~25 s,时间窗较窄,很难抓到真正的动脉期;②背景肝细胞受损,对比剂摄取较难,导致在背景肝与病灶在CT增强扫描中密度差减小。本研究还发现,CT对小肝癌在动脉期显示以高密度影像学表现为主,门静脉期与平衡期以低密度为主;MRI对小肝癌动脉期以高信号影像学表现为主,门静脉期、平衡期及肝胆期以低信号为主,呈现快进快出的特征,与荆航等[11]研究结果相符。同时有文献报道,假包膜(呈双重结构,内层薄而外层有丰富的血管及新生胆管覆盖)可作为诊断肝脏非典型增生结节的重要标志,一般在动脉增强晚期或平衡期出现环状高密度灶[12],本研究结果提示MRI对肝癌病灶包膜的显示更具优势,包膜环状强化特征在门静脉期、平衡期更加明显。
本文局限性在于:①本研究选取对象为小肝癌患者,可以对阅片者有/或潜在有提示作用;②由于CT与MRI检查有时间差,患者的病情可能会进展而导致肿瘤影像学特征有变化;③取材局限,有可能降低病理结果的评估;④本研究利用固定的延迟时间进行增强扫描,但固定的延迟时间对于同一位患者的CT及MRI检查中均被使用,提供了两种强化模式对比的可能。
综上所述,CT多期增强扫描的强化特点多在注射对比剂较短的时间内呈现,另外随着对比剂剂量的加大很难形成对比剂团,尤其对小肝癌的检出率不高,而且CT具有放射性损伤。MRI检测无放射性,可多方位及多角度显示病灶情况,扫描时间短而分辨率高,且对肿瘤假包膜显示良好,尤其结合LAVA序列及Gd-BOPTA增强扫描可以提高小肝癌的检出率。
