Hsa_circ_0003998调控miR-218-5p/Wnt/β-catenin通路对肝癌细胞增殖、迁移和侵袭的影响
2021-05-25林辉雄周悦乔刘志强林川杰
林辉雄 王 琳 周悦乔 刘志强 林川杰
1.琼海市人民医院肿瘤内科 (海南 琼海, 571400) 2.海南省人民医院(海南医学院附属海南医院)肿瘤内科
肝癌是一种全球范围内最常见的恶性肿瘤,具有较高的转移率、复发率和死亡率,预后较差[1,2]。目前,肝切除术、肝移植、放化疗、靶向治疗等多种治疗手段的综合应用,使肝癌的5年生存率得到了一定提高,但其易复发和转移,导致预后仍不太理想[3,4]。肝癌的发生和转移涉及多种基因和信号通路的失调,因此深入探讨肿瘤发生转移的内在分子机制,对探索新的肝癌治疗靶点具有重要意义。
环状RNA(circRNA)是一类呈封闭环状结构的非编码RNA分子,近年来越来越多的证实表明,circRNA在癌症中表达失调,参与癌细胞增殖、凋亡、转移等过程,与癌症进展密切相关[5~7]。Hsa_circ_0003998是一个剪接序列长度为304 nt的circRNA,位于chr20:47570092-47580435,被证实在肝细胞癌中高表达,与肿瘤大小、分化程度、微血管侵犯和患者总生存期有关,提示circ_0003998可能参与肝癌的发生发展[8]。本研究在此基础上,体外培养肝癌细胞,深入研究circ_0003998对肝癌细胞增殖、迁移和侵袭的影响及其作用机制。
1 材料与方法
1.1 主要试剂 DMEM培养基购自美国Gibco公司;胎牛血清购自美国Gibco公司;青链霉素混合液购自北京索莱宝科技有限公司;Lipofectamine 3000转染试剂购自美国ThermoFisher公司;Trizol试剂购自美国Invitrogen公司;CCK8试剂盒购自上海酶联生物科技有限公司;Matrigel基质胶购自美国BD公司;双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司;RIPA裂解液购自上海碧云天生物技术有限公司;实验用所有蛋白抗体购自上海艾博抗贸易有限公司。
1.2 细胞培养 人肝上皮细胞THLE-2细胞和肝癌细胞Huh7、MHCC97、Hep3B、PLC/PRF/5均购自美国ATCC。所有细胞均培养于含10%胎牛血清、1%青霉素和链霉素混合液的DMEM培养液,于37℃、5% CO2的无菌细胞培养箱中培养。
1.3 实验方法
1.3.1 细胞转染及分组 小干扰RNA(siRNA)阴性对照、circ_0003998 siRNA、miRNA inhibitor、miR-218-5p inhibitor由广州锐博生物技术有限公司设计合成。使用Lipofectamine 3000转染试剂,分别将siRNA 阴性对照和circ_0003998 siRNA转染至Huh7细胞,并记为si-NC组和si- circ_0003998组;另将miRNA inhibitor、miR-218-5p inhibitor分别与circ_0003998 siRNA共转染至Huh7细胞,记为si-circ_0003998+anti-NC组和si-circ_0003998+anti-miR-218-5p组。
1.3.2 qRT-PCR实验 收集对数生长期的细胞,采用Trizol法提取细胞总RNA,紫外吸收法进行RNA浓度检测和纯度检测,提取RNA溶液的A260/A280比值在1.8~2.1之间,纯度符合实验要求。取适量RNA样品为模板,进行逆转录反应,合成cDNA。以cDNA为模板进行荧光定量PCR反应,结果分别以GAPDH和U6为内参,采用2-ΔΔCt法计算circ_0003998和miR-218-5p的相对表达量。
1.3.3 CCK8实验 收集对数生长期的细胞,调整细胞悬液浓度为5×104/ml,以每孔100 μl接种于96孔细胞培养板中,置于37℃、5% CO2的无菌细胞培养箱中培养。分别于培养24 h、48 h、72 h时,每孔加入10 μl CCK8溶液孵育4 h,使用酶标仪测定450 nm波长处的吸光度值(OD值)。
1.3.4 Transwell实验 将Transwell小室放入培养板中,小室内称上室,培养板内称下室。取生长至对数期的细胞,消化、洗涤,用无血清培养液重悬,调整细胞浓度为2×105/ml。细胞迁移检测:在下室加入800 μl含血清培养液,上室中加入150 μl细胞悬液,置于细胞培养箱中培养24 h;取出上室,吸除上室内液体,将上室放入加有800 μl甲醇的培养孔中,室温固定30 min;取出上室,吸干上室固定液,将上室放入加有800 μlGiemse染色液的培养孔中,室温染色20 min;取出上室,冲洗,用湿棉棒轻轻擦去上室底部膜表面的细胞,晾干,移至载玻片上,封片,显微镜下计数5个随机视野,统计细胞迁移数目。细胞侵袭检测:用无血清培养液稀释Matrigel基质胶(5∶1),在上室中加入100 μl Matrigel基质胶,待胶凝固后,每孔加入100 μl细胞悬液,同时在下室中加入500 μl含血清培养液,置于培养箱中孵育24 h,取出上室,冲洗后,用5%戊二醇固定,然后加入Giemsa染色10 min,冲洗,显微镜下观察并计数细胞侵袭数目。
1.3.5 双荧光素酶实验 本研究通过circBank网站分析发现circ_0003998与miR-218-5p具有结合位点。将含有miR-218-5p结合位点的circ_0003998的序列构建双荧光素酶报告载体,记为circ_0003998 WT,将含有miR-218-5p结合位点的circ_0003998序列突变,构建双荧光素酶报告载体,记为circ_0003998 MUT,将circ_0003998 WT和circ_0003998 MUT分别与miRNA mimics(miR-NC)、miR-218-5p mimics(miR-218-5p)共转染Huh7细胞,使用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.3.6 Western blot实验 收集对数生长期的细胞,使用RIPA裂解液提取细胞总蛋白,使用BCA蛋白浓度测定试剂盒检测蛋白样品的蛋白浓度,将蛋白样品在沸水中加入3~5 min,充分变性,然后进行SDS-PAGE电泳分离目的蛋白,转膜,封膜。加入稀释后的一抗β-catenin(1∶1 000)、N-cadherin(1∶1 000)、Vimentin(1∶500)、E-cadherin(1∶500)、GAPDH(1∶2 500),4℃孵育过夜,洗膜,加入辣根过氧化酶标记的二抗稀释液(1∶1 000),室温孵育1 h。洗膜,加入显色液显色,显微镜下曝光、拍照,使用Image J软件分析蛋白条带灰度值。
1.4 统计学方法 本研究所有实验均进行3次生物学重复,实验数据应用统计学软件SPSS19.0分析,以均数±标准差表示,两组间比较采用LSD-t检验,多组间比较采用单因素方差分析检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 肝癌细胞中circ_0003998、miR-218-5p的表达 qRT-PCR实验结果,与人肝上皮细胞THLE-2细胞相比,肝癌细胞Huh7、MHCC97、Hep3B和PLC/PRF/5中circ_0003998相对表达量明显升高(P<0.05),miR-218-5p相对表达量明显降低(P<0.05),其中Huh7细胞中circ_0003998和miR-218-5p差异表达最明显。见表1。
2.2 敲减circ_0003998抑制肝癌Huh7细胞增殖 见表2。
2.3 敲减circ_0003998抑制肝癌Huh7细胞迁移和侵袭 Transwell实验结果,与si-NC组比较,si-circ0003998组细胞迁移数目和细胞侵袭数目均明显减少(P<0.05)。见图1和表3。说明敲减circ0003998能抑制Huh7细胞迁移和侵袭。

表1 circ_0003998、miR-218-5p在肝癌细胞中的表达

表2 细胞增殖检测

组别细胞迁移数目细胞侵袭数目si-NC组97.63±11.2455.57±7.05si-circ0003998组36.58±4.74*18.69±2.14*
2.4 circ_0003998靶向miR-218-5p 本研究通过circBank网站分析发现circ_0003998与miR-218-5p具有结合位点(见表4);双荧光素酶实验结果(见表5),与circ_0003998 wt和miR-NC共转染组比较, circ_0003998 wt和miR-218-5p共转染组的细胞中荧光素酶活性明显降低(P<0.05);qRT-PCR实验结果(见表6),与si-NC组比较,si-circ0003998组细胞中miR-218-5p相对表达量明显升高(P<0.05)。说明Huh7细胞中circ0003998靶向负调控miR-218-5p的表达,敲减circ0003998上调miR-218-5p的表达。

表4 circ_0003998与miR-218-5p的结合位点

表5 荧光素酶活性检测

表6 circ0003998负调控miR-218-5p的表达
2.5 抑制miR-218-5p逆转circ_0003998的作用 见表7、表8。

表7 细胞增殖检测

表8 细胞迁移和侵袭数目比较
2.6 circ_0003998/miR-218-5p对Wnt/β-catenin通路和EMT通路蛋白表达的影响 见表9、图2。Western blot实验结果,与si-NC组比较,si-circ0003998组细胞中β-catenin、N-cadherin和Vimentin蛋白相对表达明显降低(P<0.05),E-cadherin蛋白相对表达明显升高(P<0.05);与si-circ0003998+anti-NC组比较,si-circ0003998+anti-miR-218-5p组细胞中β-catenin、N-cadherin和Vimentin蛋白相对表达明显升高(P<0.05),E-cadherin蛋白相对表达明显降低(P<0.05)。说明敲减circ_0003998抑制Huh7细胞中Wnt/β-catenin通路活性,抑制EMT,而抑制miR-218-5p能够逆转这种作用。
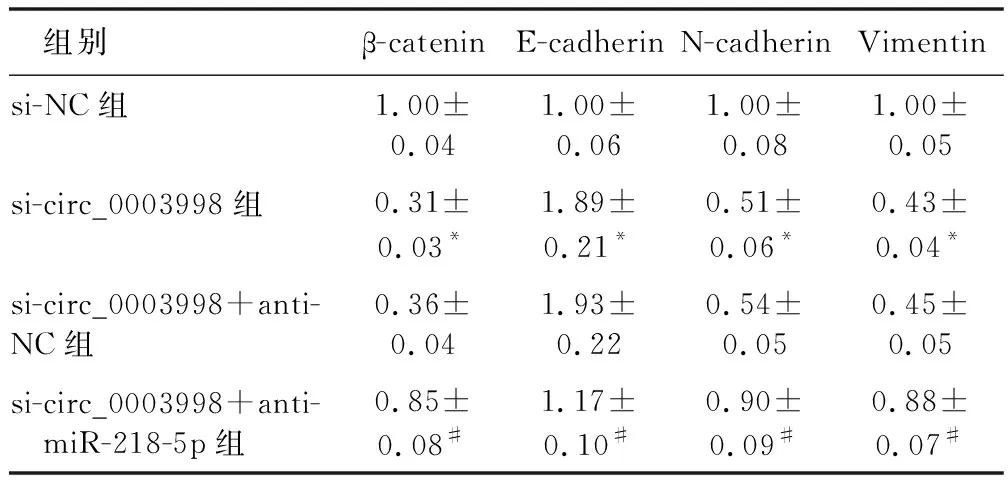
表9 蛋白相对表达量比较
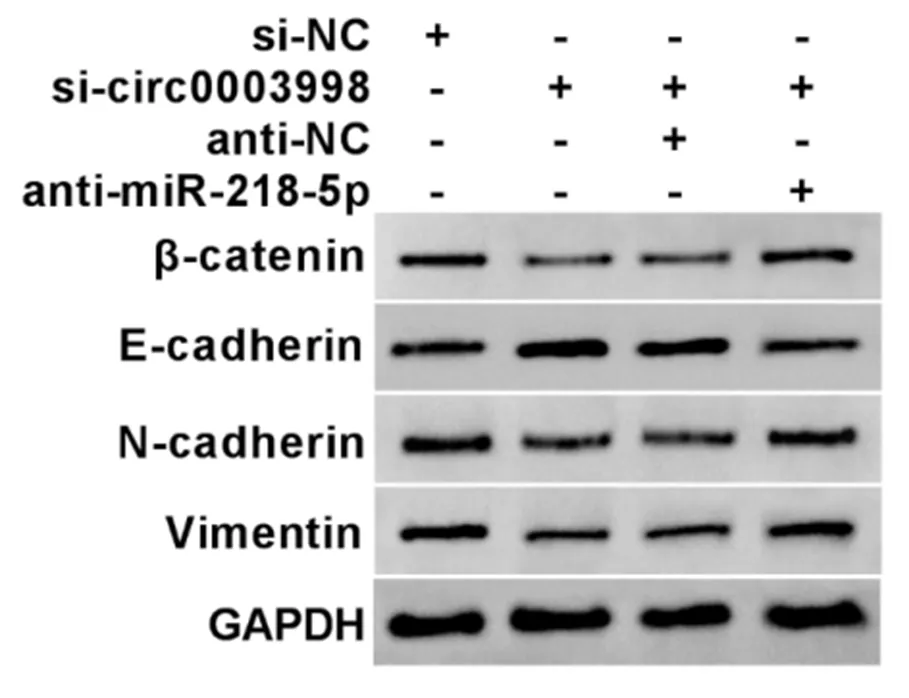
图2 Western blot检测蛋白表达
3 讨论
近年来研究发现,circRNA异常表达参与肿瘤发生和发展,可作为肿瘤潜在的生物标志物,也可能为肿瘤靶向治疗提供新的靶点[9]。如circ_0001649在肝癌组织中低表达,与肿瘤大小和复发有关,分析癌组织和癌旁组织表达发现,circ_0001649对肝癌具有一定诊断价值[10]。circ_103809在肝癌中高表达,体外实验证实敲除circ_103809抑制肝癌细胞增殖、周期进展和迁移,体内实验证实circ_103809的短发夹RNA发挥肿瘤抑制作用[11]。circ_0003998被报道是肝癌的独立预后因子,且与乙型肝炎和健康者比较,其诊断肝癌的曲线下面积(AUC)为0.833,对肝癌具有较高的诊断价值[8]。此外,circ_0003998在非小细胞肺癌中高表达,可靶向miR-326促进癌细胞增殖、侵袭和化疗耐药[12,13]。
本研究结果,circ_0003998在肝癌细胞中高表达,体外构建敲低circ_0003998表达的Huh7细胞,发现敲除circ_0003998后细胞增殖、迁移和侵袭能力受到抑制。功能实验研究表明[14,15],circRNA在细胞中主要是作为miRNA的海绵起作用。本研究通过生物信息学网站circBank发现,circ_0003998与miR-218-5p具有结合位点,双荧光素报告基因实验和qRT-PCR实验证实circ_0003998靶向负调控miR-218-5p的表达。进一步在Huh7细胞中抑制miR-218-5p进行回复实验,发现抑制miR-218-5p逆转了敲除circ_0003998对Huh7细胞增殖、迁移和侵袭的抑制作用。提示circ_0003998通过靶向miR-218-5p调控肝癌细胞增殖、迁移和侵袭。
Wnt/β-catenin通路是经典的Wnt信号通路,Wnt活化后首先与细胞膜上的跨膜受体结合,将Wnt信号传递至胞质蛋白,经过一系列复杂反应使胞质内β-catenin水平增高,进而β-catenin发生核转移,与核内转录因子结合激活下游靶基因,其异常活化与恶性肿瘤发生密切相关[16-18]。EMT是由上皮细胞转化成间质细胞并获得迁移和侵袭能力的过程,研究表明, Wnt/β-catenin通路活化可诱导EMT发生从而促进肿瘤细胞生长和转移[19]。本研究分析Huh7细胞中β-catenin蛋白及EMT相关蛋白N-cadherin、Vimentin和E-cadherin的表达发现,敲减circ_0003998后Huh7细胞中β-catenin和N-cadherin、Vimentin蛋白表达减少,而E-cadherin表达增多,说明敲减circ_0003998抑制了细胞中Wnt/β-catenin通路活性和EMT发生,miR-218-5p的回复实验证实,抑制miR-218-5p后逆转了敲减circ_0003998对细胞中Wnt/β-catenin通路活性和EMT发生的作用。
综上所述,circ_0003998在肝癌细胞中高表达,敲减circ_0003998可通过上调miR-218-5p,抑制肝癌细胞中Wnt/β-catenin通路活性和EMT,抑制肝癌细胞增殖、迁移和侵袭。本研究揭示了circ_0003998对肝癌细胞恶性生物学行为的影响,但其在体内是否抑制肿瘤生长还有待进一步实验研究。
