鸟苷酸结合蛋白α亚基变异与腹膜假黏液瘤关系的研究进展*
2021-05-24徐大钊林育林李雁
徐大钊 林育林 李雁②
鸟苷酸结合蛋白(guanine nucleotide-binding protein,G protein,G蛋白),是哺乳动物细胞信号通路的关键调控因子[1],哺乳动物细胞绝大多数受体通过与G蛋白偶联而将信号转导至胞内。G蛋白由α、β、γ 3个亚基组成异源三聚体,信号转导依赖于Gα在静止构象(结合二磷酸鸟苷,guanosine diphosphate,GDP)与活化构象(结合三磷酸鸟苷,guanosine triphosphate,GTP)之间的循环交替[2]。与β、γ亚基相比,α亚基具有催化和结合位点,当胞外信号分子与G蛋白偶联受体(G proteincoupled receptor,GPCR)结合时,后者发生构象变化,催化Gα蛋白上GDP置换成GTP,促进Gα活化,提高与下游效应分子的亲和力,同时减少与Gβ、Gγ的亲和力[3]。Gα亚基蛋白(Gα)是G蛋白异源三聚体的结构核心和功能核心,是G蛋白转导信号通路的中枢。深入研究Gα基因表达与调控,对认识该信号转导蛋白的表达和功能机制,探索该基因突变与疾病的相关性,寻找临床治疗的新靶点等,均具有重要意义。本文首先简述Gα蛋白基因表达,重点综述Gα蛋白结构和功能变异与腹膜假黏液瘤(pseudomyxoma peritonei,PMP)中的关系,以期探索腹膜假黏液瘤发病的分子病理学机制。
1 Gα基因转录表达
1.1 GNAS基因生物学特征
Gα 基因(guanine nucleotide-binding protein alpha-subunit,GNAS)位于染色体20q13.32,又称GNAS复合体基因位点(GNAS complex locus),碱基对总长度71 495 bp,包括13 个外显子和12 个内含子,主要编码激动型Gα蛋白(stimulatory G protein α-subunit,Gsα)及其同源异构体,属于G蛋白偶联受体家族。
1.2 GNAS基因的转录和表达
GNAS编码Gα的启动子位于最下游,呈双亲源性等位基因表达。外显子1上游45 kb、35 kb和2.5 kb处有3个选择性启动子,对应3个第一外显子,分别启动转录神经内分泌蛋白55(neuroendocrine secretory protein 55,NESP55)mRNA、超大α蛋白(extra-large alphas protein,XLαs)mRNA 和外显子A/B mRNA,其中外显子A/B mRNA为非翻译性mRNA;在上游启动子调节下,这3个第一外显子与外显子2~13拼接产生不同的转录本(图1),故这些转录产物被称为同源异构体[4]。上述选择性启动子表现出不同的转录表达模式:NESP55由母源等位基因专一性表达,启动子在父源等位基因中甲基化;NESP55 下游有一个反义转录子(反义NESP,NESPantisense,AS),其和XLαs、外显子A/B均由父源等位基因专一性表达,启动子在母源等位基因中甲基化(图1)。
2 Gα蛋白结构与功能
2.1 Gα蛋白结构
GNAS 基因编码Gα 蛋白,由α 螺旋、β 折叠和无规卷曲按下列方式连接:β1→α1→αA→αB→αC→αD→αE→αF→β2→β3→α2→β4→α3→β5→αG→α4→β6→α5(图2A)。包括2 个结构域(图2B):1)GTP/GDP 结合域(GTP 酶结合域,GTPase domain),通过由第39~394 位氨基酸折叠成5 个α 螺旋(α1~α 5)围绕着6 个β 折叠(β1~β6)所组成,其中6 个β 折叠中除了β2 为反向平行排列,其余β 折叠均为正向平行排列,GTP/GDP 结合域除了具有结合鸟苷酸位点之外,还具有结合β、γ亚基以及偶联受体和效应器的位点;2)螺旋结构域(helical domain),由6个α螺旋(αA~αF)组成,形似“盖子”覆盖在GTP/GDP结合域上[5],其功能是阻滞GDP 与非活化状态Gα 解聚,对GDP与GTP内在转换效率起限速作用[2]。
Gα 蛋白包含5 个模体(图2C):G1(第42~55 位氨基酸),G2(第196~204 位氨基酸),G3(第219~228 位氨基酸),G4(第288~295 位氨基酸),G5(第364~369位氨基酸)。Gα有4个GTP/GDP结合域,分别位于第47~55位、第197~204位、第223~227位、第292~295位氨基酸;1个通过酰胺基结合GTP的结合位点,位于第366 位氨基酸。Gα 中4 个GTP/GDP结合域和1个GTP结合位点,分别对应模体G1~G5,故模体是Gα的功能和结构中心。
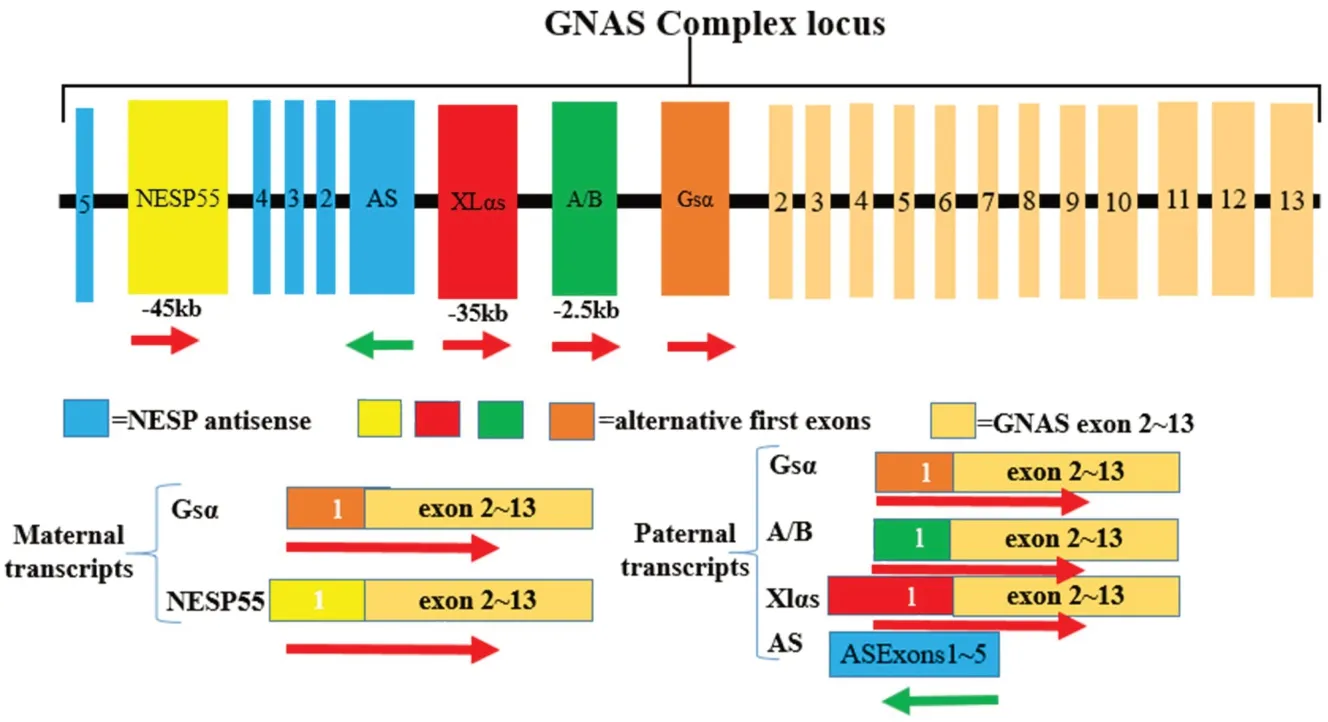
图1 GNAS基因复合体同源等位基因表达模式
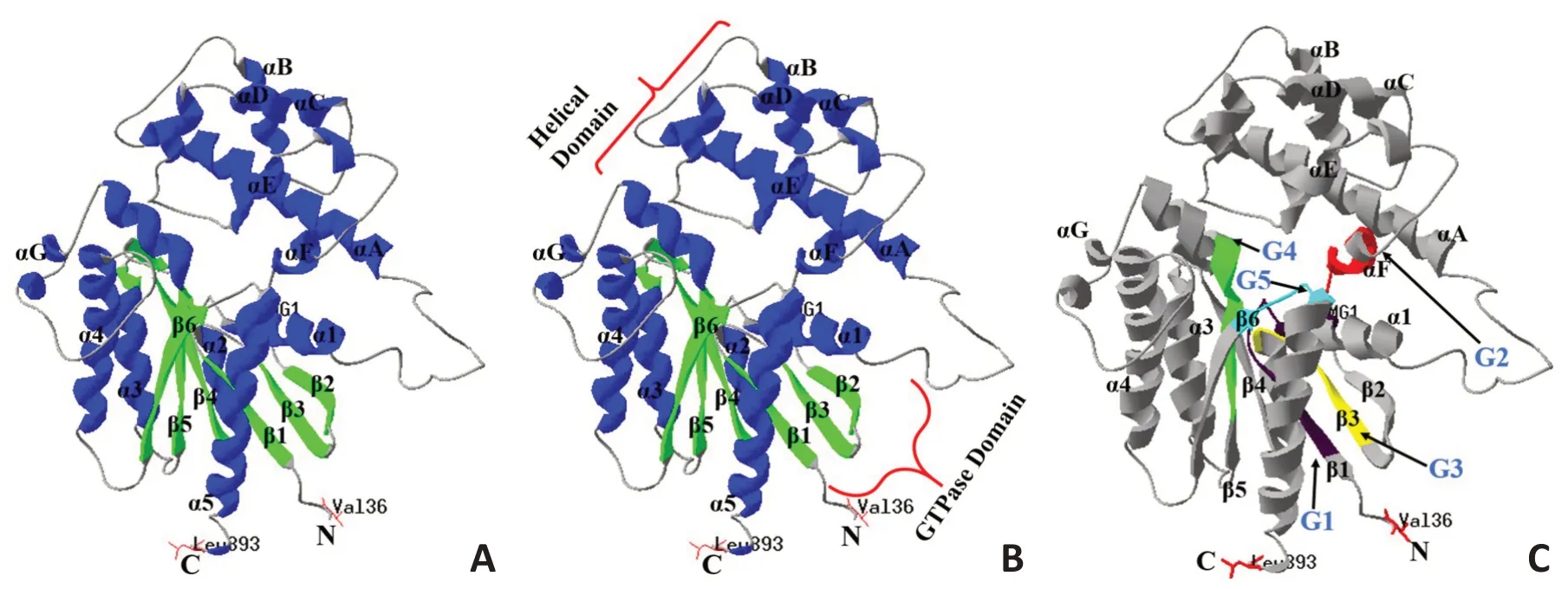
图2 Gα蛋白三维空间构象及5个模体结构域
2.2 Gα蛋白介导细胞信号转导功能
通过7次跨膜的G蛋白循环,G蛋白偶联受体完成细胞信号传导,主要过程如下:1)配体激活偶联的受体后与Gα蛋白结合,导致G蛋白的构象改变,Gα蛋白与GDP亲和力下降,释放GDP,并随即与GTP结合;2)Gα蛋白结合GTP后,与β、γ亚基解聚,成为活化态Gα蛋白,激活下游的效应分子,介导细胞信号通路的转导;3)由Gα蛋白激活的效应分子,反过来同时激活Gα蛋白自身的GTP酶活性,后者将GTP水解成GDP,导致Gα蛋白与效应分子解聚,Gα蛋白恢复至原来构象,重新与β、γ亚基结合形成三聚体,回到静止状态。活化的Gα(Gsα)蛋白通过激活下游的腺苷酸环化酶(adenylate cyclase,AC),催化三磷酸腺苷(adenosine triphosphate,ATP)脱去一个焦磷酸分子而生成第二信使环磷酸腺苷(cyclic adenosine monophosphate,cAMP),介导cAMP/PKA细胞信号传导通路[6]。
2.3 Gα蛋白介导细胞信号转导的分子生物学机制
2.3.1 Gα 蛋白介导cAMP-PKA 信号通路 Gα 蛋白介导cAMP-PKA 信号通路活化的Gα 蛋白首先激活AC,产生第二信使cAMP,并能调节cAMP 表达水平,后者激活cAMP 依赖的蛋白激酶A(protein kinase A,PKA),PKA 再激活cAMP 效应元件结合蛋白(cAMP response element binding protein,CREB)/转录激活因子(activating transcription factor,ATF)等基因调控蛋白,调控基因转录,构成完整的cAMP-PKA 信号转导通路(图3)。激活的CREB/ATF分子可与胞核内的黏蛋白基因的顺式作用元件结合,调节黏蛋白分泌。研究证实PKA抑制剂[7]、异源三聚体G蛋白复合物抑制剂[8]均可抑制黏蛋白分泌。
2.3.2 Gα蛋白介导磷脂酰肌醇信号通路 Gα蛋白介导磷脂酰肌醇(phosphatidylinositol)信号转导通路(图3),主要过程如下:配体结合G蛋白偶联受体后,导致后者构象改变,活化的Gα蛋白激活下游PLC,PLC催化磷脂形成二酰甘油(diacylglycerol,DAG)和三磷酸肌醇(inositol triphosphate,IP3),IP3会导致细胞内Ca2+浓度升高。研究发现Ca2+依赖性蛋白激酶Cε(PKC-epsilon,PKCε,)可上调黏蛋白2(mucin2,MUC2)、黏蛋白5AC(mucin5AC,MUC5AC)的表达[9];DAG则会直接激活蛋白激酶C(protein kinase C,PKC),导致PKC磷酸化[10],PKC可激活Raf-1,发挥与cAMP-PKA的协同作用[11]。
2.3.3 Gα 蛋白介导其他信号通路 与磷脂酰肌醇3-激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)通路和大鼠肉瘤蛋白(RAS)-丝裂原活化蛋白激酶(MAPK)通路交叉,通过ATF/CREB、核因子κB(nuclear factor kappa-B,NF-κb)入核,调节黏蛋白基因表达,间接调节黏蛋白的分泌[11];PI3K-Akt 信号通路激活的磷酸二酯酶4B(phosphodiesterases 4B,PDE4B)可清除cAMP,拮抗cAMP-PKA信号通路[12]。
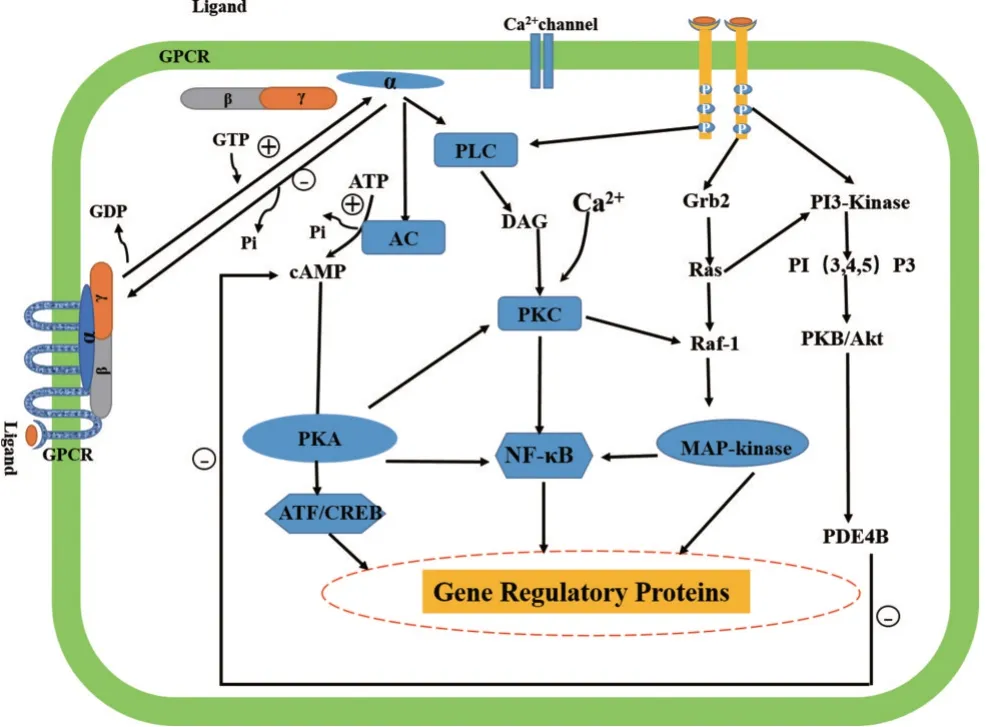
图3 Gα蛋白介导细胞信号通路模式图
3 GNAS和Gα蛋白突变与PMP的关系
3.1 GNAS突变与PMP的关系
PMP是一种以黏蛋白持续分泌为主要病理特征的恶性肿瘤综合征。尽管目前无PMP基因突变谱的大样本数据,但多项研究表明,PMP患者中GNAS为高频基因突变[13],Sio等[14]研究40例PMP肿瘤组织样本,通过高通量测序(next generation sequencing,NGS)发现GNAS突变率为52%;Matson等[15]研究10例PMP患者,检测了石蜡包埋切片中236个癌相关基因,其中4例患者出现GNAS突变(R201H/R201C转换)。有研究发现PMP中存在BRAF基因突变[16],通过NGS测序发现PMP中高频突变的仍是GNAS和KARS基因,很少有BRAF-V600E、PIK3CA和APC基因突变[17]。因此GNAS基因突变是PMP发生的重要分子机制之一[11]。
GNAS基因突变已在多种恶性肿瘤研究中得到证实[18],尤其是来源于外分泌和内分泌器官的黏液性肿瘤,如结直肠黏液性癌和阑尾黏液性癌,可高频出现GNAS基因突变,提示该基因的致癌和致分泌作用[19]。
PMP中GNAS突变位点相对稳定,通常为Chr20:57484420(碱基:C-G)和Chr20:57484421(碱基:GC)[11]。PMP 的发生、发展与诸多细胞信号转导通路相关,如PI3K、Akt[20]以及前列腺素EP4 受体(prostaglandin E2 receptor 4,EP4)/cAMP/PKA/CREB等[19],但PKA 途径是黏蛋白持续分泌的主要参与者,是PMP病理特征的主要因素,抑制PKA 途径会减少大多数PMP 患者的黏蛋白产生[21]。典型的GNAS 突变导致Gα蛋白GTP酶活性降低,GTP不能水解释放磷酸,使GTP 与Gα 蛋白持续结合,后者激活cAMP-PKACREB 信号传导通路,CREB 结合MUC2 启动子,上调MUC2 基因表达,最终导致黏液分泌持续亢进,是PMP发生、发展的核心分子病理机制,该机制也提供了以cAMP/PKA 信号通路为分子靶点治疗PMP 的理论依据[19]。
3.2 Gα蛋白变异与PMP的关系
Gα 蛋白变异与PMP 密切相关,其机制与Gα 蛋白变异后持续激活cAMP-PKA 信号转导通路相关。PMP 中最常见 的Gα 蛋 白变异位点是R201H 或R201C。Gα蛋白R201变异还可见于胰腺癌、卵巢癌和乳腺黏液腺癌[22]。
GNAS 突变作为PMP 分子病理机制已得到研究证实。作为GNAS 突变后的关键蛋白,Gα 形态与功能将成为今后研究PMP的重要内容,包括GNAS-Gα变异与PMP病理特征,预后生存的相关性研究。Noguchi 等[23]在18 例PMP 患者中发现5 例低级别PMP患者存在GNAS突变,而仅在3例高级别PMP中发现GNAS 突变;Alakus 等[12]也发现GNAS 在高级别PMP患者中的突变率较低,而在低级别PMP 存在高频的GNAS突变。预后方面,一项阑尾肿瘤预后的研究[24]认为GNAS 突变的阑尾肿瘤患者的中位生存期达到115.5 个月。但上述报道均为小样本的回顾性研究,有待大样本临床数据的进一步验证。
3.3 PMP中Gα蛋白的突变结构
本研究根据筛查出的GNAS基因突变后Gα蛋白的突变位点R201H 或R201C,利用化学分子式构建突变前后Gα 蛋白的化学基团。根据化学基团的化学特性和化合键变化来判断Gα 蛋白突变的结构和功能。在R201H突变中,第201位的精氨酸突变成组氨酸,组氨酸的分子结构中具有一个苯环结构,含有苯环的化合物具有不易氧化、碳环异常稳定的特性。在R201C突变中,第201位的精氨酸突变成半胱氨酸,其与第200 位的半胱氨酸形成了2 个毗邻巯基,两者构成二硫键,具有稳定蛋白质构象的功能。因此,不论是R201H 还是R201C,突变后的Gα·GTP复合体化学结构更加稳定,使GTP更不易被解聚。
根据Gα蛋白一级结构(UniProtKB数据库提供)及筛查出的Gα蛋白突变位点R201H或R201C,利用Swiss-PDB Viewer 4.1.0软件构建出突变前后Gα蛋白的三维空间结构来判断突变后Gα蛋白的功能变化(图4)。
模体1~5(G1~G5)为Gα蛋白与GTP结合的功能结构域,该结合过程必须有Mg2+螯合参与,Mg2+是Gα酶促结合反应的关键辅基,Mg2+的空间位置和浓度是该结合反应的关键限速因素。正常Gα蛋白三维空间构象中,G1~G5空间构象为紧密异构体,Mg2+完全包埋于G1~G5 模体组成的空间结构中,Mg2+位置限制了Gα 蛋白与GTP的结合效率(图4A);而R201H构象中G1~G5空间构象特征为疏松异构体,Mg2+全暴露于模体G1~G5功能结构域表面,与H201氨基酸形成平面结构,因此Gα蛋白与GTP结合效率增加,Mg2+能保持Gα·GTP复合体结构的稳定,使GTP不易解聚,研究证实如果不存在Mg2+,则Gα 解聚GTP 效率至少会增加10 倍(图4B)。在R201C构象中G1~G5空间构象特征也为疏松异构体,Mg2+半暴露于G1~G5模体组成的空间结构中,与C201氨基酸形成近似平面结构,也会促进Gα与GTP结合速率,并保持Gα·GTP复合体构象的稳定,使GTP不易解聚(图4C)。
通过Gα蛋白突变前后不同的的三维构象图谱,Mg2+空间位置对Gα蛋白与GTP结合效率起重要作用。Mg2+的空间位置若完全包埋于G1~G5空间构象中,Gα蛋白与GTP结合为正常速率,相应的cAMP为正常水平;Mg2+半暴露于G1~G5空间构象中则有限加速Gα蛋白与GTP的结合速率,cAMP水平相对升高;Mg2+完全暴露于G1~G5空间构象中,无限加速Gα与GTP的结合速率,cAMP水平大幅升高(表1)。
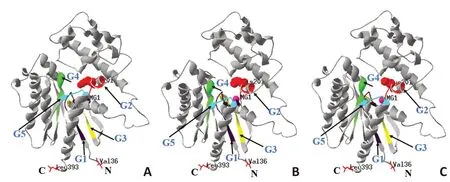
图4 Gα突变前后的三维构象图
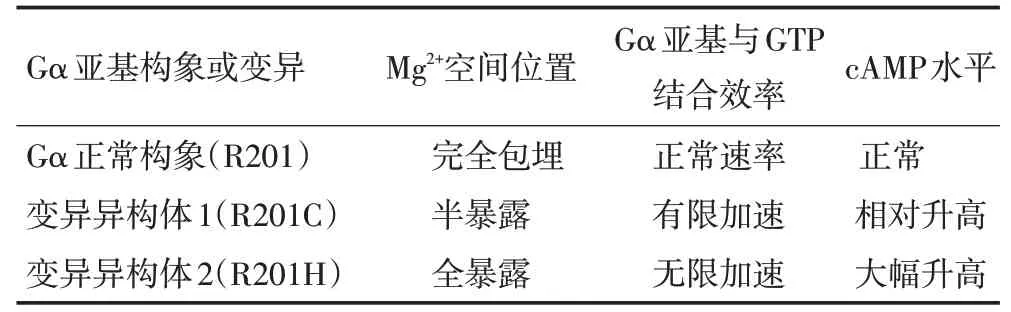
表1 Gα蛋白突变前后的三维空间构象及功能变化
4 结语
PMP 相关的Gα 蛋白结构、功能的研究正处于探索起步阶段。GNAS-Gα变异的探索有可能带来PMP诊疗领域的新突破。明确PMP 中Gα 蛋白突变的关键分子特征,将有助于发展针对PMP 的治疗新靶点[24]。目前通过NGS检测PMP患者的高频突变基因的技术已经较为成熟和规范,下一步的研究重点将集中在GNAS突变后Gα蛋白的定性与定量研究以及Gα蛋白表达水平与临床病理特征的关系研究。确保从GNAS 基因转录水平、Gα 蛋白翻译水平以及细胞信号转导功能方面形成完整的PMP分子病理机制的闭环研究。但PMP中细胞较少,富含大量黏液,目前缺乏从富含黏液间质的PMP肿瘤组织中提取富集突变Gα 蛋白的关键技术,是在PMP 中研究Gα 蛋白变异的最大挑战。
