CLDN18.2在胃癌中的研究进展*
2021-05-24种晓艺蔡洁媛张小田
种晓艺 蔡洁媛 张小田
CLDN18.2是表达于正常胃黏膜的紧密连接蛋白,参与构成细胞间紧密连接,影响细胞旁离子通透性并参与维持细胞极性。目前CLDN18.2已成为最具潜力的胃癌靶向治疗研究领域,因此临床与基础研究大量报道。本文主要就CLDN18.2相关的既往研究及进展进行综述,以期整合其相关进展,为CLDN18.2阳性胃癌临床及转化研究提供参考。
1 CLDN18.2的分子特点
1.1 CLDN18.2结构、表达与功能
Claudin(CLDN)蛋白家族是构成紧密连接重要的组成及功能结构,包括至少27个家族成员,均是定位于细胞膜表面的跨膜蛋白,且结构具有高度一致性:包括4 个跨膜区和2 个胞外环,这种高度一致性在跨膜区尤为显著。CLDN蛋白通过辅助蛋白(主要是ZO)与细胞骨架连接而保持稳定,从而发挥紧密连接屏障,维持细胞极性功能[1-5]。就肿瘤而言,CLDN生物学功能尤其是在肿瘤发生发展中的角色目前尚无定论,而可以肯定的是,CLDN蛋白表达紊乱(包括表达数量及空间分布的紊乱)会影响细胞与细胞,细胞与细胞外基质连接,影响细胞屏障功能及极性的维持,从而引起细胞间细胞因子、离子渗透性的变化,引起细胞增生性转化。
CLDN蛋白普遍在多种组织中表达,只有少数表达于单一组织[6]。其中CLDN18 是表征胃谱系的重要分子,与其他CLDN蛋白结构不同的是,CLDN18在其第二个胞外环中有一段延伸[3]。CLDN18基因位点位于3q22 染色体,分子量大小约30 kD,包含6 个外显子和5 个内含子,其中第一外显子的交替剪接将CLDN18 分为CLDN18.1 和CLDN18.2 两个剪接体,因此二者氨基酸序列高度同源(91%氨基酸序列相同)[2,7]。两者分别特异性表达于肺组织及胃组织,其中CLDN18.2 主要分布于分化周期短、更新速度快的胃黏膜(胃正常腺体、主细胞、壁细胞、内分泌细胞),以及十二指肠的潘氏细胞内,胃干细胞区域不表达;除与CLDN18.1高度同源外,CLDN18.2蛋白序列及启动子在物种进化过程中也保持高度的保守性(89%~99%)。而CLDN18.1与CLDN18.2的差异主要集中在第一胞外环,差异氨基酸69个;二者第一胞外环所带正负电荷的分布与数量存在较大差异,CLDN蛋白的第一胞外环与细胞旁的紧密连接以及选择性离子通透性有关,表明CLDN18.1 和CLDN18.2 具有不同的选择性离子通透性[2,8]。目前普遍认为CLDN18.2 参与调节H+、Na+等阳离子的通透性,CLDN18.2 的缺失可引发胃黏膜下中性粒细胞聚集以及炎症反应发生[4]。表达于壁细胞的CLDN18 在基底外侧膜以不连续的吻合束排列,完全包封壁细胞,而在主细胞中,吻合束之间的间隔相对较远,表明CLDN18.2 可能通过特定的结构限制来调节细胞旁阳离子的渗透作用[9]。
1.2 CLDN18.2检测方法及表达分布
由于CLDN18.1 与CLDN18.2 的高度同源性,且差异氨基酸多为中性,CLDN18.2 的特异性检测抗体研发进程较慢。目前CLDN18.2 可用的蛋白表达检测手段主要是免疫组织化学法,比较成熟的检测抗体来源主要有两种:FAST 研究中使用的CLAUDETECT(德国Ganymed 公司),以及Abcam Cambridge(美国Abcam 公司);其中CLAUDETECT 抗体的阳性检出率稍高于美国Abcam公司的抗体(表1)。
CLDN18.2在正常胃组织中局限表达于胃黏膜细胞基底部外侧的紧密连接,而在间质细胞中并不表达。因此不同抗体检出的阳性细胞均为膜阳性。目前普遍认为肿瘤在恶性转化中细胞极性发生改变,导致CLDN18.2广泛分布于细胞膜表面。细胞极性的改变未改变CLDN18.2在细胞中的膜定位,但需要注意的是,胃癌恶性转化过程中,引起细胞极性改变的原因是否与CLDN18.2的空间分布异常直接相关,CLDN18.2是否是引起胃癌细胞极性改变的关键因素,极性改变与CLDN18.2分布异常是因果关系还是正/负反馈作用,有待于进一步研究。此外,CLDN18.2的异位激活多见于胰腺导管癌、食管腺癌、非小细胞肺癌、胆道肿瘤、Barrett食管等,其中有研究表明CLDN18表达常见于早期以及大导管胰腺癌,胃上皮样特征的获得被认为是胃型胰腺癌发生的早期关键事件。因此,作为胃上皮高度特异性的标志物,CLDN18.2检测可辅助胰腺导管癌分型及早期诊断[10-11]。
关于CLDN18.2阳性胃癌的人群分布,目前的部分研究将胃癌CLDN18.2 表达率限定在42%~86%,CLDN18.2阳性胃癌约占胃癌人群中的16%~73%。可以发现胃癌中CLDN18.2阳性率,以及CLDN18.2阳性胃癌在胃癌中占比,在不同研究中存在较大差异,其中检测抗体种类及浓度、检测人群的分布情况、肿瘤分型、评价标准,可能是造成差异的主要因素(表1)。
多项临床研究以及样本量较大的回顾性分析提示,CLDN18.2表达具备一定的分子病理特点:弥漫型胃癌高于肠型胃癌,EBV病毒(Epstein-Barr virus)阳性胃癌高于阴性胃癌(81.0%vs.40.2%,P<0.001),原发灶、周围淋巴结转移以及远处转移病灶表达基本一致,CLDN18.2与HER-2共表达人群与HER-2阳性胃癌人群占比基本一致(约12%)[1,12-14]。其中,CLDN18.2在EBV相关性胃癌(EBVaGC)表达值得关注,目前的研究虽多探索CLDN18在EBVaGC的表达情况,但也具有一定的提示价值:涉及例数最多的一项研究指出,43例EBVaGC中有84%CLDN18为阳性[15],考虑与EBVaGC源自未分化成熟的细胞,在致癌过程中保留源细胞特征所致。
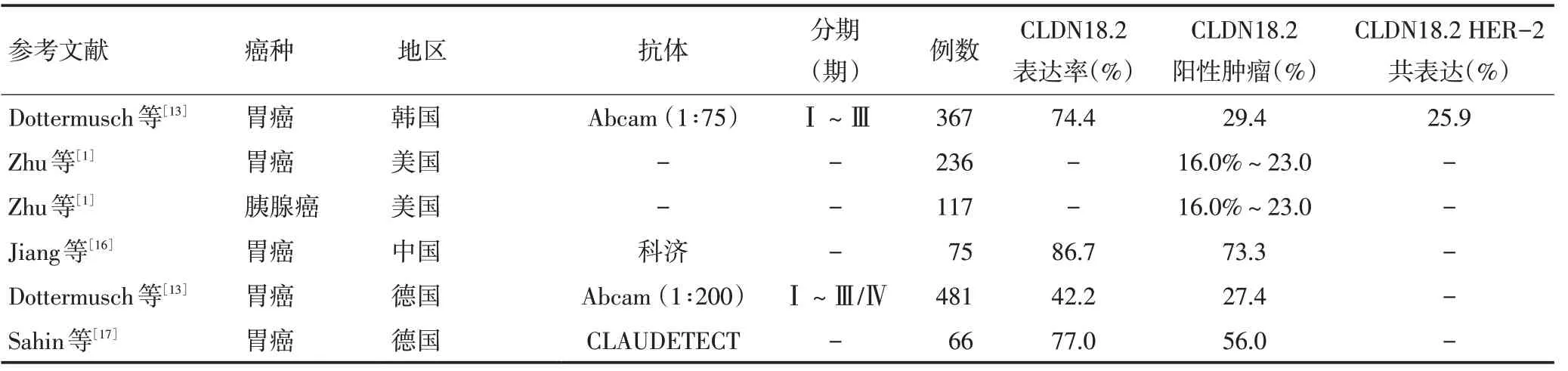
表1 CLDN18.2在不同研究中的表达
1.3 CLDN18.2阳性肿瘤的预后
CLDN表达紊乱已在尿路上皮细胞癌、肠癌、乳腺癌中被证实参与肿瘤发生与进展[9]。CLDN18在不同癌种中与肿瘤进展相关性相差较大:CLDN18在胃癌体外研究中证实有抑制肿瘤生长、增殖、迁移侵袭作用[20],与正常胃组织相比,CLDN18在57.5%的胃癌以及73.7%肠型胃癌中下调,提示胃黏膜肠上皮化生过程中胃型特征的丢失[15,21-22]。CLDN18在肿瘤中的过表达与结直肠癌患者更高的N、T分期相关;CLDN18阳性胆管癌往往伴随较高的导管周围浸润性生长、肝内转移、神经侵犯和淋巴结转移频率,且预后往往较差[23-25]。对于CLDN18.2,多项研究提示其与肿瘤预后无关,但基本所有研究纳入的患者均接受不同方案的治疗,预后干预因素繁杂,因此多无指导意义。
CLDN18.2的组织表达特异性使其成为肿瘤治疗的优异靶点,目前虽有多项研究提示CLDN18参与构成紧密连接的重要作用,但对CLDN18.2功能的描述仍非常匮乏;此外,目前检测抗体特异性和灵敏性的不确定也使得对CLDN18.2阳性胃癌人群的分布、特点的研究需保持谨慎态度。但可以肯定的是CLDN18.2表达的紊乱,将导致胃癌细胞间、细胞与细胞外基质细胞旁通透性的改变以及屏障功能的损害,而为肿瘤细胞营造了不同的微环境,这也将赋予CLDN18.2阳性与阴性胃癌不同的生物学特点。期待后续更多临床试验的回顾性分析提供更多的线索。
2 CLDN18.2的相关基础研究
受限于检测抗体,CLDN18.2的基础研究较少,多数基础研究着眼于CLDN18,现以CLDN 蛋白家族、CLDN18为例,汇总相关研究如下。
2.1 CLDN屏障与细胞极性维持功能相关基础研究
2.1.1 CLDN如何改变细胞极性 CLDN蛋白与ZO-1结合,从而促进紧密连接域细胞内肌动蛋白骨架相互作用,因此,目前认为CLDN 可能通过细胞骨架重排从而影响细胞极性[26]。
2.1.2 CLDN改变细胞屏障功能 目前多项研究认为CLDN表达紊乱导致细胞屏障功能的紊乱与细胞极性相关:1)CLDN蛋白丢失导致细胞紧密连接丢失,而紧密连接主要作用:①抑制膜蛋白从顶端至基底外侧扩散,从而维持细胞极性;②细胞旁通路调节离子通透性。紧密连接完整性的丧失是炎性和自身免疫性疾病的危险因素[27];2)有研究发现CLDN2被认为是成孔的CLDN蛋白,即CLDN2过表达时,“紧密”的紧密连接转换为“有孔”的紧密连接,在结肠炎活检标本中发现CLDN18与CLDN2相似的表达方式,推测CLDN18属于这种成孔CLDN蛋白[28]。
2.2 CLDN18.2表达调节的相关基础研究
多项临床前研究表明,放化疗可提高CLDN18在胰腺癌中的表达[29]。吉西他滨可上调胰腺癌CLDN18.2 表达水平[30]。而生长因子、EGF、FGF2、IFN-α、H2O2cAMP 促丝裂原、PMA 以及胃基因表达的激活剂均可上调CLDN18.2 mRNA表达;相反的,幽门螺旋杆菌的感染,以及肿瘤的肠上皮化生都存在CLDN18下调的现象,从而导致消化道上皮内瘤变和肿瘤发生[27]。总结可能机制:1)有研究对CLDN18.2启动子进行测序,发现位于启动子区转录因子CREB结合位点,而结合位点的启动子区CpG 二核苷酸甲基化可阻滞其结合,从而抑制CLDN18.2 表达。CLDN18.2 表达在绝大多数正常组织中受到严格抑制,但在恶性转化过程中逃避抑制[12,17,31-32];2)PMA通过诱导PKC 及ERK-MAPK 途径,磷酸化激活AP-1从而促CLDN18.2 mRNA转录[10,33]。
2.3 CLDN18的抑癌/促癌作用机制研究
2.3.1 CLDN18的抑癌作用 胃癌浸润前沿的Ki-67标记指数与CLDN-18水平呈负相关[34]。基因工程鼠的研究提示CLDN18.1 及CLDN18.2 敲除小鼠可在无幽门螺旋杆菌感染的前提下自发形成胃癌,其潜在可能机制为屏障功能丧失而诱导炎症反应的发生。研究发现CLDN18敲除鼠多发萎缩性胃炎,胃内H+渗透性增强,IL-1β 分泌增加,壁细胞数量减少,胃内pH 值下调,肺上皮祖细胞细胞增殖能力增强,G2/M及S期细胞增多,胃和肾脏的大小均增加[35-36]。涉及通路包括,炎症、细胞干性、Wnt信号通路、Notch通路以及Hippo 通路等[31,37-39]。其中,YAP/TAZ 通路研究最为深入广泛:CLDN18 在细胞中与ZO-1、p-LATS、p-YAP结合,CLDN18丢失后,p-LATS活性丧失,去磷酸化YAP,使其易位至细胞核,从而促进细胞增殖[9,40]。
2.3.2 CLDN18的促癌作用 促癌作用多表现在CLDN18异位激活的癌种中。在正常食管鳞状上皮,CLDN18不表达,但Barrett食管柱状上皮CLDN18的表达量是ZO-1的7倍,CLDN18可降低紧密连接H+离子的通透性,防止其攻击破坏食管鳞状上皮,从而促肿瘤发生[41]。对于胆管腺癌细胞而言,EGFR的异常过度激活导致下游Ras/Raf/MEK/ERK级联反应的激活,诱导CLDN18表达,同时CLDN18表达可进一步诱导ERK1/2磷酸化,形成正反馈回路,起到促癌作用[42-43]。
3 CLDN18.2的相关临床试验
作为靶向CLDN18.2单抗-IMAB362的Ⅱ期临床研究,MONO研究[44]证实IMAB362单药治疗复发或难治型进展期胃腺癌或低位食管癌[CLDN18.2:免疫组织化学(immunohistochemistry,IHC):强度≥2+,表达占比≥50%]的疗效[客观缓解率(objective response rate,ORR):10%,疾病控制率(disease control rate,DCR):30%]与CLDN18.2表达呈正相关即CLDN18.2高表达(IHC:强度≥2+,表达占比≥70%)的患者疗效更优。MONO研究结束后,2016年美国临床肿瘤学会(ASCO)年会中FAST研究表明:IMAB362(剂量为800 mg/m2)联合化疗(EOX:表柔比星+奥沙利铂+卡培他滨)作为一线治疗方案可显著延长进展期胃及胃食管结合部肿瘤患者生存,即无进展生存(progress free survival,PFS):5.7个月vs.7.9个月,总生存(overall survival,OS):8.7个月vs.12.5个月。研究共纳入161例患者(IHC:CLDN18.2表达强度≥2+,表达细胞占比≥50%),其中CLDN18.2表达程度较强(IHC:CLDN18.2表达强度≥2+,表达细胞占比≥70%),人群疗效更为显著(PFS:6.1个月vs.9.1个月;OS:9.3个月vs.16.6个月)。由于IMAB362主要的抗肿瘤作用是依靠抗体ADCC以及CDC,同时CLDN18在成骨细胞中高表达,敲除CLDN18的小鼠破骨细胞活性增加,导致骨量降低。研究人员考虑联合IL-2或许可以协同增强抗体ADCC作用,与此同时联合唑来膦酸预防出现严重骨质疏松。因此,与FAST研究同时进行的2015年ASCO报道的PILOT Ⅰ期临床研究以探索IMAB362联合IL-2以及唑来膦酸治疗晚期CLDN18.2阳性胃-食管交界部癌的安全性为主要研究终点,共纳入28例患者,研究表明IMAB362可与ZA/IL-2安全联合。生存收益方面,与FAST研究无较大差距(PFS:12.7周,OS:40周)。PILOT研究设计了不同浓度梯度IL-2的队列,但遗憾的是研究人员未对ZA/IL2是否能够增强IMAB362的抗肿瘤作用以及对ADCC作用的调节作用进行后续报道。
上述临床研究表明,恶心、呕吐、中性粒细胞减少、贫血、裂孔疝等是IMAB362 相关的不良反应,呕吐最为常见(55%~69%)[45],多为1~3级。
CLDN18.2涉及靶向药、小分子抑制剂、以及CART、免疫细胞治疗、抗体耦联药、肿瘤疫苗等多个治疗手段的相关研究逐渐开展,癌种涉及胃癌,胃-食管交界部癌以及胰腺癌[12]。在Clinical Trial注册的临床试验,有11项正在研究中(表2),其中2018年开始的两项Ⅲ期临床试验GLOW研究(IMAB362+CAPOXvs.CAPOX)、SPOTLIGHT 研究(IMAB362+mFOLFOX6vs. mFOLFOX6),考虑IMAB362疗效与CLDN18.2表达呈正相关,研究纳入标准均为IHC检测CLDN18.2≥2+,表达细胞占比≥75%,两项临床试验共纳入1 000余例亚洲人群,在CLDN18.2相关临床研究中规模最大、最值得期待。
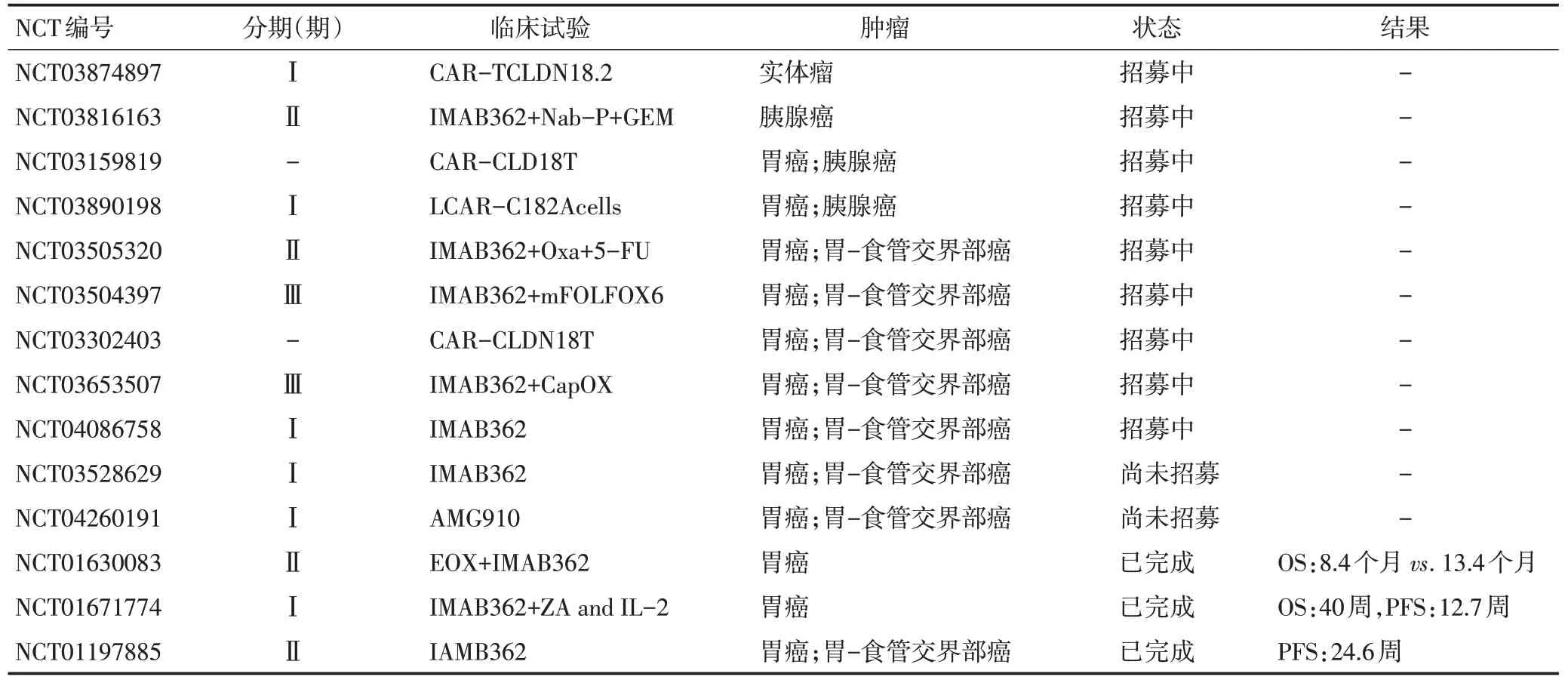
表2 CLDN18.2的相关临床试验汇总
近年来CAR-T 在晚期实体瘤中的疗效有所突破,CLDN18.2高特异性表达方式使其成为CAR-T治疗的理想靶点,CAR-CLDN18.2 T细胞治疗有望改善CAR-T 在实体瘤治疗中的处境。一项正在开展的CAR-CLDN18.2 T 细胞Ⅰ期临床试验共纳入12 例胃癌以及胰腺癌术后复发转移患者,目前的数据显示晚期患者生存获益明显:1 例完全缓解(completeremission,CR),3例部分缓解(partial remmision,PR),5例疾病稳定(stable disease,SD)以及2 例疾病进展(progressive disease,PD),1 例未统计,ORR 为33%,PFS 130 天。由于研究纳入的胃癌患者均为术后患者,因此CAR-T 对靶器官造成的损伤以及其他不良反应缺乏数据。有其它正在开展的临床研究主要针对晚期实体瘤,涵盖不能手术患者,弥补前期不足。CAR-CLDN18.2 T在多线后晚期实体瘤的疗效,不良反应中尤其是细胞因子风暴的发生几率和防控措施的探索值得期待。
总体而言,FAST研究展示了CLDN18.2作为胃癌靶点极好的前景,未来GLOW及Spotlight研究将带来CLDN18.2的“亚洲数据”,而联合治疗方案优化、高表达人群特点、获益人群甄别、标志物疗效预测、耐药后治疗方案的选择、多靶点共表达人群治疗方案的选择、免疫治疗的结合等都是未来继续探索的方向。紧随其后的CAR-T、小分子抑制剂、双抗类药物的临床试验无疑为CLDN18.2 高表达且靶向药物疗效差、或晚期多线后患者提供更多选择。
值得一提的是,靶向CLDN18.2 融入胃癌精准药物治疗以及免疫治疗时代,是未来探索热点,可能需要从精准检测、精准用药、精准监测等多方面入手。精准检测包括抗体优化、规范CLDN18.2 阳性胃癌定义、多点时空异质性;精准用药则包含精确的用药时机以及联合方案:即CLDN18.2 阳性胃癌围手术期用药管理,靶向CLDN18.2 在晚期胃癌患者一线治疗最佳联合方案以及后线治疗的价值,耐药后选择,多靶点共表达患者用药方案的选择,靶向CLDN18.2 对肿瘤免疫微环境影响以及与免疫治疗如何结合等;精准监测则是指联合目前的“液体活检”、二代测序技术,探索CLDN18.2 作为标志物的疗效判断与预后预测作用。
4 结语
FAST 研究的成功表明继HER-2 之后CLDN18.2有望成为胃癌一线治疗的新靶点,正在进行的多项临床试验也有望为CLDN18.2 阳性肿瘤患者提供更多选择。根据目前的研究结果,CLDN18.2 与细胞黏附的相关分子和通路相关可能性大,表达量与空间分布紊乱导致细胞屏障功能和细胞极性改变,参与肿瘤发生发展;未来CLDN18.2 阳性胃癌患者特点研究应着重于肿瘤细胞微环境、代谢特点。综上所述,靶向CLDN18.2 治疗“前途光明”,但距离达到精准治疗的标准,仍有非常广阔的探索空间。
