培美曲塞致皮肤色素沉着与肺腺癌化疗疗效关系的研究*
2021-05-24张琰陶洁王莹
张琰 陶洁 王莹
非小细胞肺癌(non-small cell lung cancer,NSCLC)是世界范围内死亡率最高的恶性肿瘤[1],近年来,其发病率呈增长趋势。NSCLC的主要病理类型包括非鳞状细胞癌和鳞状细胞癌,其中肺腺癌是所有NSCLC类型中最常见病理类型[2]。由于分子靶向药物及免疫治疗药物的出现,进展期肺腺癌患者的生存得以延长[3],培美曲塞是一种多靶点的抗代谢药物,对于进展期肺腺癌患者,培美曲塞联合铂类药物是目前推荐的治疗方案[4],其毒性反应更低。但个体对化疗的反应存在明显差异,在既往的临床工作中,本研究组在临床实践中发现使用培美曲塞药物治疗后出现皮肤色素沉着的患者似乎有着更好的临床缓解率,因此本研究对接受培美曲塞联合卡铂一线治疗的晚期肺腺癌患者的疗效及不良反应进行回顾性分析。
1 材料与方法
1.1 病例资料
收集新疆医科大学附属肿瘤医院2016 年1 月至2018年12月收治的117例经组织病理证实为肺腺癌的患者,均行EGFR基因检测证实为野生型。组织学分型、分级使用世界卫生组织(WHO)2015 版肺癌组织学分类,TNM分期采用国际肺癌研究学会(IASLC)第7版肺癌分期系统。117例患者中男性62例,女性55例;年龄37~71岁,平均年龄(58.49±6.88)岁;病理类型均为腺癌;分期为ⅢB~Ⅳ期,ⅢB期61例,Ⅳ期56 例;高中分化59 例,低分化58 例;有吸烟史42 例,无吸烟史75例。所有患者的诊疗方案均经本院多学科讨论及科内讨论后制定。
1.2 方法
1.2.1 治疗方法及疗效评价 患者均采用培美曲塞500 mg/m2,d1,ivgtt。在首次治疗时至少在给药前5~7 天给予口服叶酸片400 μg,1 天1 次,并持续给药至培美曲塞停药后3 周;首次给药前1 周内给予维生素B12 1 000 μg,肌肉注射,之后每3个周期给药1次。在用药前天、当天及后次日需口服地塞米松片4 mg,1天2次。卡铂注射液按照AUC=5计算,于第1天静脉滴注,每21天为1个周期,每2个周期复查CT进行疗效评价。所有患者完成4~6个周期治疗。疗效评价按照实体瘤疗效评价标准(RECIST)1.1 版进行,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD)。客观有效率(objective response rate,ORR)为CR和PR患者占所有患者的比例。无进展生存时间(progression-free survival,PFS)为肿瘤患者从接受化疗开始至疾病进展或者任何原因死亡的时间。
1.2.2 皮肤色素评价 皮肤色素沉着定义为由于过多黑色素沉积,导致皮肤变黑。评判标准参照不良事件的通用术语标准(CTCAE)4.0 版进行分级,均由研究者进行判断。CTCAE中关于色素沉着的判断分为1 级和2 级:1 级为色素沉着<10%体表面积,未对患者产生心理影响;2级为色素沉着>10%体表面积,存在心理影响[5]。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。计数资料以例数或百分比表示,组间比较采用χ2检验,PFS 比较使用Kaplan-Meier 法。以P<0.05 为差异具有统计学意义。
2 结果
2.1 培美曲塞所致皮肤色素沉着与晚期肺腺癌患者临床病理特征的关系
本研究中,皮肤色素沉着皮肤色素沉着发生率为43.6%(51/117),不同年龄、性别、肿瘤分期、分化程度及吸烟情况患者的皮肤色素沉着发生率差异无统计学意义(P>0.05,表1)。
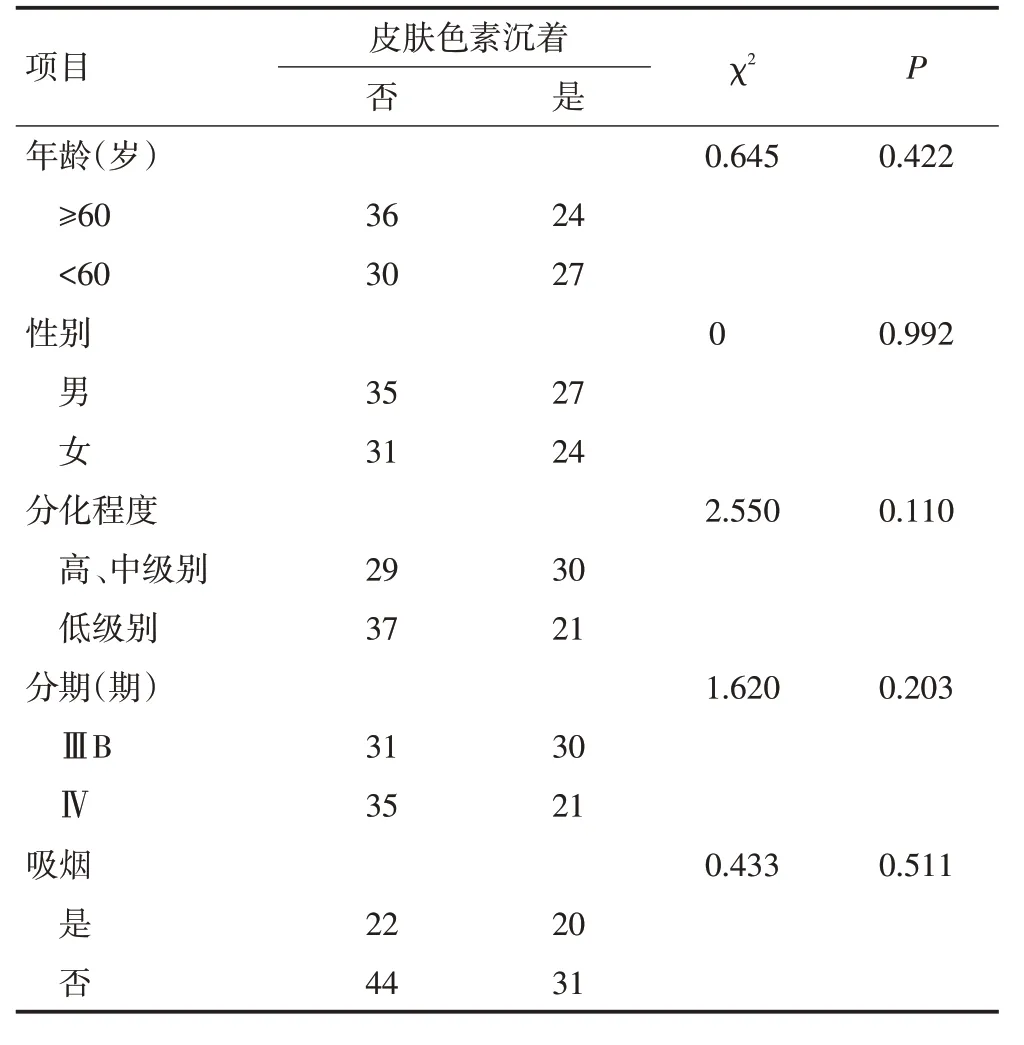
表1 皮肤色素沉着的发生与晚期肺腺癌患者临床病理特征的关系
2.2 皮肤色素沉着与培美曲塞化疗疗效的关系
所有患者一线均选用培美曲塞联合卡铂方案,出现皮肤色素沉着的患者与未出现皮肤色素沉着的患者相比,差异有统计学意义(47.1%vs. 24.2%,P<0.05,表2);出现皮肤色素沉着的患者PFS 较未出现皮肤色素沉着的患者显著延长(6.2个月vs.4.1个月,P<0.05,图1)。
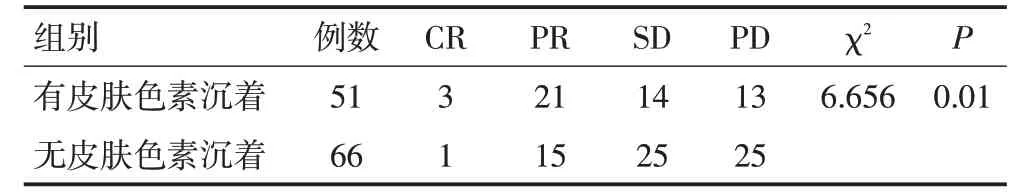
表2 皮肤色素沉着的发生与晚期肺腺癌患者一线化疗疗效的关系
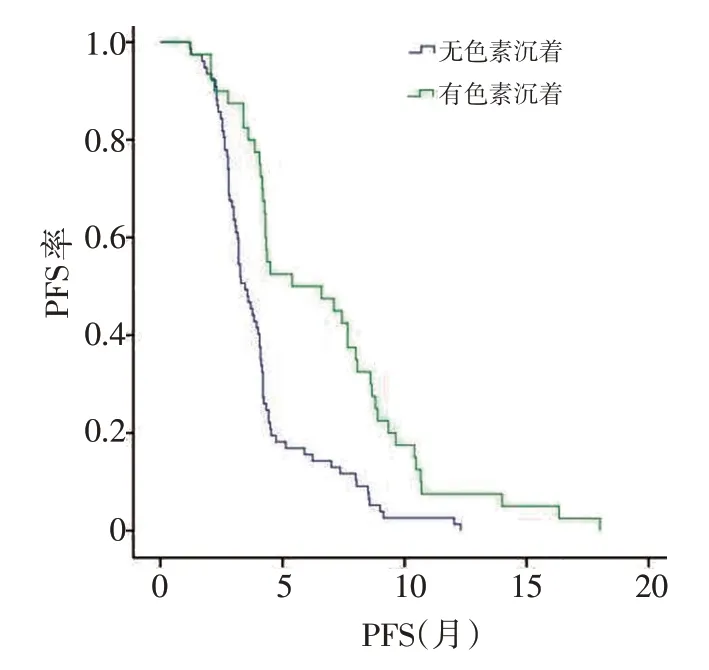
图1 皮肤色素沉着的发生与患者PFS的关系
3 讨论
肺癌是全球范围内发病率及病死率最高的恶性肿瘤,既往的治疗手段比较单一,手术、化疗及放疗为其主要的治疗手段。近年来,随着靶向药物、免疫治疗的问世,肺癌患者5 年生存率较前有着明显延长。培美曲塞联合铂类药物为目前非鳞状细胞肺癌一线治疗的标准方案。
培美曲塞是一种多靶点的抗叶酸制剂,主要通过干扰细胞内叶酸的代谢对肿瘤细胞的复制产生抑制作用,较既往其他药物联合铂类方案有着更低的不良反应发生率[6]。目前关于细胞毒药物导致皮肤色素沉着的可能机制包括:1)对黑色素细胞的直接毒性刺激黑色素合成;2)对肾上腺的毒性使促肾上腺激素和促黑素细胞激素分泌过多;3)酪氨酸激酶抑制剂缺乏;4)药物-黑素复合物的形成;5)对角蛋白细胞的毒性导致炎症后色素沉着等[7]。培美曲塞所致的皮肤色素沉着鲜见报道,目前尚未阐明该药物引起色素沉着的机制。有报道认为培美曲塞引起的色素沉着与一般的皮肤新陈代谢及内环境紊乱所致的色素沉着机制不同[8],可能是一种独特的选择性色素调节紊乱的表现形式。在本研究中,患者由于使用培美曲塞而出现色素沉着,具体的机制目前尚不明确,可能是由于培美曲塞导致体内的黑素细胞数量升高,也可能因为培美曲塞直接刺激表皮黑素细胞的形成所致。在既往的临床工作中,笔者发现使用培美曲塞后出现色素沉着的患者有着更好的临床缓解率,但翻阅文献并未有报道此不良反应与化疗疗效之间的关系,可能是由于皮肤色素沉着对患者来说主要影响外形美观,并不会造成过多的不适,易被忽视。
本研究对一线使用培美曲塞联合卡铂方案进行化疗的117例晚期肺腺癌患者进行观察,出现皮肤色素沉着51例,发生率为43.6%。皮肤色素沉着的主要部位为面部及手足。通常在治疗的第1 周期结束后即可观察到该不良反应,随着治疗的结束后的2~3个月,症状逐渐减轻或者消失。皮肤色素沉着的发生率与晚期肺腺癌患者年龄、性别、分期、肿瘤分化程度及吸烟史无关。发生皮肤色素沉着的患者化疗有效率为47.1%(24/51),高于未出现皮肤色素沉着患者的有效率(24.2%,16/66);出现皮肤色素沉着患者的PFS 为6.2 个月,优于未出现皮肤色素沉着患者(4.1个月)。
综上所述,本研究发现培美曲塞所导致皮肤色素沉着的患者其化疗的有效率及PFS 均优于未出现皮肤色素沉着的患者,皮肤色素沉着有望成为培美曲塞治疗晚期肺腺癌的疗效预测指标。在日常的诊疗过程中需要重视对皮肤色素沉着的观察,对于存在皮肤色素沉着的患者,应叮嘱注意平时的皮肤清洁,避免摩擦,注意防晒及热水烫洗。但由于本研究病例数较少且为回顾性的研究,仍需进一步扩大样本量并开展前瞻性研究,针对色素沉着的发生机制及与化疗药物的疗效开展更深入的研究,探究两者的关系。
