肝癌肝移植术后复发转移的免疫治疗
2021-05-20刘少儒许磊波
刘少儒 许磊波
原发性肝癌(肝癌)的发病率和死亡率居高不下,每年全球有超过70万例肝癌患者死亡,给人类社会带来了沉重的负担[1]。肝癌起病隐袭,早期诊断率低,仅20%~30%的初诊肝癌患者有机会进行根治性手术[2]。化学药物治疗(化疗)对肝癌的疗效非常有限,分子靶向治疗药物具有一定疗效,但仍不理想。免疫治疗是近期肿瘤治疗领域的热点,针对细胞毒T淋巴细胞相关抗原(cytotoxic T lymphocyteassociated antigen,CTLA)-4和程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)/程序性细胞死亡蛋白配体1(programmed cell death proteinligand 1,PD-L1)通路的药物已在多种肿瘤包括肝癌中取得明显疗效[3-5]。
肝癌是我国肝移植的主要适应证之一,术后复发转移是影响受者长期生存的重要因素。数据表明,肝癌肝移植受者术后5年复发率达20.0%~57.8%,常见复发转移部位为肺(37.2%~55.7%)和移植肝(37.8%~47.9%)。肝癌肝移植术后一旦发生复发转移,疾病将迅速进展[6]。肝癌肝移植术后复发转移应如何进行个体化治疗、是否可以采取免疫治疗尚有较多争议。本文将从肿瘤免疫逃逸、移植免疫耐受、肝癌肝移植术后复发转移免疫治疗现状、肝癌肝移植术后复发转移免疫治疗策略4个方面进行综述。
1 肿瘤免疫逃逸
机体的免疫系统具有免疫监视、免疫防御和免疫自稳的作用,而肿瘤细胞可通过多种机制如逃避免疫监视、诱导T细胞耗竭等逃避机体免疫系统的识别、攻击和杀灭,从而在宿主体内生存和增殖,这种现象称为肿瘤免疫逃逸,是肿瘤的重要特征之一。研究表明,PD-1/PD-L1通路是一种重要的肿瘤免疫逃逸机制。PD-1是T细胞活性的负调控因子,当T细胞与PD-L1和PD-L2相互作用时,其活性受到抑制。而肿瘤细胞可表达PD-L1,从而抑制免疫系统的清除作用。
Ma等[7]在2个队列共纳入498例肝癌患者的研究中发现,PD-L1高表达与血清甲胎蛋白(alphafetoprotein,AFP)高水平,肿瘤、淋巴结、转移(tumor,node,metastasis,TNM)分期晚期或巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)分期晚期正相关。Calderaro等[8]在217例肝癌患者中发现,肿瘤细胞或肿瘤微环境中炎症细胞高表达PD-L1,都会使肿瘤侵袭性增加,表现为血清AFP水平高、分化较差、血管浸润。Dai等[9]发现癌旁细胞高表达PD-L1的患者,在接受根治性肝癌切除术后,复发和转移风险更高,预后更差。PD-1/PD-L1是肿瘤微环境中介导免疫逃逸的关键分子,靶向PD-1/PD-L1治疗可恢复自身免疫细胞对肿瘤的清除作用,是免疫检查点抑制剂(immune checkpoint inhibitor,ICI)抗肿瘤治疗的理论基础。PD-1/PD-L1抑制剂因具有良好的临床疗效,近年来已成为肿瘤免疫治疗领域的热点之一。
2 移植免疫耐受
排斥反应是指移植受者对移植物进行攻击、破坏和清除的过程,包括抗体介导和细胞介导的排斥反应。T细胞在移植免疫耐受形成过程中发挥着重要作用,其接受第一信号和第二信号的共同刺激,第二信号即共刺激分子。共刺激分子分为正性刺激信号(CD27-H7、CD40-CD154)和负性刺激信号(CTLA-4、PD-1/PD-L1、OPG、DcR3),当前者占优势时,T细胞则增殖活化为效应性T细胞,提高免疫活性;当后者占优势时,则形成免疫耐受。
PD-1/B7-H1通路是免疫反应重要的负向调节途径,B7-H1在供者组织细胞中高表达,并与同种异体移植物中浸润T细胞的凋亡相关。阻断PD-1/B7-H1通路或敲除B7-H1,均会导致小鼠移植模型中移植物免疫细胞浸润,发生出血和坏死,并导致受体小鼠术后12 d内死亡[10]。有研究表明,PD-1参与形成移植免疫耐受[11-12]。
王英等[13]在35例肝移植受者中发现,与发生急性排斥反应的受者比较,未发生急性排斥反应的受者CD8+T细胞和CD4+T细胞表面PD-1的表达水平更高,且PD-1的表达水平与丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转移酶(γ-glutamyl transferase,GGT)水平呈负相关。CD8+T细胞和CD4+T细胞表面PD-1的表达在保护移植肝、诱导移植免疫耐受中具有重要作用。应用免疫抑制剂如他克莫司(tacrolimus,Tac),也可诱导PD-1表达上调,表明PD-1在移植免疫耐受中具有重要作用,其机制可能为通过传递抑制性信号或促进调节性T细胞(regulatory T cell,Treg)发挥作用[14-15]。
B7、CD28、CTLA-4之间的相互作用是调节细胞介导的排斥反应的主要机制[16]。T细胞活化后,CTLA-4在细胞膜上的表达上调,通过多种机制抑制T细胞的功能,包括竞争性结合CD28的配体B7和诱导T细胞周期终止等,以维持免疫稳态及诱导免疫耐受形成[17]。
PD-1主要在免疫耐受形成的维持期起作用,而CTLA-4则在免疫耐受形成的诱导期起作用。CTLA-4对高黏附性T细胞产生的抑制作用相对更强,而PD-1可同时抑制T细胞和B细胞,两者在免疫耐受形成过程中起着相互补充、相互协同的作用[18]。负性共刺激分子及其调节网络在移植免疫耐受中起着重要的调节作用,研究其分子机制有助于诱导移植受者免疫耐受的形成。
过度活跃的表皮生长因子受体、丝裂原活化蛋白激酶、磷脂酰肌醇-3-激酶/蛋白激酶(phosphatidylinositol-3-kinase/protein kinase,PI3K/Akt)通路以及缺氧诱导因子(hypoxia-inducible factor,HIF)-1驱动的信号通路异常活化可导致肿瘤微环境中PD-L1表达上调[19-21]。肿瘤细胞能够通过选择性表达PD-L1来逃避细胞介导的免疫反应。肿瘤细胞表面的PD-L1与效应性T细胞和活化的自然杀伤(natural killer,NK)细胞表面的PD-1结合可有效地阻断细胞介导的免疫反应。在器官移植受者发生恶性肿瘤的情况下,同时使用免疫抑制剂和ICI,可能会在抗肿瘤的同时导致排斥反应,如何权衡两者显得尤为重要。
3 肝癌肝移植术后复发转移的免疫治疗现状
肿瘤免疫治疗包括单克隆抗体类ICI、细胞治疗[淋巴因子激活杀伤细胞(lymphokineactivated killer cell,LAK)、细胞因子诱导杀伤细胞(cytokine-induced killer cell,CIK)、肿瘤浸润性淋巴细胞(tumor in filtrating lymphocyte,TIL)、嵌合抗原受体T细胞(chimeric antigen receptor- T cell,CAR-T)、T细胞受体T细胞(T cell receptor- T cell,TCR-T)]、治疗性抗体、癌症疫苗、小分子抑制剂及免疫调节剂。目前ICI应用最为广泛,其中针对CTLA-4和PD-1/PD-L1通路的免疫治疗应用较成熟。通常认为器官移植受者需长期应用免疫抑制剂,禁忌使用ICI以免诱发排斥反应。但免疫细胞在抑制肿瘤发生发展中具有重要作用,如何应用ICI使得机体发挥抗肿瘤效应而不引起排斥反应,权衡两者取其重是肝癌肝移植术后复发转移治疗中亟需探讨的问题。
多项文献报道,肝癌肝移植术后复发转移受者采用免疫治疗后预后不佳,不良反应明显。汪国营等[22]报道了1例肝硬化合并肝癌患者肝移植术后复发,采用帕博利珠单抗治疗后诱发急性免疫性肝炎的病例。肝穿刺活组织检查(活检)后,予糖皮质激素冲击治疗及加强免疫抑制治疗,受者带瘤生存,生存期超过8.0个月,但肝功能持续异常。Varkaris等[23]报道1例肝癌合并肝硬化患者肝移植术后复发,使用索拉非尼、卡培他滨联合放射治疗(放疗),病情稳定一段时间后肿瘤再次进展,最后采用帕博利珠单抗治疗,3个月后肿瘤迅速进展,受者死亡,期间未发生明显排斥反应。Gassmann等[24]报道了1例肝癌患者接受原位肝移植术后2年复发,索拉非尼治疗不良反应明显,且肿瘤进展,综合考虑后采用纳武单抗治疗。1个疗程后出现肝功能异常,肝穿刺活检示排斥反应明显。大剂量糖皮质激素冲击及Tac加强免疫抑制治疗,肝功能持续恶化,受者出现凝血功能障碍,最终死于颅内出血。2例纤维板层型肝癌患者分别于11岁和16岁确诊,肝移植术后肿瘤复发,接受纳武单抗治疗后均出现不可逆的急性排斥反应,并最终死亡,肝穿刺活检显示PD-1和PD-L1免疫荧光染色阳性[25]。
大多数临床资料显示肝癌肝移植术后复发转移受者采用免疫治疗的预后不良,但也有治疗成功的案例。Amjad等[26]报道了1例肝癌合并丙型病毒性肝炎(丙肝)肝硬化患者,在治疗丙肝后接受肝移植治疗,免疫抑制方案为Tac+吗替麦考酚酯(mycophenolate mofetil,MMF)。1年后肿瘤复发且多处转移,PD-L1免疫组织化学染色阳性,但肝功能良好,遂使用纳武单抗治疗,第4疗程时出现肝酶升高,停药1次并使用泼尼松治疗。治疗6个月后,肝脏病变及所有转移性病变均坏死或消失,效果显著,已影像学无瘤生存24.0个月,在可评估生存情况的接受免疫治疗的肝癌肝移植术后复发转移受者中,该受者目前生存期最长。Rammohan等[27]报道1例肝癌肝移植术后肺转移的受者,采用索拉非尼治疗后肿瘤进展,使用帕博利珠单抗治疗效果明显,已影像学无瘤生存10.0个月。De Toni等[28]报道1例肝癌肝移植术后转移受者,行纳武单抗治疗15个疗程,生存时间达10.0个月。DeLeon等[29]回顾性分析了7例肝移植术后复发转移接受PD-1抑制剂治疗受者的临床特征,其中5例为肝癌,2例为黑色素瘤(1例原发病非肝癌)。7例受者中2例发生排斥反应,1例获得完全缓解,3例疾病进展,1例发生多器官衰竭;中位总体生存期和无进展生存期分别为1.1(0.3~21.1)个月和1.8(0.7~21.1)个月。Kuo等[30]报道1例肝移植受者移植肝中出现恶性周围神经鞘膜瘤样黑色素瘤,接受了伊匹单抗和帕博利珠单抗治疗,受者耐受良好,接受25个疗程的免疫治疗后移植物功能正常,无需更改免疫抑制方案。Morales等[31]报道了1例肝移植术后黑色素瘤,行伊匹单抗治疗后部分缓解,生存时间已达10.0个月。在出现抗肿瘤反应的受者中,生存期最长超过24.0个月[26]。肝癌肝移植术后复发转移或新发其他肿瘤受者免疫治疗的临床特征见表1、2[22-31],序贯使用伊匹单抗与帕博利珠单抗,虽无排斥反应,但病例数仅为1例,无法合理评价疗效。上述病例中,肝癌肝移植术后复发转移受者免疫治疗后排斥反应的发生率为39%(5/13),因此此类受者采取免疫治疗需慎之又慎。
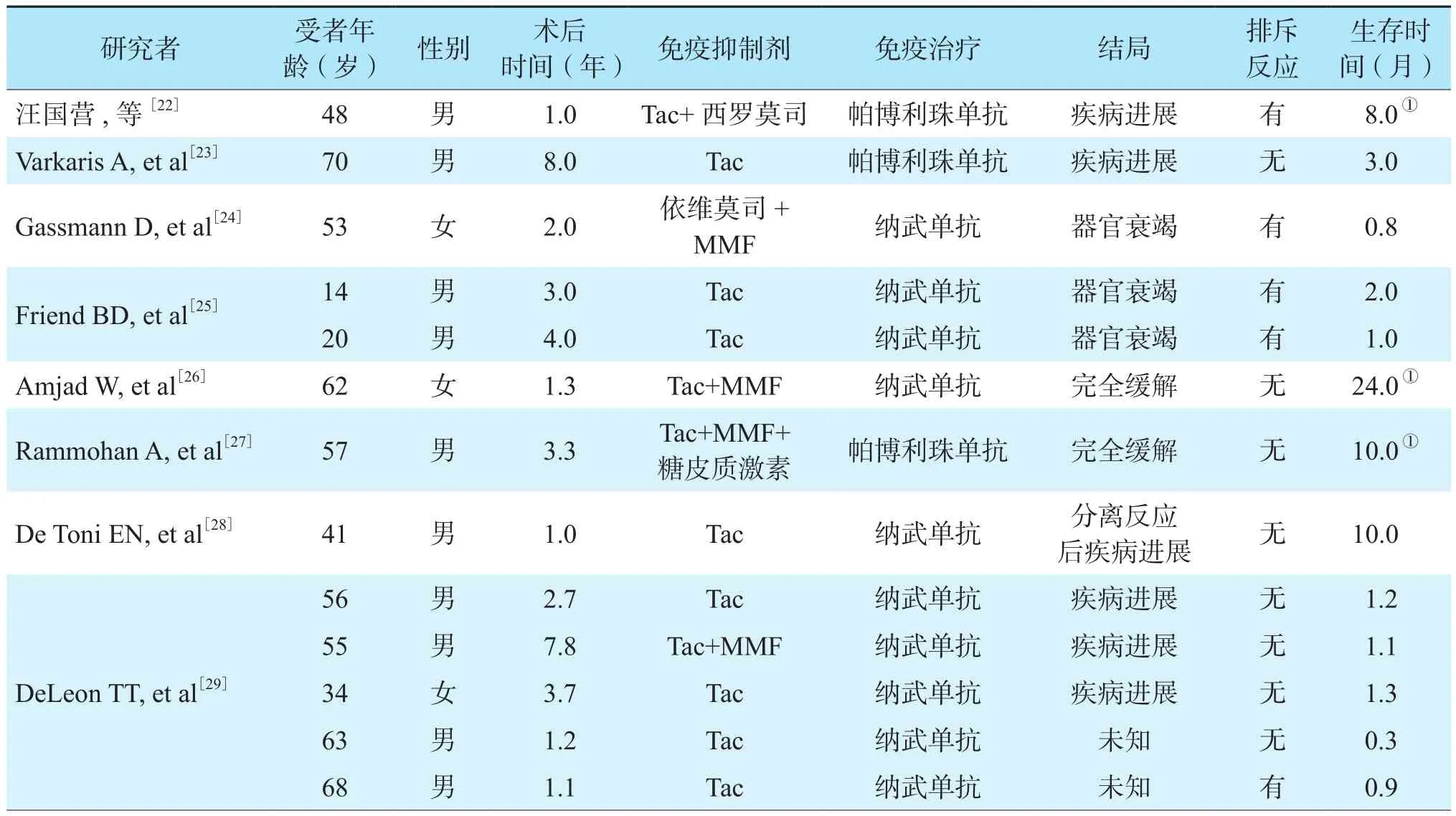
表1 肝癌肝移植术后复发转移受者免疫治疗的临床特征Table 1 Clinical characteristics of immunotherapy for recipients with recurrence and metastasis after liver transplantation for liver cancer

表2 肝癌肝移植术后新发其他肿瘤受者免疫治疗的临床特征Table 2 Clinical characteristics of immunotherapy for recipients with other de novo tumors after liver transplantation for liver cancer
4 肝癌肝移植术后复发转移的免疫治疗策略
4.1 个体化免疫治疗
有报道肝移植受者因黑色素瘤接受免疫治疗后,具有抗肿瘤效应而无排斥反应,移植物功能良好[29-33]。从免疫学的角度来看,具有抗肿瘤反应与不发生排斥反应是相互矛盾的,但文献报道有21%的受者存在这种情况[34]。理想情况下,应明确移植器官免疫耐受和肿瘤免疫逃逸是PD-1依赖性的还是其它分子依赖性的,从而有针对性地选择ICI治疗,最大程度地发挥免疫治疗效应,同时避免诱导急性排斥反应[35]。Aguirre等[36]汇总了39例实体器官移植受者的临床资料,16例接受ICI治疗后发生了排斥反应,5例进行了PD-L1检测,其中4例移植物PD-1/PD-L1阳性,表明PD-L1表达水平不仅可以预测PD-1/PD-L1抑制剂肿瘤治疗应答率,也可预测排斥反应发生率。发生急性排斥反应的受者活检显示PD-L1表达水平升高,而没有发生排斥反应的受者活检(包括其中1例治疗前活检)均未显示PD-L1阳性[25,29,37]。因此,建议在肝移植受者进行ICI治疗前应常规进行移植肝活检,并且在选择PD-1/PD-L1或CTLA-4抑制剂时应将PD-L1检测结果纳入考虑范围。
由于排斥反应存在不良后果,因此通常在常规药物治疗失败后才会使用ICI。一般ICI首次用药不久后可发挥作用(大多数发生在治疗后的3个月内)[38],但药效延迟可能导致ICI产生有效作用前发生疾病进展或器官功能障碍,这可能是接受ICI治疗的肝移植受者发生不良结局较多的原因。我们建议将ICI治疗作为肝癌肝移植术后治疗的二线方案之一,在一线治疗期间严密观察,一旦发现肿瘤复发或进展,根据受者的具体情况、潜在的肿瘤学效益以及排斥反应发生的可能性,尽早决定是否进行免疫治疗。
4.2 个体化免疫抑制方案
免疫抑制剂可能会影响ICI的疗效,因ICI发挥作用需要完整的T细胞反应,是否同时使用糖皮质激素治疗仍然存在争议。最近一项研究表明,同时使用糖皮质激素并不一定会影响ICI的疗效[39]。另一篇文献报道,为了避免ICI介导的排斥反应,预防性应用大剂量糖皮质激素治疗,并未影响受者的治疗效果[40]。因此,在没有禁忌证且治疗过程中免疫抑制剂逐渐减量的情况下,可尝试使用糖皮质激素进行预防性治疗[28,31-32]。值得注意的是,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂具有抗细胞增殖和抗血管生成作用,并且可延长肝癌肝移植受者的生存期,因此可考虑西罗莫司和ICI联合应用[41]。
目前数据表明,PD-1/PD-L1抑制剂的抗肿瘤效应优于CTLA-4抑制剂,但PD-1/PD-L1通路在维持同种异体移植器官免疫耐受中起着重要作用[42],因此更易诱发排斥反应。上述病例中,CTLA-4抑制剂导致的排斥反应发生率仅为33.3%,但由于病例数较少且多为回顾性研究,因此不足以得出肝移植受者接受CTLA-4抑制剂比PD-1/PD-L1抑制剂更安全的结论。同理,在开始ICI治疗之前,建议常规行移植肝活检,如果PD-L1阳性,则可考虑使用CTLA-4抑制剂进行治疗。
4.3 免疫细胞治疗
在某些实体肿瘤中,TIL过继转移治疗和经工程改造以表达识别肿瘤抗原的重组TCR-T治疗取得了良好疗效[43];CAR-T对晚期淋巴瘤和复发、难治性急性淋巴细胞白血病具有良好效果[44-46],但目前尚无在肝癌肝移植术后复发转移受者中使用免疫细胞治疗的报道。从作用机制上推测,将改造后特异识别肿瘤抗原的T细胞用于治疗肝癌肝移植术后复发转移,可能在不引起排斥反应的同时发挥抗肿瘤效应。
5 结 语
综上所述,肝癌肝移植术后复发转移的免疫治疗经验尚浅,需严格筛选病例和治疗方案,且治疗期间应严密观察肝功能和排斥反应,一旦发生严重的排斥反应,需加强免疫抑制方案以保留移植物功能。为了更好地治疗具有免疫检查点的肝移植受者,多学科团队之间应密切合作,与受者及其家属就风险和益处进行充分讨论,并进行密切的临床随访,寻找可以预测排斥风险和肿瘤反应的生物标志物,并研究将抗移植物反应与抗肿瘤效应相分离的治疗方案。
