微血管侵犯对肝癌肝移植受者预后影响的临床研究
2021-05-20王建丰曾凯宁李海波邓宜南张英才张彤易述红汪根树杨扬陈规划
王建丰 曾凯宁 李海波 邓宜南 张英才 张彤 易述红 汪根树 杨扬 陈规划
原发性肝癌(肝癌)是最常见的恶性肿瘤之一,其发病率位于恶性肿瘤中的第6位[1-2]。随着对肝癌基础研究的逐渐深入及临床治疗经验的不断探索,针对不同分期的肝癌,可选择的治疗方式也变得多种多样。原位肝移植已被用作治疗肝癌和其他潜在肝病的有效手段,但术后肿瘤复发可严重影响其临床效果。美国多中心样本数据表明,符合米兰标准的肝癌肝移植受者术后5年无复发生存率(recurrencefree survival,RFS)为68.2%,总体生存率(overall survival,OS)为71.3%,复发率为11.1%,且大多在肝移植术后1~2年内复发[3]。微血管浸润(microvascular invasion,MVI)是肝癌肝切除或肝移植术后复发的危险因素[4-5]。MVI难以通过术前影像学确定,只能通过肿瘤标本来评估。MVI与肝癌肝移植受者生存状态相关[6-8]。目前将MVI作为肝移植术后预后指标的临床研究仍较少,且当前尚缺乏术前诊断MVI的方法。本研究探讨MVI的发生及其对肝癌肝移植受者预后的影响,为改善肝癌肝移植受者预后提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2014年1月至2017年6月中山大学附属第三医院肝移植中心行肝癌肝移植手术的177例受者的临床资料。根据术后经病理学检查是否证实MVI,分为MVI阳性组(64例)和MVI阴性组(113例)。MVI阳性组,男59例,女5例,年龄54(47,62)岁,原发病包括包括乙型、丙型等病毒性肝炎后肝癌53例,酒精性肝病后肝癌6例,胆汁淤积性肝病后肝癌5例;MVI阴性组,男106例,女7例,年龄49(43,57)岁,原发病包括乙型、丙型等病毒性肝炎后肝癌88例,酒精性肝病后肝癌17例,胆汁淤积性肝病后肝癌4例,其他原因肝癌4例。收集受者肝移植前局部治疗史,对比治疗前后肿瘤的大小、数量,根据美国癌症联合委员会肝癌分期系统(第8版),将成功实现肿瘤、淋巴结、转移(tumor,node,metastasis,TNM)降期的定义为降期治疗成功,将未行局部治疗或行局部治疗后未能成功降期的定义为术前未成功降期。本研究得到了医学伦理委员会批准,受者均签署知情同意书。
纳入标准:(1)初次同种异体肝移植手术;(2)术前影像学资料确诊为肝癌或术后病理学检查被证实为肝癌。排除标准:(1)围手术期因手术并发症死亡;(2)随访资料不完整;(3)术中或术后病理学检查发现存在大血管侵犯或远处转移。
1.2 随访内容
肝移植术后对所有受者进行常规随访。出院后前2年,每2个月随访1次,之后每3~6个月随访1次。当存在肿瘤复发的可疑证据时,可增加随访的频率。在常规随访期间,受者均接受血常规、肝肾功能、肿瘤学标志物等血液学检查和腹部超声造影、增强CT或MRI、胸部增强CT等影像学检查,必要时做正电子发射计算机体层显像仪(positron emission tomography and computed tomography,PET/CT)检查。随访时间截止至2020年10月1日。OS定义为肝移植手术当日至受者死亡或随访截止时所有受者的生存率,RFS定义为肝移植手术当日至术后肿瘤首次复发或随访截止时所有受者的生存率。
1.3 研究内容
比较MVI阴性组和MVI阳性组受者的临床资料,包括性别、年龄、体质量指数(body mass index,BMI)、终末期肝病模型(model for end-stage liver disease,MELD)评分、肿瘤分化程度、术前甲胎蛋白(alpha-fetoprotein,AFP)水平、Child-Pugh分级、肿瘤最大直径、肿瘤数量、有否卫星灶、是否符合米兰标准等,分类选取合适的截断值[9-12];分析肝癌肝移植受者的预后,包括所有受者的OS和RFS、两组受者的OS和RFS等;对影响肝癌肝移植受者预后的危险因素进行单因素分析,包括年龄、MELD评分、肿瘤分化程度、术前AFP水平、肿瘤最大直径、肿瘤数量、有否卫星灶、有否MVI、术前是否成功降期等,将有统计学意义的变量再纳入多因素分析。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,比较采用Shapiro-Wilk检验或t检验;不符合正态分布的计量资料采用中位数(下四分位数,上四分位数)表示,比较采用Mann-WhitneyU检验;计数资料以率表示,比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier法绘制生存曲线,比较采用log-rank检验;将单因素分析中有统计学意义的变量采用逐步法纳入模型,采用Cox回归分析进行多因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 肝癌肝移植受者的预后分析
中位随访时间为48个月。177例肝癌肝移植受者中,79例肿瘤复发,复发率为44.6%。肝癌肝移植受者1、3、5年OS和RFS分别为80.2%、62.1%、58.5%和66.3%、57.5%、51.2%。MVI阳性组受者的1、3、5年OS和RFS分别为70%、39%、35%和53%、39%、33%,低于MVI阴性组受者的86%、75%、72%和73%、68%、63%,差异均有统计学意义(均为P<0.05,图1)。

图1 肝癌肝移植受者的生存曲线Figure 1 Survival curves of recipients after liver transplantation for liver cancer
2.2 两组受者临床资料的比较
177例肝癌肝移植受者中,64例(36.2%)经病理学确诊为MVI阳性,其中肿瘤最大直径<3 cm和>8 cm的受者MVI发生率分别为27%和57%。与MVI阴性受者相比,MVI阳性受者的肿瘤分化程度较低、术前AFP水平较高、肿瘤最大直径较大、肿瘤数量较多、伴卫星灶较多、不符合米兰标准的例数较多(均为P<0.05,表1)。

表1 两组受者临床资料的比较Table 1 Comparison of clinical data of recipients between two groups
2.3 影响肝癌肝移植受者预后危险因素的单因素分析
影响肝癌肝移植受者生存情况单因素分析结果见表2。影响肝癌肝移植受者RFS和OS的危险因素包括肿瘤分化程度、术前AFP水平、肿瘤最大直径、肿瘤数量、有否卫星灶、有否MVI、术前是否成功降期(均为P<0.05),而受者年龄、MELD评分不是影响肝癌肝移植受者RFS和OS的危险因素(均为P>0.05)。

表2 影响肝癌肝移植受者RFS和OS危险因素的单因素分析Table 2 Univariate analysis of risk factors for RFS and OS of recipients after liver transplantation for liver cancer
2.4 影响肝癌肝移植受者预后危险因素的多因素分析
多因素Cox回归分析结果显示,肿瘤最大直径>8 cm、术前AFP水平≥20 ng/mL、肿瘤中低分化及MVI阳性是影响肝癌肝移植受者OS的独立危险因素(均为P<0.05,表3);MVI阳性、肿瘤中低分化及术前未成功降期是影响肝癌肝移植受者RFS的独立危险因素(均为P<0.05,表4)。
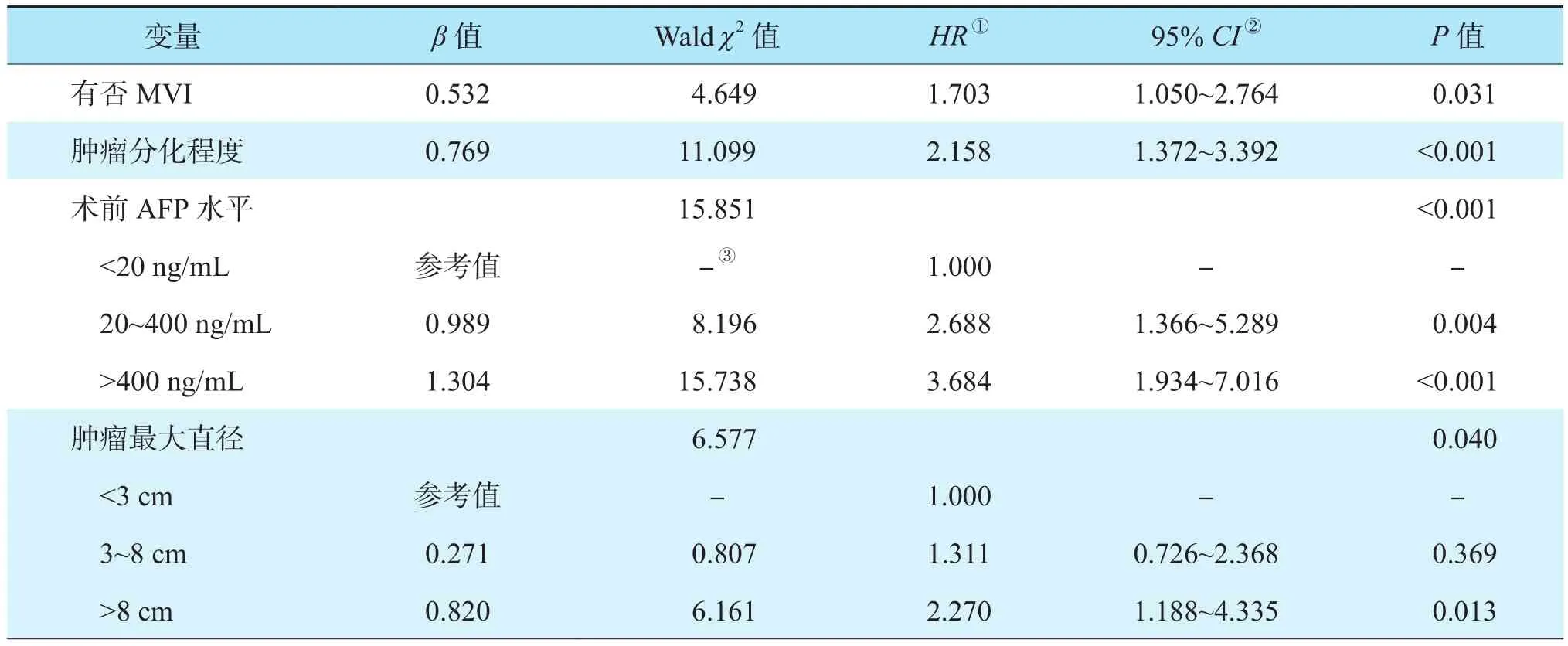
表3 影响肝癌肝移植受者OS危险因素的多因素分析Table 3 Multivariate analysis on the risk factors of OS of recipients after liver transplantation for liver cancer
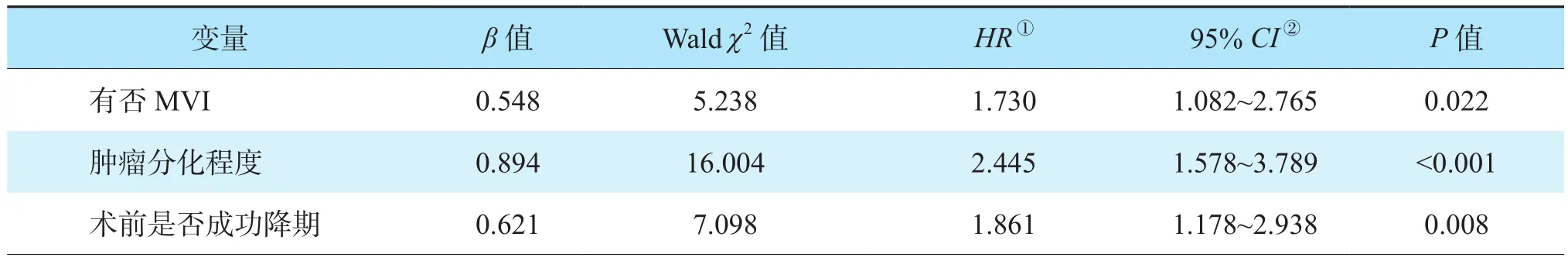
表4 影响肝癌肝移植受者RFS危险因素的多因素分析Table 4 Multivariate analysis on the risk factors of RFS of recipients after liver transplantation for liver cancer
3 讨 论
MVI是肝癌患者肝切除和肝移植术后预后较差的重要因素[13-16]。本研究中,MVI的发生率为36.2%,其中肿瘤最大直径<3 cm和>8 cm的受者MVI发生率分别为27%和57%,与其他中心的报道一致[17-18]。MVI阳性受者的5年OS和RFS略低于江涛等[19]报道的36.5%和42.3%。
本研究结果显示MVI阳性组受者1、3、5年OS和RFS均低于MVI阴性组受者,表明MVI是影响肝癌肝移植受者预后的重要危险因素,有研究证实MVI能更好地预测肿瘤复发和受者生存情况[19-22]。已有研究团队建立了一些结合临床特征、实验室指标和影像学特征的临床预测模型,可更准确预测MVI,如Nitta等[21]构建的预测肿瘤外MVI的列线图模型和Jiang等[22]根据放射学特征和临床变量以及三维卷积神经网络(3D-CNN)开发的XGBoost(eXtreme Gradient Boosting)模型。
本研究结果表明肿瘤最大直径>8 cm、术前AFP水平≥20 ng/mL、肿瘤中低分化和MVI阳性是影响肝癌肝移植受者OS的独立危险因素,而MVI阳性、肿瘤中低分化以及术前未成功降期是影响肝癌肝移植受者RFS的独立危险因素,与相关研究报道一致[3,19,23]。发生MVI预示着OS和RFS较低,而仅凭有否MVI,可能无法准确预测受者的预后情况。有研究对MVI进行亚组分析,发现受者的预后与MVI的数量和分布情况有关[24-25]。我国《原发性肝癌规范化病理诊断指南》根据MVI的数量和分布情况进行了风险分级,M0为未发现MVI;M1(低危组)为发现5个MVI,且发生于近癌旁肝组织区域(1 cm);M2(高危组)为发现>5个MVI,或MVI发生于远癌旁肝组织区域[26]。刘荣军等[23]发现MVI分级是影响肝癌肝移植受者预后的独立危险因素,且MVI分级越高,受者预后越差。术前局部治疗可消除MVI,但也有研究报道降期治疗成功患者的预后较符合米兰标准肝移植受者差[27]。因此,应将MVI视为全身性疾病,必要时应采取全身治疗降低术后复发率。
综上所述,MVI对肝癌肝移植受者预后具有重要影响,是影响OS和RFS的独立危险因素。受者的肿瘤分化程度低、术前AFP水平高、肿瘤最大直径大、肿瘤数量多、伴卫星灶多是MVI发生的危险因素,MVI可能成为指导肝癌肝移植术后治疗的重要指标。本研究是单中心回顾性队列研究,样本量较小,可能存在选择偏倚,且本研究未根据MVI的数量及分布情况进行分级,未探讨MVI的分布及数量对肝癌肝移植受者预后的影响。今后将扩大样本量,纳入更加详细的MVI分布情况,结合更多的MVI预测指标如生物学指标,建立一个基于影像学、生物学、病理学等的多因素评分体系,以更好地预测MVI的发生及其对肝癌肝移植受者预后的影响。
