CNBr-Papain-Sepharose 4B 亲和填料的制备及其性质研究
2021-05-18刘明宇李树红谭小千
刘明宇, 李树红, 杨 娟, 林 昊, 杨 珂, 谭小千
(四川农业大学 食品学院,四川 雅安625000)
木瓜蛋白酶Papain 是一类半胱氨酸蛋白酶,由212 个氨基酸残基组成,并含有3 对二硫键。构成其三维结构的两个结构域之间形成一个缝隙,缝隙内含有酶的活性位点[2],而半胱氨酸蛋白酶抑制剂(Cysteine proteinase inhibitors,CPIs) 是一类蛋白质水解酶抑制因子,其分子活性中心含有半胱氨酸残基(Cys-His)活性基团。它的3 个疏水结构域构成了一个可外露的锲形结构边缘,与Papain 在结构上高度互补,进而专一地抑制Papain 的活性[3]。 因此,可在分离半胱氨酸蛋白酶抑制剂时,将Papain 作为配基,偶联在活化的载体上,如曾仲奎[4]等曾以Papain为配基纯化百合巯基蛋白酶抑制剂。
Cystatins 广泛存在于动物体内,属于CPIs 的一个类群,目前对鱼类Cystatins 的性质及应用研究尚有不足。 对鱼源Cystatins 的精准分离纯化是研究其酶学特性的前提;另一方面,本团队前期研究表明,鱼卵、皮、肝胰等加工废弃组织及鱼糜加工的废弃漂洗水[5-8]中存在大量Cystatins 活性。 有报道显示,鱼源Cystatin 在抑制鱼糜凝胶软化[9]、鱼片抑菌[10]和保鲜[11]等食品领域具有潜在的应用前景,但目前尚缺少对从鱼类废弃组织及漂洗水中回收Cystatin 的高效方法。
基于团队前期实验制备的重组鱼类Cystatins能专一高效地与Papain 结合[11],作者所在实验室自制了亲和填料(CNBr-Papain-Speharose 4B)并以木瓜蛋白酶Papain 为配基,以对鲢鱼重组Cystatins 的吸附性能为评价指标, 测定了该填料配基偶联密度、稳定性、贮藏性能及重复性。 以鱼糜漂洗水为例,对该填料的CPIs 回收情况进行了验证。 该研究为今后探索精准分离、 高效回收鱼源Cystatins 的方法奠定了基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂 CNBr:购自美国Adamas 公司,纯度≥97%;KBr: 购自西亚试剂公司, 纯度≥99.5%;Papain:购自美国Sigma 公司,使用前配制成5 mg/mL 的溶液;Sepharose 4B: 购自美国Sigma 公司;重组鲢鱼Cystatin:参考陈海等[11]的方法,由作者所在实验室制备,纯度≥90%,使用前配制成5 mg/mL。
1.1.2 主要仪器设备 全波长酶标仪: 型号Varioskan flash, 购自美国Thermo electron 公司;傅立叶变换红外光谱仪:型号FTIR-650,购自天津港东科技发展公司; 高效液相色谱仪: 型号LC-2010ChT,购自日本岛津公司;全自动低中高压层析系统:型号Duo/Flow,购自美国Bio-Rad 公司。
1.2 方法
1.2.1 CNBr-Papain-Sepharose 4B 亲和填料的制备
1)Sepharose 4B 的活化 以Axéan 等[12-13]的方法为基础,略作改动,对介质Sepharose 4B 进行活化,即取6 g 捣碎后的CNBr,溶于50 mL 蒸馏水,分批小心倒入50 mL 预处理后的Sepharose 4B(pH 10.0)中。该操作在40 ℃水浴锅中进行,并用5 mol/L K3PO4-K2HPO4缓冲液(pH 9.3)调节pH,使pH 值恒定 在11.0。 用0.1 mol/L Na2CO3-NaHCO3缓 冲 液(pH 9.5) 对已活化的Sepharose 4B 进行快速抽洗,抽干后, 即可得活化的Sepharsoe 4B, 即CNBr-Sepharsoe 4B。
2)CNBr-Papain-Sepharose 4B 的偶联 取3 g CNBr-Sepharsoe 4B, 用0.6 mol/L HCl 溶液进行多次冲洗,后分别与一定体积的的5 mg/mL Papain 溶液于4 ℃混合过夜进行偶联。 后加入40 mL 的0.2 mol/L 甘氨酸溶液(pH 8.0)封闭,4 ℃搅拌过夜。 而后用含0.5 mol/L NaCl 的0.1 mol/L CH3COOH 溶液和0.1 mol/L Na2CO3-NaHCO3缓冲液重复冲洗3次, 即得已偶联Papain 的亲和层析填料CNBr-Papain-Sepharose 4B, 将其置于体积分数30%乙醇中于4 ℃下保存,备用。
1.2.2 CNBr-Papain-Sepharose 4B 亲和填料的性能分析
1)紫外光谱分析 参考Amostová 等[14]的方法,分别将Sepharose 4B、CNBr-Sepharsoe 4B 及CNBr-Papain-Sepharose 4B 的甘油混匀样于220~400 nm波长下进行扫描。
2)红外光谱分析 参考陈嫚等[15]的方法,分别制 备Sepharose 4B、CNBr-Sepharose 4B 及CNBr-Papain-Sepharose 4B 与KBr 的干燥压片样品。 以KBr 为背景, 于红外光谱仪上分别测定各样品红外光谱,波数范围为0~4 000 cm-1。
3)微球性状描述 参照孙永亮[16]等方法,各取少 量Sepharose 4B、CNBr-Sepharose 4B 和CNBr-Papain-Sepharose 4B 分别混合于蒸馏水中并均匀的涂于载玻片,置于光学显微镜(×100)下观察并拍照。
4)蛋白质浓度的测定 以史新昌等[17]的方法为基础,略作改动。 用超纯水测定C18 RP-HPLC 色谱柱的峰面积S0, 后分别将0、1、2、3、4、5 mg/mL 的Papain 及重组Cystatin 在相同条件下 (上样量均为100 μL)进行C18 RP-HPLC 分析,求得样品的峰面积Se作为标品。 以Se/S0的比值为纵坐标,以Papain及重组Cystatin 的质量浓度为横坐标, 绘制C18 RP-HPLC 的标准曲线。 测样品Se/S0,根据标准曲线计算蛋白质质量浓度及质量。
5) 配基Papain 的有效偶联密度测定 参照张琦等[18]方法,即首先按照1.2.1 的方法进行5 组偶联反应,各组取3 g 抽干的CNBr-Sepharsoe 4B 活化,加 入 不 同 体 积(12、15、18、21、24 mL)的Papain(5 mg/mL), 同时以未活化的Sepharose 4B 做5 组空白。此时实验组及各空白组Papain 的加量即偶联前蛋白质质量,各组3 次重复。 反应后过滤填料,收集各组滤液,冻干。 冻干粉溶于1 mL 超纯水,微滤后取100 μL 按1.2.2 中(4)的方法检测并计算各组偶联反应后Papain 的蛋白质质量浓度及质量,即未偶联蛋白质量,得出偶联量和相对偶联率。
CNBr-Speharose 4B 对Papain 的偶联性能计算公式为:

式中:m1为实验组偶联前蛋白质质量,mg;m2为实验组未吸附蛋白质质量,mg;m3为空白组偶联前蛋白质质量,mg;m4为空白组未吸附蛋白质质量,mg;M 为偶联前填料质量,g。

6)对重组Cystatin 有效吸附性能的测定 参考代军等[19]方法,略作改动,向1.2.2(5)中各组偶联Papain 后的亲和层析填料中添加重组Cystatin(5 mg/mL),添加比例仍以抽干的活化CNBr-Speharose 4B 为基准,即按CNBr-Speharose 4B∶Cystatin 为1∶5(g∶mL)将二者混匀后,于37 ℃振荡吸附2 h;同时以(5)中的各空白组填料(即以未活化的Sepharose 4B 偶联papian 的处理) 与重组Cystatin 混合作为Cystatin 有效吸附性能测试的各空白组,各组重复3次。 反应后抽滤,收集滤液,冻干后溶于1 mL 超纯水,微滤后取100 μL,按(4)的方法检测吸附后滤液中的Cystatin 蛋白质质量浓度及质量, 即未吸附Cystatin 蛋白质质量,计算得出吸附量和相对吸附率。
CNBr-Papain-Speharose 4B 对Cystatin 的 吸 附性能计算公式为:

式中:m1为空白组未吸附Cystatin 量,mg;m2为实验组未吸附Cystatin 量,mg;M 为加入的亲和填料总量,g。

7) 热稳定性测定 对CNBr-Papain-Sepharose 4B 进行热处理(4 ℃、10~70 ℃,12 h),而后过滤洗涤,收集滤液冻干。 冻干粉溶于1 mL 超纯水,微滤后取100 μL 按 (4) 的方法检测各组洗涤液中Papain 的蛋白质质量浓度和质量, 以计算配体Papain 的残留结合量与结合率。 后按(6)检测各处理下填料对Cystatin 的有效吸附性能, 所有实验3次重复。 以Papain 的结合率和Cystatin 的吸附率为纵坐标,以温度为横坐标作图,从而确定热稳定性。
Papain 的残留结合量和残留结合率计算公式为:
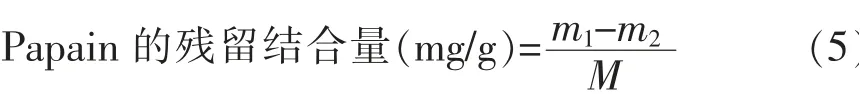
式 中:m1为Papain 总 偶 联 量,mg;m2为 反 应 组Papain 总脱落量,mg;M 为填料质量,g。

8) 酸碱稳定性测定 取CNBr-Papain-Sepharose 4B 与各缓冲液(pH 2.0~13.0)按1∶20(g∶mL)混合,37 ℃孵育12 h,后过滤并洗涤,滤液与洗涤液合并收集。各处理组的Papain 残留结合量与结合率及Cystatin 的吸附性能, 测试计算方法同(7)。以Papain 的结合率和Cystatin 的吸附率为纵坐标,以pH 值为横坐标作图,从而确定其酸碱稳定性。
9) 贮藏稳定性 各组CNBr-Papain-Sepharose 4B 与超纯水均按1∶20(g∶mL)混合,4 ℃下贮存6 个月,每月取样,以超纯水充分过滤洗涤,收集洗涤液,测各取样点填料的Papain 残留结合量与结合率及Cystatin 的吸附性能, 测试计算方法同1.2.2 中(7)。 以Papain 的结合率和Cystatin 的吸附率为纵坐标,以时间为横坐标作图,从而确定其贮藏稳定性。
10) 填料重复性测定 取5 g 按最佳料液比制备的CNBr-Papain-Sepharose 4B 亲和填料, 装柱,后用Buffer A (含50 mmol/L NaCl,1 mmol/L EDTA及1 mmol/L β-巯基乙醇的25 mmol/L 乙酸钠,pH 6.0)压实、平衡,之后按照1.2.2(6)中所确定的Cystatin 最大吸附量进行加样 (即5 g 填料上样106.3 mg),收集流出液,冻干。 后用Buffer B(含1 mol/L NaCl 的Buffer A,pH 6.0) 洗去非特异性结合的蛋白质,以Buffer A 除盐后,用洗脱液Buffer C(含50 mmol/L NaCl 及1 mmol/L EDTA 的0.25 mol/L磷酸-氢氧化钠缓冲液,pH 11.0) 进行梯度洗脱,流量0.3 mL/min,收集流出液并冻干,再用Buffer A 进行平衡,重复以上操作3 次,以上操作均于4 ℃进行。
将3 次收集的流出液冻干粉分别溶于1 mL 超纯水,微滤后按1.2.2 中(4)的方法检测3 次流出液中的未吸附Cystatin 蛋白质质量浓度及质量, 并计算吸附率。
Cystatin 的吸附率计算公式为:

式 中:M 为 加 入Cystatin 的 总 质 量;m 为 未 吸 附Cystatin 的质量。
1.2.3 鲢鱼鱼糜漂洗水中CPIs 的CNBr-Papain-Sepharose 4B 层析回收 参考李树红[20]方法,取鱼糜漂洗水进行酸处理(pH 4.0,37 ℃,30 min)及硫酸铵分级沉淀处理, 后用少量Buffer A 溶解沉淀,充分透析后浓缩至适当体积,得到浓缩CPIs 粗提液。
将CNBr-Papain-Sepharose 4B 亲和填料装柱后,用Buffer A 压实、平衡,将浓缩粗提液微滤后上样。以Buffer A 洗去不吸附的蛋白质,以Buffer B 洗去非特异性结合的蛋白质, 经Buffer A 除盐后,用Buffer C 进行梯度洗脱,流速0.3 mL/min,收集洗脱液。 根据Anastasi 等[21]的方法测定亲和层析后各收集管样品对Papain 水解荧光合成肽底物Z-Phe-Arg-MCA 的抑制活性,以确定目的蛋白质的洗脱峰。
2 结果与分析
2.1 CNBr-Papain-Sepharose 4B 的紫外光谱分析
紫外扫描结果见图1。 CNBr-Sepharose 4B 和CNBr-Papain-Sepharose 4B 均在紫外波长约220 nm 处呈现强吸收峰, 该峰为溴化氰中双键在紫外光照射下能级跃迁产生的典型吸收峰, 说明在Sepharose 4B 载体上成功引入了溴化氰。 CNBr-Papain-Sepharose 4B 在280 nm 处的吸收峰, 表明Papain 已成功偶联到载体上。
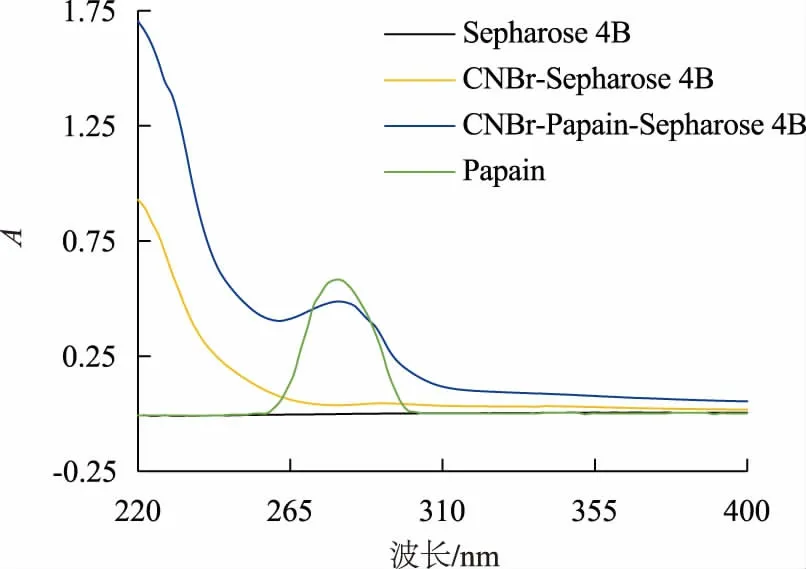
图1 紫外光谱分析Fig. 1 Assay of ultraviolet spectroscopy
2.2 CNBr-Papain-Sepharose 4B 的红外光谱分析
红外光谱的结果见图2。 未活化的Sepharose 4B 在3 446 cm-1处的吸收峰(1)是由缔合羟基(υOH)伸缩引起的,2 844 cm-1处(2)出现的是υcH吸收峰,1 381 cm-1处 (6) 出现的峰是O-H 面内弯曲振动(δO-H)的吸收峰,1 275 cm-1(7)出现的是O-H 面内弯曲振动(δO-H)的吸收峰,1 188 cm-1(9)为糖苷键υC-O-C伸缩振动吸收峰,852 cm-1(10)是糖环的σC-H伸缩振动引起的吸收峰,751 cm-1处(11)出现糖环扩张运动引起的吸收峰。CNBr 活化的Sepharose 4B 除具有上述光谱特征外,还在2 210 cm-1(3)出现了氰伸缩振动(σC≡N) 的特征吸收峰。 在此基础上, 偶联Papain 后的填料,还分别在1 672 cm-1处(4)、1 547 cm-1处(5)出现典型的酰胺I 峰(σC=O)、酰胺II 峰(σN-H+υC-N),而在1 249 cm-1处(8)出现的较弱的酰胺III 峰, 可能是被Sepharose 4B 的δO-H吸收峰(7)掩盖。

图2 红外光谱分析Fig. 2 Assay of infrared spectroscopy
2.3 CNBr-Papain-Sepharose 4B 的微球性状描述
CNBr 活化和配基Papain 偶联前后琼脂糖凝胶介质 (Sepharose 4B、CNBr-Sepharose 4B 和CNBr-Papain-Sepharose 4B) 的微粒性状照片见图3。Sepharose 4B 的粒径在实验过程中始终介于100~200 μm 之间,无明显变化,且表面光滑,说明活化和偶联的整个过程对凝胶介质的性能没有明显影响,这对于提高选择性分离具有积极意义[22]。 因此,推测本实验所制备的亲和层析填料符合实际应用的要求。


图 3 Sepharose 4B、CNBr -Sepharose 4B 和 CNBr -Papain-Sepharose 4B 在显微镜下的形态Fig. 3 Microscopic graphs of Sepharose 4B, CNBr -Sepharose 4B and CNBr-Papain-Sepharose 4B
2.4 Papain 偶联密度及Cystatin 吸附性能测定
2.4.1 C18 RP-HPLC 测Papain 及重组Cystatin 质量浓度绘制标准曲线 不同质量浓度的Papain 及重组Cystatin 进行C18 RP-HPLC 色谱柱绘制标准曲线见图4-5。 Papain 蛋白质标准曲线的线性方程为y=2.052 8x+1.252 5 (R2=0.990 2), 重组Cystatin蛋白质标准曲线的线性方程为:y=2.085 4x+1.139 7(R2=0.991 2)

图4 C18 RP-HPLC 的Papain 标准曲线Fig. 4 Standard curve of Papain of C18 RP-HPLC

图5 C18 RP-HPLC 的重组Cystatin 标准曲线Fig. 5 Standard curve of recombinant Cystatin of C18 RP-HPLC
2.4.2 Papain 偶联密度及Cystatin 吸附性能测定各Papain 添加量组、Papain 偶联量及相对偶联率值以及相应组别的亲和填料对Cystatin 的吸附量和相对吸附率见表1。

表1 Papain 偶联密度及Cystatin 吸附性能测定Table 1 Determination of coupling density of Papain and adsorption performance of Cystatin
随着Papain 的添加量的增加, 每克CNBr-Sepharose 4B 对Papain 的偶联量随之增加。 在各组吸附性能测定中, 前三组亲和填料对Cystatin 的吸附量与Papain 的偶联量成正相关,第四组亲和填料对Cystatin 的吸附量为21.26 mg/g,为最大吸附量,同时达到了最大相对吸附率 (100%)。 此后随着Papain 偶联量增大, 亲和填料对Cystatin 的吸附量反而下降。 因此,每克CNBr-Sepharose 4B 加入7 mL Papain(5 mg/mL),即配体与配基的料液比为1∶7(g∶mL)时,偶联制备的亲和填料CNBr-Papain-Sepharose 4B 对Cystatin 的相对吸附率最佳,即每克活化的CNBr-Sepharose 4B 对Papain 的偶联量为32.17 mg, 此时的填料对Cystatin 表现为最大吸附量21.26 mg。
2.5 CNBr-Papain-Sepharose 4B 的热稳定性
CNBr-Papain-Sepharose 4B 的热稳定性测定结果见图6。 在4~40 ℃的温度范围内,填料的Papain残留结合率及对重组Cystatin 的吸附率均为100%,说明此时制备的亲和填料稳定性高。 50 ℃时,两指标均开始出现下降趋势,并且此后随着温度的升高而迅速降低,证明已偶联上的Papain 会随着温度的升高而脱落, 进而Cystatin 的吸附性能也会因其受到影响。 因此,本实验所制备的亲和填料最理想的操作温度为4~40 ℃。
配基Papain 作为一种蛋白质, 其在50 ℃以下时稳定性较好,更高的温度会导致其活性下降[23],这也可能是该亲和填料在50 ℃时,Papain 结合率下降的原因之一。 同时,以蛋白质为配基的亲和填料,其可操作温度通常处于4~40 ℃之间, 本实验制备的CNBr-Papain-Sepharose 4B 亲和层析填料的热稳定性结果说明其在实际应用中可行。 此外,拟用该亲和层析填料纯化的鱼源Cystatin 是具有半胱氨酸蛋白酶抑制作用的活性蛋白,其纯化的过程需要保持4 ℃低温条件[24],而本实验中制备的亲和填料在4 ℃下性能非常稳定,恰好符合该类蛋白质层析操作的温度要求。
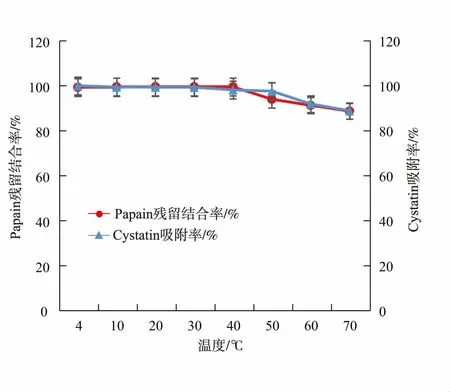
图6 CNBr-Papain-Sepharose 4B 的热稳定性Fig. 6 Thermal stability of CNBr-Papain-Sepharose 4B
2.6 CNBr-Papain-Sepharose 4B 的酸碱稳定性
CNBr-Papain-Sepharose 4B 的酸碱稳定性测定结果见图7。 在pH 3.0~12.0 之间,Papain 的残留结合率很高,均在95.7%以上,且对Cystatin 的吸附率在85.0%以上, 说明在此pH 范围内制备的亲和填料比较稳定;而在pH 2.0 极酸和pH 13.0 极碱的条件下, 亲和填料的配基Papain 不稳定, 易脱落,对Cystatin 的吸附率极显著降低; 另一方面, 在pH 6.0~8.0 之间, 亲和填料Papain 的残留结合率和对Cystatin 的吸附率均最高,接近100%。 因此,本研究制备的亲和填料在pH 3.0~12.0 之间稳定, 最理想的保存及使用pH 为6.0~8.0。

图7 CNBr-Papain-Sepharose 4B 的pH 稳定性Fig. 7 pH stability of CNBr-Papain-Sepharose 4B
对于大部分蛋白质而言,pH 6.0~8.0 是较为温和适宜的pH 环境,此外,在层析纯化过程中,洗脱缓冲液的pH 值偏离目的蛋白质等电点pI 0.5 单位时, 会更好地维持目的蛋白质的稳定性。 大部分Cystatin 的等电点也在pH 6.0~8.0 附近, 如鲢鱼Cystatin 的等电点pI 为6.5[25],三疣梭子蟹(Portunus trituberculatus)PtCystatin 的等电点pI 为5.24[26]。 因此进行鱼源Cystatin 纯化时,所用适宜的pH 值条件都基本处于pH 6.0~8.0 之间,而此时制备的亲和填料最稳定,对Cystatin 的有效吸附性能最高,意味在实际应用过程中, 该填料会更有利于目的Cystatin类蛋白的纯化,分离效果更高效。
而鱼源Cystatin 种类较多,来源广泛,个别鱼源Cystatin 是酸性蛋白或碱性蛋白, 如斑狼鳚(spotted wolffish)Cystatin 的等电点pI 为3.6[27];从中华鲟(Acipenser sinensis) 中提取得到的Cystatin C 的等电点pI 为9.3[28-29]。 因此在层析纯化过程中,洗脱缓冲液的pH 值变化可能较大。 该自制亲和填料在pH 3~12 范围内具有稳定性, 证明其对于鱼源Cystatin 有较好的适用性。 此外,以Sepharose 做为介质的层析填料在再生或者在位清洗时常会用到较为激烈的碱性环境, 如使用0.1 mol/L NaOH(pH 12.0 左右)作为清洗溶液,而该填料具有较好的酸碱稳定性,证明其可以进行短时间的在位清洗和再生,具有现实可操作性。
2.7 CNBr-Papain-Sepharose 4B 的贮藏稳定性
不同贮藏时间内制备的亲和填料CNBr-Papain-Sepharose 4B 的稳定性测定结果见图8。 由图可知,CNBr-Papain-Sepharose 4B 在4 ℃初始贮藏点时,其Papain 的残余结合率及其对Cystatin 的吸附率均为100%,但随着贮藏时间的延长,两指标呈现降低趋势;2 个月内非常稳定,4 个月时,其Papain 的残余结合率仍在92%以上;贮藏6 个月之后, 其Papain 的残余结合率有所降低, 仍保持在80%以上, 但此时对Cystatin 的吸附率明显降低为64.95%。
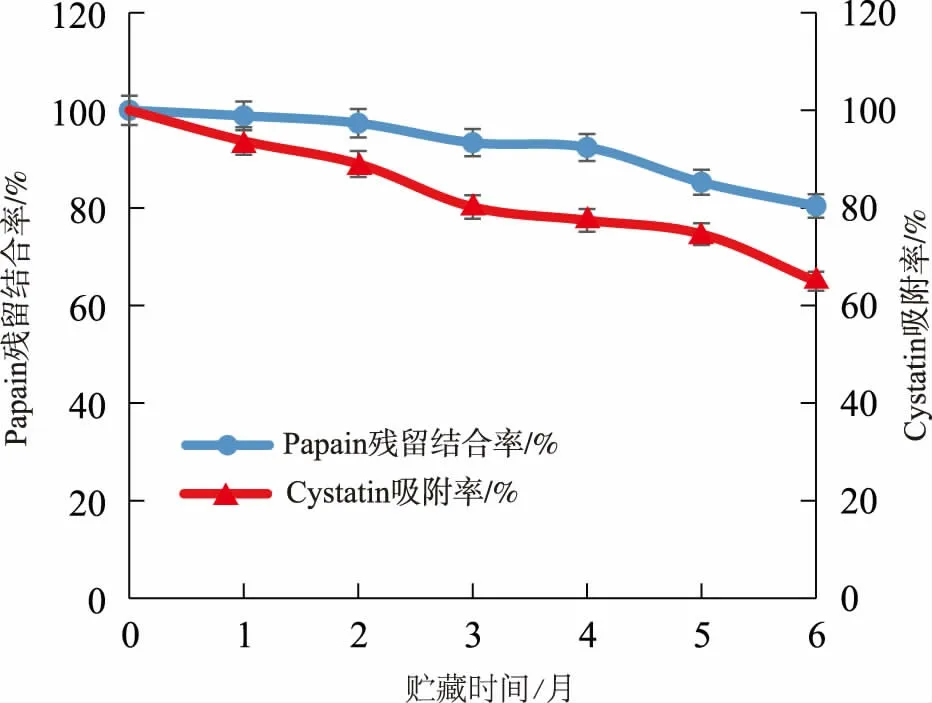
图8 CNBr-Papain-Sepharose 4B 的贮藏稳定性Fig. 8 Storage stability of CNBr-Papain-Sepharose 4B
实验制备的CNBr-Papain-Sepharose 4B 亲和填料在6 个月的贮藏期内, 保持了大部分的稳定性。 其在6 个月时对Cystatin 吸附率降低的主要原因应该是与本实验中采用的贮藏溶液有关。 通常商业化产品的保存液为适宜pH 条件下的含有体积分数20%或30%乙醇的缓冲溶液,而本实验所用的贮藏溶液为超纯水,并不有利于维持配基蛋白Papain的稳定性。 由此可以推测,改进贮藏溶液的成分将会进一步提高该亲和填料的贮藏稳定性。 本团队将在后期实验中进一步、更全面地优化填料的贮藏条件,提高贮藏性能。
2.8 CNBr-Papain-Sepharose 4B 的使用重复性
CNBr-Papain-Sepharose 4B 的使用重复性见表2。 从表2 可以看出,填料对Cystatain 的吸附率很稳定,在连续3 次使用时均维持在95%以上,证明填料的重复性能较好。 使用重复性测定时, 填料对Cystatin 的吸附量均低于2.4.2 中所测得的Cystatin最大吸附量, 主要是因为2.4.2 在测定吸附性能时采用了静态吸附载量法,而1.2.2 中(10)采用动态吸附载量法,更接近实际的层析操作过程。 然而由于存在动态的吸附、解吸平衡及一定的样品漏出率(通常允许在5%以内), 所以实验测得的动态吸附载量和吸附率均比静态吸附时要低些, 是正常的。尽管本实验制备的填料使用重复性比较稳定,但是任何填料的有效重复使用次数都受多种因素的影响,例如柱的种类、样品性质、填料保存和再生方法、层析操作细节习惯以及纯化的要求,因此不可能永久再生。 本实验制备的填料也是具有一定的使用寿命,探究该填料的各项性能,对合理使用填料、延长使用寿命都有指导意义。

表2 CNBr-Papain-Sepharose 4B 的重复使用性Table 2 Reusability of CNBr-Papain-Sepharose 4B
2.9 鲢鱼鱼糜漂洗水中CPIs 的CNBr-Papain-Sepharose 4B 亲和层析
鲢鱼鱼糜漂洗水中CPIs 的CNBr-Papain-Sepharose 4B 亲和层析图见图9。 可以看出,CPIs 浓缩粗提液经CNBr-Papain-Sepharose 4B 亲和层析后, 于吸光度A280处监测到3 个明显的独立蛋白质峰(峰I,峰II 和峰III)。 其中经Buffer A 洗脱下大量杂蛋白质, 即峰I, 伴随有少量的活性损失;经Buffer B 洗脱下的非特异性结合蛋白质峰II 没有呈现出Papain 抑制活性; 而经BufferC 洗脱液梯度洗脱后, 主要在洗脱液比例升至58%时得到峰III,该峰A280蛋白质峰值最低, 而Papain 抑制活性最高,说明其具有明显的Papain 抑制比活性,证明CNBr-Papain-Sepharose 4B 填料成功地实现了鲢鱼鱼糜漂洗水CPIs 的高效回收纯化。

图9 鲢鱼鱼糜漂洗水中CPIs 的CNBr-Papain-Sepharose 4B 亲和层析图Fig. 9 CNBr-Papain-Sepharose 4Baffinity chromatography of CPIs from silver carpsurimi rinse water
3 结 语
利用溴化氢活化法对sepharose 4B 进行活化并将其与Papain 偶联制得亲和填料CNBr-Papain-Sepharose 4B。 通过结构表征, 综合220 nm 及280 nm 紫外吸收峰、氰伸缩振动(σC≡N)的特征吸收峰(2 210 cm-1) 以及典型的酰胺峰 (1 672、1 547、1 249 cm-1),可靠地证实了Sepharose 4B 被CNBr 活化,且Papain 偶联成功。
利用重组鲢鱼Cystatin 的吸附率为指标来筛选活化的琼脂糖介质对Papain 适宜的偶联密度并测定亲和填料的稳定性。 结果表明,CNBr-Speharose 4B 和Papain 最 佳 料 液 比 为1 ∶7 (g ∶mL),CNBr-Papain-Sepharose 4B 在4~40 ℃下热稳定性最高,pH 6.0~8.0 之间CNBr-Papain-Sepharose 4B 最稳定,pH 3.0~12.0 之间仍具有较高的可操作性。 在4 ℃下以超纯水作为贮藏溶液, 制备的填料在6 个月内保持80%以上的Papain 残留结合率及65%以上的Cystatin 吸附率。连续重复使用3 次后,填料对目的蛋白质的吸附率均保持在95%以上,具有较好的重复性。最后,制备的CNBr-Papain-Sepharose 4B亲和填料成功高效地回收了鲢鱼鱼糜漂洗水中的CPIs。
