IRE1对重症急性胰腺炎大鼠淋巴细胞凋亡的作用研究
2021-05-13宋嗣恩覃月秋黄赞松周喜汉
宋嗣恩,覃月秋,黄赞松,周喜汉
(1. 右江民族医学院研究生学院,广西 百色 533000;2.右江民族医学院附属医院消化内科,广西 百色 533000)
重症急性胰腺炎(severe acute pancreatitis,SAP)是消化内科常见的急危重症,约占急性胰腺炎(acute pancreatitis,AP)20%,该病起病凶险、并发症多、治疗费用高、预后差、病死率高[1-2]。临床上SAP的早期表现为全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),晚期常因继发感染导致多器官功能障碍(multiple organ dysfunction,MODS)。有研究发现淋巴细胞凋亡异常导致机体免疫失衡是SAP患者继发感染及脓毒症的重要原因[3],但其分子机制尚不清楚。最近研究发现肌醇需求酶1(inositol requiring enzyme 1,IRE1)参与了细胞凋亡的调节[4],而IRE1是否参与SAP淋巴细胞凋亡的调节文献报道较少。为明确IRE1在大鼠SAP淋巴细胞凋亡中的作用,本研究应用逆行胰胆管注射牛磺胆酸钠诱导SD大鼠SAP动物模型,RT-qPCR检测脾脏淋巴细胞IRE1 mRNA、Caspase-3 mRNA的表达情况,流式细胞术检测淋巴细胞凋亡,初步探讨IRE1对SAP大鼠脾淋巴细胞凋亡的作用,为阐明SAP机体免疫失衡机制,寻找干预和治疗SAP新靶点,提供可靠的理论依据。
1 材料与方法
1.1 材料 20只体重控制在250~300 g的成年SD大鼠,牛磺胆酸钠(美国Sigma);大鼠淀粉酶和脂肪酶测定试剂盒(北京冬歌博业生物科技有限公司) ;总RNA提取试剂盒(上海闪晶分子生物科技有限公司);Fastking RT Kit(上海闪晶分子生物科技有限公司); SYBR Green(上海闪晶分子生物科技有限公司);PCR引物IRE1、 Caspase-3合成(上海捷倍思基因技术有限公司);Anti- IRE1抗体、Anti-Caspase-3抗体(默克生命科学);紫外分光光度计;罗氏LightCycler96实时荧光定量PCR仪。
1.2 方法
1.2.1 动物分组 采用随机数字表法将20只大鼠随机分为假手术组(SO组)、SAP组,每组10只。SO组大鼠仅开腹翻动胰腺后关腹,SAP组大鼠在胰胆管逆行注射5%牛磺胆酸钠0.1 ml/100 g构建SAP模型[5]。
1.2.2 胰腺组织病理学及评分 按照Schmidt评分细则及方法[6],胰腺组织石蜡包埋,超薄切片机切成4微米/片,HE染色后,采用双盲法,转显微镜下由两名病理医生进行阅片评分,随机选取5个400×视野/片,进行观察以下4种病理状态:①水肿(edema);②出血(hemorrhage);③坏死(necrosis);④炎症浸润(inflammatory infiltration),这4种病理状态作为病理损伤严重程度评分的参考依据,逐一进行评分,并做好记录。
1.2.3 淀粉酶和脂肪酶检测方法 按照大鼠淀粉酶和脂肪酶检测试剂盒说明书进行检测。
1.2.4 脾脏淋巴细胞分离 研磨脾脏组织,制备脾脏组织单细胞悬液,加1×PBS或1640无血清培养液3 ml按照1∶1 比例稀释;混匀,37℃水浴中平衡,吸取脾脏组织单细胞悬液至淋巴细胞分离液液面上,置于20℃,2000 r/min水平离心机离心20 min,吸取乳白色淋巴细胞层,加入15 ml离心管中,然后加入细胞洗涤液10 ml,混匀细胞,离心10 min(转速1500 r/min),倒掉上清液,重复操作本步骤一次。将重悬的细胞转移到平皿中, 5%CO2培养箱中设定温度37℃,进行培养60 min,待单核细胞贴壁后,收集所需的淋巴细胞悬液。
1.2.5 RT-qPCR检测 IRE1 mRNA、Caspase-3 mRNA表达内参β-actin引物序列:F5′-GGGAATGGGTCAGAAGGACT-3′,R5′-CTTCTCCATGTCGTCCCAGT-3′。IRE1序列:F5′-GGACTGCCTGGGTCTTTGAT-3′,R5′-TGTGGGGTCAAACGCCTATT-3′。Caspase-3序列:F5′-CTAGCTCCTAGTCTCTGCTCCC-3′,R5′-TCCGTCCCCAATACGTGTCGAATGCA-3′。按照操作说明书,分别提取各组脾脏组织的总RNA,采用紫外分光光度计检测OD260、OD280其浓度。抽取2 μg总RNA采用逆转录法合成cDNA,将其存入-80℃冰箱。采用SYBR Green扩增cDNA,并使用PCR仪检测。以β-actin分析IRE1和Caspase-3的mRNA表达水平。每组设3个复孔进行对照,利用2-△△CT法计算IRE1及 Caspase-3的mRNA相对表达量。
1.2.6 流式细胞术检测淋巴细胞凋亡 分离好的淋巴细胞悬液,采用低温PBS重复洗涤细胞,细胞用1×Binding Buffer调为1×106/ml,吸取100 μl淋巴细胞悬液转移至5 ml流式管中,各加入5 μl PI 和5 μl AnnexinV-FITC,缓慢混匀细胞悬液,孵育(条件为:室温25℃,避光15 min),将400 μl 1×Binding Buffer加入每个流式管,上机检测。

2 结果
2.1 大鼠胰腺病理评分 SO组胰腺腺泡结构清晰,无明显水肿,偶有炎性细胞浸润;SAP组胰腺腺泡高度水肿,出现腺泡结构的破坏,可见间质内的红细胞渗出和出血、坏死,血管损伤或血栓形成, 间质水肿,间隔模糊变宽,炎症反应明显,可见脂肪坏死,导管扩张,腺泡细胞萎缩。按照Schmidt评分细则,SAP组与SO组比较,胰腺病理组织学评分显著性增加,见表1。

表1 大鼠胰腺病理组织损伤评分
2.2 大鼠的血清淀粉酶和脂肪酶水平 SAP组中大鼠的血清淀粉酶和脂肪酶水平含量均显著升高,与SO组相比,差异有统计学意义(P<0.001),见表2。

表2 大鼠的血清淀粉酶和脂肪酶水平含量 单位:U/L
2.3 大鼠脾脏淋巴细胞IRE1、Caspase-3 mRNA相对表达量 SO组大鼠脾脏淋巴细胞中IRE1 、Caspase-3 mRNA相对表达量呈低表达,SAP组大鼠中IRE1 mRNA相对表达量显著升高,与SO组相比,差异有统计学意义(P<0.05),见图1。
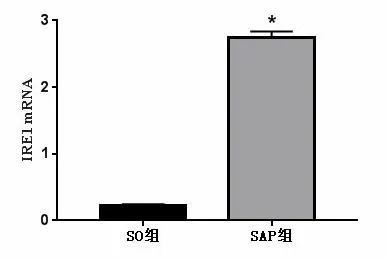
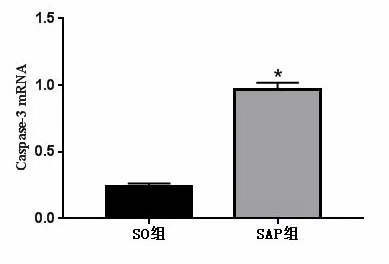
注:与SO组相比较,*:P<0.05。
2.4 流式细胞术检测大鼠脾淋巴细胞凋亡情况 使用二维散点图表示大鼠脾淋巴细胞凋亡率,以Annexin-V FITC为横坐标,PI为纵坐标,以阴性对照、PI单染管和FITC单染管设定界限,把淋巴细胞分成:正常活细胞(左下象限Q4,Annexin-V FITC-、PI-);早期凋亡细胞(右下象限Q3,Annexin-V FITC+、PI-);死亡细胞(右上象限Q2,Annexin-V FITC+、PI+)。SAP组脾淋巴细胞凋亡率与SO组比较,脾淋巴细胞凋亡率升高(P<0.001),见表3、图2。

表3 实验大鼠脾血淋巴细胞凋亡率
2.5 SAP大鼠脾淋巴细胞中IRE1与Caspase-3 mRNA相对表达量相关分析 SAP组中脾脏淋巴细胞IRE1 mRNA与脾脏淋巴细胞Caspase-3 mRNA相对表达量呈正相关(r=0.884,P<0.05),提示脾脏淋巴细胞IRE1 mRNA表达增高,脾脏淋巴细胞Caspase-3 mRNA水平随之上升,见图3。
2.6 SAP大鼠脾淋巴细胞中IRE1 mRNA表达与凋亡率的相关分析 SAP组中脾脏淋巴细胞IRE1 mRNA与脾脏淋巴细胞凋亡率呈正相关(r=0.875,P<0.05),显示脾淋巴细胞中IRE1表达的增高,脾脏淋巴细胞凋亡率升高,见图4。
3 讨论
SAP是由胰腺的局部炎症引发严重的全身多器官损害的疾病,它主要以致命的MODS和SIRS为特征[7]。尽管临床上大部分的SAP患者能够得到及时诊断和必要的治疗,但治疗手段和方法的选择仍然十分有限[8]。目前,SAP仍然是一个高发病率和死亡率的消化系统疾病,据统计仅在欧洲SAP患者死亡率甚至高达44%[9]。AP首先从无菌的局部炎症开始,诱发SIRS,然后是代偿性抗炎反应综合征(compensatory anti-inflammatory response syndrome,CARS),有相关研究表明在SAP小鼠中SIRS和CARS可并行发展[10],最终导致机体免疫抑制。SAP初期始于胰腺组织的局部炎症,可导致多种胰腺外器官功能障碍的发生,然而,潜在的机制仍不清楚[11]。研究表明淋巴细胞大量凋亡导致SAP患者淋巴细胞亚群减少,是影响机体产生免疫抑制的重要因素[5,12]。我们采用流式细胞术检测SAP大鼠脾淋巴细胞凋亡率,结果发现SAP淋巴细胞凋亡率增高,与前人的研究结果一致[13-14],提示机体免疫功能受损。

SO组
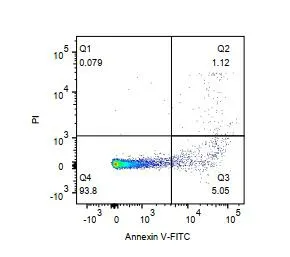
SAP组
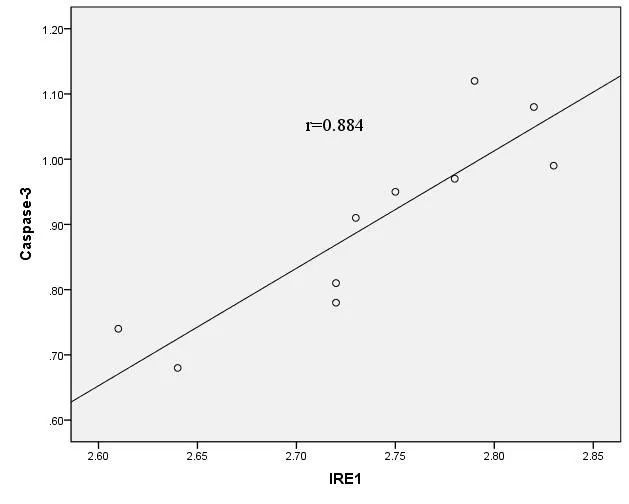
图3 SAP大鼠脾淋巴细胞中IRE1与Caspase-3mRNA表达水平的相关性
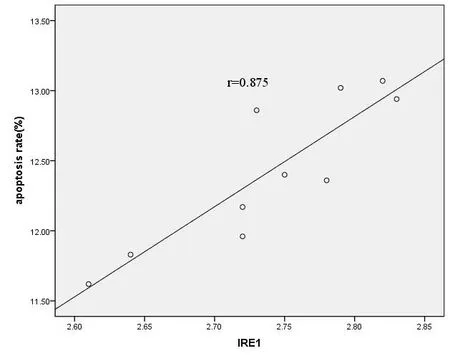
图4 SAP大鼠脾淋巴细胞中IRE1与凋亡率的相关性
内质网应激(endoplasmic reticulum stress,ERS)是新近研究发现的调控细胞凋亡的信号转导通路[15]。细胞应激是AP等胰腺疾病发生的先决条件,当细胞受到刺激时,内质网发生紊乱,且堆积着大量的错误/未折叠蛋白质,引发未折叠蛋白反应(UPR)以保持内质网稳态。但持续性内质网应激可诱发炎症,严重时可致细胞凋亡,且与AP的细胞凋亡存在显著关系[16]。越来越多的证据表明ERS是损伤胰腺腺泡细胞的早期反应,是AP的发病机制之一[15]。
IRE1内质网应激信号途径,是启动的触发UPR的最保守的途径[17]。有文献报道AP通过IRE1通路激活胰腺的ERS,IRE1、 XBP1 mRNA和蛋白水平显著升高[4],而ERS可能通过胰腺腺泡细胞凋亡导致实质损伤[18]。IRE1α内切酶是ERS的关键调控因子,控制着肿瘤细胞的存活和凋亡。抑制IRE1α内切酶可导致剪接XBP1的减少,从而降低癌细胞的增殖,增加细胞的死亡[19]。通过抑制自适应的UPR反应信号通路,IRE1还激活内质网应激通路,促进细胞死亡和胰腺炎[20]。我们研究发现SAP大鼠脾淋巴细胞IRE1表达明显升高,提示SAP时内质网IRE1途径激活,IRE1可能参与SAP的发病,这与Jia G等[21]在其他动物身上的研究结论相符,但是否与淋巴细胞凋亡相关尚不明确,因此我们进一步检测了脾淋巴细胞Caspase-3表达,并进行了相关研究。
为明确IRE1与SAP淋巴细胞凋亡的关系,我们做了IRE1与Caspase-3表达及淋巴细胞凋亡率相关性分析,结果显示SAP组中脾脏淋巴细胞中IRE1 mRNA表达增高,同时脾脏淋巴细胞Caspase-3 mRNA水平及淋巴细胞凋亡率亦升高。进一步分析发现,脾脏淋巴细胞IRE1 mRNA表达水平与Caspase-3 mRNA表达水平呈正相关,IRE1 mRNA与淋巴细胞凋亡率呈正相关。综合以上分析, IRE1高表达,有可能是在SAP中导致淋巴细胞凋亡增加的重要原因。淋巴细胞是一种重要的炎性细胞,其表达水平通常代表着炎症水平的高低。在SO组中,淋巴细胞的比例低,凋亡水平低,正说明了SO组中淋巴细胞处于一个良性的循环中。相反,淋巴细胞在SAP组中的高表达与高凋亡,说明了淋巴细胞的生成与因抗炎所致的凋亡,处于一个高速的循环之中。由于淋巴细胞能分泌诸多炎性因子,炎性因子在SAP患者体内的蓄积,可导致“炎症风暴”的产生,这是胰腺炎患者死亡最常见的原因之一[22-23]。因此通过调控IRE1的表达,干预淋巴细胞的凋亡,减少炎症因子的释放可能是SAP的一个新的治疗思路。
