FDFT1基因重组慢病毒表达载体的构建及其表达测定
2021-05-13陈晓颖易雪丽陆飞燕曾怡
陈晓颖,易雪丽,,陆飞燕,曾怡
(1. 右江民族医学院附属医院,广西 百色 533000;2. 右江民族医学院病原微生物学与免疫学教研室,广西 百色 533000)
法尼基二磷酸法尼基转移酶1(farnesyl diphosphate farnesyl transferase 1,FDFT1) ,又称鲨烯合成酶,是一种分子量为47 kDa的酶,由416个氨基酸组成。人类FDFT1启动子包含两个固醇调节元件(sterol regulatory element,SRE)SRE-1基序、一个倒置的SRE-3 (inverse SRE-3,Inv SRE-3)和一个核转录因子Y(nuclear factor,NF-Y),是SRE结合蛋白(binding protein,BP)SREBPs的结合位点。这三个SREBP结合位点已经被证实与甾醇介导的FDFT1启动子的调控有关[1]。SREBPs以转录因子形式参与胆固醇生物合成途径的许多基因的转录。SREBP2是FDFT1的关键转录因子之一。SREBP2位于内质网膜上,当SREBP2被激活后进入细胞核,与FDFT1启动子中的SRE区域结合,激活FDFT1进入转录过程。FDFT1是胆固醇合成途径的第一个酶,通过两阶段反应合成角鲨烯。两个焦磷酸法尼酯(farnesyl pyrophosphate,FPP)分子先聚合形成前角鲨烯二磷酸(pre-squalene diphosphate,PSDP), PSDP再被NADPH还原,生成角鲨烯[2],角鲨烯通过氧化、还原等多步骤转化为胆固醇。有研究结果表明胆固醇代谢异常与癌症的发生有关[3],因此,与胆固醇代谢相关的酶和相关的生物分子被认为可能是抗肿瘤治疗的靶点[4],靶向胆固醇代谢治疗方法备受重视。FDFT1在胆固醇合成调节中起重要作用,因在肺癌、髓系白血病、乳腺癌等肿瘤中高表达[5]而备受关注。本实验通过构建FDFT1基因重组慢病毒表达载体,为进一步探索FDFT1基因在肿瘤中的作用机制。
1 材料与方法
1.1 材料 包膜质粒pMD2.G、包装质粒psPAX2、pCDH-GFP质粒载体为南京医科大学卢春教授馈赠。PCR引物、PrimeScriptTMII 1st Strand cDNA Synthesis Kit、PCR试剂盒、DL 2,000 DNA Marker、 DL 10,000 DNA Marker、DL 15,000 DNA Marker、DNA切胶回收试剂盒、real-time PCR (qPCR)试剂盒为Takara生物公司(大连)产品;内切酶XbaⅠ、BamHⅠ购自NEB公司;质粒小量提取试剂盒、EasyGeno重组试剂盒、DH5α感受态细胞为北京天根生化科技有限公司产品;胎牛血清、DMEM购自Gibco公司; Trizol试剂为卓一生物技术有限公司(南宁)产品;lipofectamine2000购自Invitrogen公司。293T细胞株为本实验室保存。
1.2 方法
1.2.1 FDFT1基因片段的扩增 根据NCBI登记的FDFT1基因序列设计PCR引物,由Takara生物公司合成,引物序列如下:
FDFT1-上游引物(FDFT1-F):GGACCGCAGAGGTGAGAGTCGC
FDFT1-下游引物(FDFT1-R):TTCCTAAAGGTCCCAGCCACAC
以293T细胞cDNA为模板,普通PCR进行扩增,得到FDFT1基因全长片段。50 μl PCR反应体系包括模板1 μl,TaKaRa LA Taq 0.5 μl,2× GC Buffer 25 μl,dNTP Mixture 8 μl,上游引物0.5 μl,下游引物0.5 μl,ddH2O 14.5 μl。PCR反应条件如下:94℃预变性3 min;94℃变性30 s、60℃退火30 s、72℃延伸150 s,共进行35个循环;之后72℃加长延伸5 min。PCR产物经琼脂糖凝胶电泳确定扩增阳性后,-20℃保存。
设计FDFT1基因PCR引物,在上下游加入与pCDH-GFP载体同源序列(“”部分)及XbaⅠ、BamHⅠ限制性酶切位点(单下划线斜体部分),并在上游引物起始密码子前增加KOZAK序列(“”部分)增强目的基因表达,在下游引物终止密码子前增加V5标签蛋白编码序列(双下划线斜体部分)。引物序列如下:
FDFT1-重组上游引物(FDFT1-重组F):5′-CCTCCATAGAAGATTCTAGAGCCACCATGGAG
TTCGTGAAATGCCTTGGCCACCCCGAAGAGTT
CTACAACCTGGTGCGCTTC-3′
FDFT1-重组下游引物(FDFT1-重组R):5′-TCCTTCGCGGCCGCGGATCCTTACGTAGAATCGAG
ACCGAGGAGAGGGTTAGGGATAGGCTTACCATGTTCTCCAGTCTGAACATAG-3′
以前述FDFT1基因PCR扩增产物为模板再次扩增,反应体系及反应条件同前述,使FDFT1基因片段上下游分别带有与载体互补序列及限制性酶切位点。纯化扩增产物。测定DNA浓度,-20℃保存备用。
1.2.2 pCDH-GFP线性化载体的制备 用限制性内切酶XbaⅠ、BamHⅠ酶切pCDH-GFP载体。双酶切反应体系如下:pCDH-GFP质粒载体1 μg,XbaⅠ 1 μl,BamHⅠ 1 μl,Cutsmart Buffer 5 μl,ddH2O补足50 μl;双酶切条件:37℃ 水浴15 min;65℃水浴20 min。回收酶切后的pCDH-GFP载体,并测定其浓度。纯化的pCDH-GFP线性化载体-20℃保存备用。
1.2.3 FDFT1基因重组质粒的构建及鉴定 将线性化载体与目的基因通过同源重组反应连接。10 μl反应体系如下:线性化载体0.01 pmol,插入片段0.05 pmol,2×EasyGeno Assembly Mix 5 μl,以ddH2O补足10 μl;反应条件如下:50℃反应15 min,迅速冰上冷却5 min。将上述反应液进行转化,转化体系如下:50 μl DH5α感受态细胞;5 μl上述重组产物。转化条件如下:冰浴30 min;42℃热激90 s后冰浴150 s;加入350 μl的 LB液体培养基37℃ 180 r/min摇45 min。取100 μl转化液涂布于事先配好的含氨苄青霉素(Amp)的LB固体平板,37℃ 180 r/min倒置培养16~18 h。挑取单菌落接种至分装好的Amp抗性的LB液体培养瓶并标记,37℃ 180 r/min振荡培养60 min。取1 μl菌液进行菌落PCR鉴定,PCR反应体系及条件同1.2.1。将菌落PCR阳性的菌液继续培养至16 h后提取质粒。将提取质粒进行双酶切验证,双酶切体系及条件同1.2.2。对菌落PCR、双酶切均符合的质粒(命名为pCDH-GFP-FDFT1)进行序列测定(广州艾基生物有限公司)。根据实验需要将序列比对正确的质粒进行批量提取,-20℃保存备用。
1.2.4 FDFT1慢病毒的包装 用胰酶消化293T细胞,离心弃上清后用10%FBS的完培将细胞调整为1×105cells/ml,取2 ml接种至6孔板中,37℃、5% CO2培养24 h。转染前吸弃上清用预冷PBS洗细胞2次并尽量吸净,并用无血清DMEM润洗1次备用。将提取的pCDH-GFP-FDFT1、pCDH-GFP分别与包装质粒psPAX2 和包膜质粒pMD2.G 利用lipofectamine2000共转染293T细胞。转染8 h后给细胞换液,培养至48 h后观察荧光蛋白GFP表达情况并收集上清4℃保存。加入新鲜完培继续培养24 h后观察荧光蛋白GFP表达情况并收集上清。将48 h和72 h的上清混合离心后用0.45 μm滤器过滤,分装病毒液,-80℃保存。
1.2.5 FDFT1慢病毒的表达测定 按照实验所需将293T细胞用10%FBS的完培调整为1×105细胞/孔,接种至6孔板,37℃、5% CO2培养24 h。将实验所需的病毒液置于冰上并在4℃融化备用。感染前用预冷PBS洗细胞2次并尽可能吸干净,随机分组并标记,对应加入200 μl的FDFT1病毒液(FDFT1-VIR)及阴性对照病毒液(Ctrl-VIR),用无血清的DMEM补足2 ml。感染8 h后以10%的完全培养基给细胞换液。96 h观察荧光蛋白GFP表达,并用Trizol试剂分别提取细胞RNA,以PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit逆转录为cDNA后进行qPCR,运用相对定量法比较两组样本FDFT1表达情况。

2 结果
2.1 FDFT1目的基因的扩增 以FDFT1-F、FDFT1-R为引物,普通PCR从人全基因组cDNA中扩增FDFT1全长基因并进行琼脂糖核酸电泳,电泳结果显示在约1200 bp处出现单一条带,与实验预期的FDFT1目的条带1254 bp基本一致,见图1。以该FDFT1 PCR产物为模板,以FDFT1-重组F、FDFT1-重组R引物再次进行PCR扩增,使FDFT1两端加入载体同源序列及限制性酶切位点,经琼脂糖核酸电泳,结果显示在约1300 bp处出现目的条带,与预期的1342 bp基本一致(图片未显示)。切胶回收纯化带载体同源序列的FDFT1 PCR扩增产物,得到浓度为23.30 ng/μl的FDFT1目的基因DNA。

注:M:DL2,000 DNA Marker;1:FDFT1全基因组片段扩增产物。
2.2 pCDH-GFP线性化载体制备 用限制性内切酶酶切pCDH-GFP质粒,酶切后进行电泳验证酶切情况。如图2所示,在约7500 bp处呈现单一条带(预期条带为7544 bp),说明线性化载体制备成功。切胶回收酶切后pCDH-GFP载体,得到浓度为19.04 ng/μl的线性载体DNA。
2.3 FDFT1基因重组质粒的构建及鉴定 利用同源重组技术将FDFT1目的基因片段连接到载体上,经转化涂布接种含Amp的LB平板,培养16~18 h后挑2个阳性克隆,分别转种至含Amp抗性的LB液体培养瓶。1 h后取菌液进行菌落PCR鉴定,如图3所示,只有2号菌落在约1200 bp处出现条带。培养至16~18 h,提取菌落PCR阳性菌液的质粒。质粒进行双酶切验证,如图4所示,酶切后的质粒出现两条条带,在约1300 bp及7500 bp处,说明目的基因重组成功。将菌落PCR、双酶切验证均符合的重组质粒进行测序(广州艾基生物有限公司),测序结果显示重组质粒含有目的序列,与GenBank中登记的FDFT1(NM_004462)基因同源,表明FDFT1基因重组质粒连接成功。

注:M:DL15,000 DNA Marker;1:pCDH-GFP质粒双酶切产物。

注:M:DL2,000 DNA Marker;1:1号菌落PCR扩增产物;2:2号菌落PCR扩增产物。
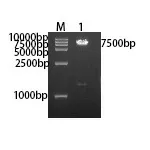
注:M:DL15,000 DNA Marker;1:pCDH-GFP-FDFT1质粒双酶切产物。
2.4 FDFT1慢病毒包装 转染48 h后利用荧光显微镜观察荧光蛋白GFP表达。如图5所示,pCDH-GFP组及pCDH-GFP-FDFT1组均可看到绿色荧光,表明构建的质粒成功转染293T细胞。

图5 荧光显微镜观察三质粒共转染48 h的293T细胞(×100)
2.5 FDFT1慢病毒表达测定 同体积的Ctrl-VIR及FDFT1-VIR分别感染293T细胞96 h后,两组均有绿色荧光表达,表明包装的病毒颗粒成功感染293T细胞。分别提取细胞总RNA,以逆转录试剂进行逆转录为cDNA,利用qPCR检测FDFT1表达,结果如表1所示,两组间差异有统计学意义(P<0.001),FDFT1-VIR组相对Ctrl-VIR组上调15.13倍。

表1 FDFT1慢病毒感染293T细胞后FDFT1表达水平
3 讨论
胆固醇是构成细胞质膜的重要部分,是维持细胞内稳态的必要脂质。胆固醇稳态[6]是一个复杂的调控过程,它在胆固醇的合成、酯化、代谢和运输中起作用。近年来胆固醇生物合成的变化被认为是多种癌症[7]的标志。当癌细胞快速增殖时,它们依赖于升高的胆固醇生物合成来提供足够的胆固醇,以满足膜生物生成和能量稳态及类固醇激素合成。胆固醇也可以通过脂质筏间接的发挥促癌作用,通过富胆固醇的脂筏[8]来传导肿瘤细胞的增殖、迁移和生存信号。也有研究发现,胆固醇通过在TME中富集的胆固醇酯和氧甾醇等衍生物来调节其对肿瘤进展的影响[9]。FDFT1即法尼基二磷酸法尼基转移酶1是一种膜结合酶,位于染色体8p.22-23.1区[10],参与胆固醇合成分支的调节。FDFT1可能作为癌症的潜在靶点在癌症的治疗中发挥作用[11]。Hughes SJ等[12]通过Northern blot分析和免疫组化分析发现在8p22-23区的FDFT1 mRNA过表达,在食管腺癌中表达增加。但Weng ML等[13]研究发现在结直肠癌中FDFT1表达较低,FDFT1作为抑癌基因通过负性调控AKT/mTOR/HIF1α信号通路来实现肿瘤抑制功能。FDFT1既作为一种致癌基因又是一种抑制基因与癌症密切相关,目前关于这种差异产生的原因的研究还很少。这种差异可能不仅是由于FDFT1表达的变化,而且是由于癌症中各种胆固醇代谢物如何导致不同反应的差异,这也可能是TME对FDFT1表现出不同反应的结果。关于FDFT1影响癌症特征的作用有很多报道,然而,关于与FDFT1相互作用的分子的研究却很少。虽然已经有很多关于FDFT1抑制剂的研究,但大多数研究都集中在降低血液胆固醇上,似乎还需要更多的研究将其用作抗癌药物。我们期望能够通过构建FDFT1慢病毒稳转株以研究FDFT1在各种肿瘤的发生发展中的相关机制,为癌症的治疗提供依据。
传统的脂质体转染方法存在一定的弊端,不适用于转染效率不高的细胞,慢病毒载体虽然操作复杂,但从理论上讲病毒颗粒能感染所有细胞,并能将外源基因整合到宿主染色体上,可以获得稳定表达的细胞株,比传统的脂质体转染发更具优势[14]。腺病毒载体虽然病毒滴度高,且易于转染其他细胞,但仍不能克服表达沉默的自身缺陷[15]。慢病毒载体是以病原体HIV-1 为基础发展起来的基因治疗载体,该载体可以将外源基因随机插入宿主基因组,具有持久性表达,感染效率高、安全性高和免疫原性低等优势[16]。虽然与其他载体相比,慢病毒载体更胜一筹,但其生物安全性方面的局限性是我们所关注的。近年来,研究者们也主要着力于改进其基因结构,从而增加慢病毒载体的生物安全性[17]。在本实验中,我们通过包装产生的病毒为“自杀”性病毒,病毒在感染靶细胞后不会产生新的病毒颗粒,也不会再去感染其他细胞。本实验成功构建FDFT1慢病毒载体,经转染后获得的病毒液能感染293T细胞,并表达FDFT1基因。本文结果为进一步研究FDFT1基因在肿瘤中的作用机制提供了实验基础。
