热射病高病死率临床分析
2021-05-10张璐刘健
张璐 刘健
【摘要】 目的:探讨热射病高病死率的相关因素。方法:回顾性分析2017年6月-2019年8月收入本院重症监护病房(ICU)诊断为热射病的14例患者的资料,排除1例,共计13例,记录生命体征、实验室检查、治疗及转归。结果:13例患者入院时格拉斯哥评分(GCS)均为3分,体温(40.385±1.169)℃,APACHEⅡ分值为(35.270±8.162)分。入院前,两组血小板计数比较,差异无统计学意义(P>0.05);入院后第1天,两组血小板计数均低于入院前,且死亡组血小板计数低于存活组,差异均有统计学意义(P<0.05)。6例存活,7例死亡,治愈率46.15%(6/13),死亡率53.85%(7/13)。结论:血小板的进行性减低与热射病高病死率相关,通过对血小板的动态监测可以评估预后,提高对热射病的认识,早期识别和恰当处置对改善预后有帮助。
【关键词】 热射病 病死率 血小板计数 APACHEⅡ
[Abstract] Objective: To explore the correlative factors of high mortality of heat stroke. Method: Retrospective analysis was performed on the data of 14 patients admitted to the intensive care unit (ICU) of our hospital from June 2017 to August 2019 who were diagnosed with heat stroke. One patient was excluded, a total of 13 patients, and vital signs, laboratory examination, treatment and outcome were recorded. Result: 13 patients on admission score (GCS), Glasgow were three points, temperature (40.385±1.169) ℃, APACHE Ⅱ score was (35.270±8.162). Before admission, there was no significant difference in platelet count between the two groups (P>0.05). On the first day after admission, platelet count in both groups were lower than those before admission, and platelet count in the death group was lower than that in the survival group, with statistically significant differences (P<0.05). Six patients survived and seven died, with a cure rate of 46.15% (6/13) and a mortality rate of 53.85% (7/13). Conclusion: The progressive decrease of platelets is associated with high mortality from heat stroke, the dynamic monitoring of platelets can be used to evaluate the prognosis and improve the understanding of heat stroke, early recognition and appropriate treatment are helpful to improve the prognosis.
[Key words] Heat stroke Mortality Platelet count APACHE Ⅱ
熱射病是严重威胁人类健康的一类急性症候群,机制不清、治疗无特异性、病死率和致残率高,部分医护人员对其认识尚存在不足而导致了诊疗的延误[1]。随着全球变暖气温升高,极端气候增加使得热射病的发病率在温带地区徒增并导致不良结果[2]。本文病例来自华北地区三甲医院,研究分析临床病例特点及预后相关因素,探讨热射病的诊断和治疗进展,旨在提高广大临床医生的重视改善热射病预后。现报道如下。
1 资料与方法
1.1 一般资料 选择于2017年6月-2019年8月收入本院重症监护病房(ICU)诊断为热射病的患者共14例,纳入标准:诊断符合中国热射病诊断与治疗专家共识(以下简称《共识》)诊断标准[3],包括(1)病史信息①暴露于高温、高湿环境;②高强度运动。(2)临床表现①中枢神经系统功能障碍表现(如昏迷、抽搐、谵妄、行为异常等);②核心温度超过40 ℃;③多器官(≥2个)功能损伤表现(肝脏、肾脏、横纹肌、胃肠等);④严重凝血功能障碍或DIC。(3)不能用其他原因解释。同时满足(1)中的任意一条、(2)中的任意一条和(3)即可诊断。排除标准:自动出院无法随访者。排除1例,共计13例。13例患者中男10例(76.92%),女3例(23.08%);年龄50~89岁,平均(69.150±12.838)岁,入院时平均体温(40.385±1.169)℃;同时患有1种及以上基础疾病者6例,包括高血压病3例,心脏病2例,慢性阻塞性肺疾病2例,糖尿病2例,脑血管病1例,脑萎缩1例。APACHEⅡ分值26~45分,平均(35.270±8.162)分。入院时均为昏迷,GCS评分3分。本研究已经伦理学委员会批准。
1.2 研究方法 回顾性分析13例患者,依据患者临床转归分为存活组6例(6/13)和死亡组7例(7/13),按照热射病的分类分为经典型和劳力型,记录患者的一般资料、生命体征、病情变化、治疗和预后的相关数据进行统计学研究分析。
1.3 统计学处理 采用SPSS 19.0软件对所得数据进行统计分析,正态分布计量资料(x±s)表示,非正态分布计量资料用M(P25,P75)表示,比较采用非参数检验U检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 存活组男5例,女1例;年龄50~87岁,平均(69.330±13.706)岁。死亡组男5例,女2例;年龄53~89岁,平均(69.000±13.153)岁。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
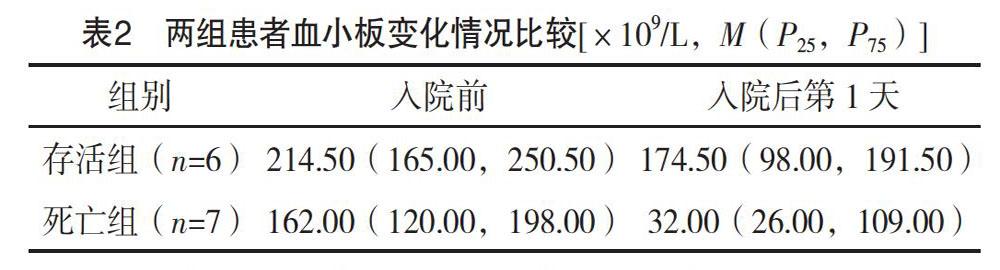
2.2 两组患者病情变化及治疗 患者入院后11例出现血小板降低,9例凝血时间延长,11例血浆肌钙蛋白升高,10例患者肾功能异常,13例患者出现肝功能异常。全部患者给予冰毯物理降温,8例出现休克给予血管活性药(去甲肾上腺素和多巴胺),11例患者呼吸衰竭给予经口气管插管并机械通气治疗,9例给予冰冻血浆及4例患者给予血小板替代治疗。见表1。
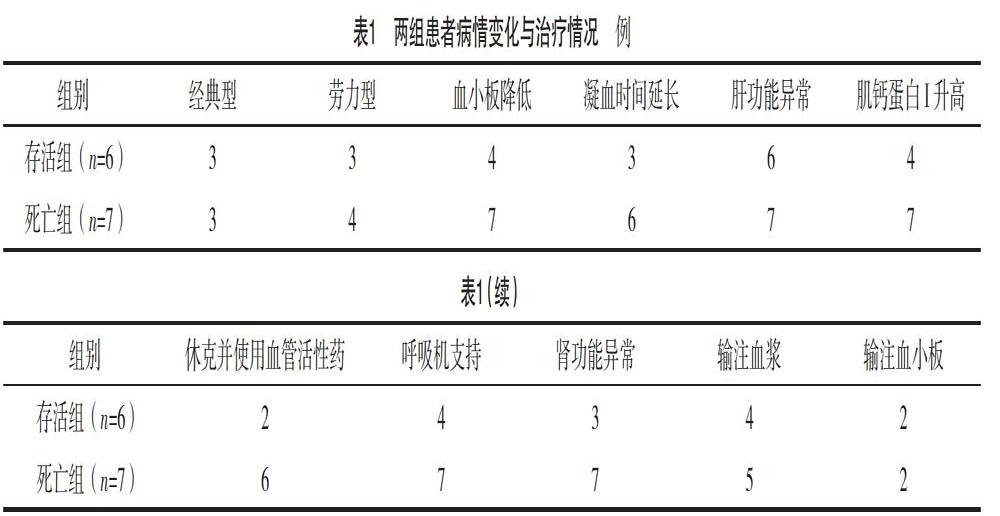
2.3 两组患者血小板变化情况比较 入院前,两组血小板计数比较,差异无统计学意义(P=0.086);入院后第1天,两组血小板计数均低于入院前(P存活组=0.046,P死亡组=0.018),且死亡组血小板计数低于存活组,差异均有统计学意义(P=0.012)。见表2。
2.4 患者转归情况 平均住院时间7.00(1.58,19.00)d(小于1 d者2例),好轉出院6例,死亡7例,治愈率46.15%(6/13),死亡率53.85%(7/13)。
3 讨论
热射病是指暴露于热环境、剧烈运动所致的机体产热与散热失衡,以核心温度升高>40 ℃和中枢神经系统异常为特征,如精神状态改变、抽搐或昏迷,并伴有多器官损害的危及生命的临床综合征[3],被认为是一种与全身炎症反应相关的高热,导致以脑病为主的多器官功能障碍综合征[4],是一种理化因素所致的急危重症。
3.1 气候特点和环境暴露 国务院新闻办公室发布的中国气象局《中国气候公报》(2017-2019)显示,2018-2019年,全国平均气温较常年偏高0.5~0.79 ℃,夏季高温日数较常年同期偏多[5]。天津位于华北平原东部,夏季受西北太平洋副热带高压西侧影响七月最热。天津市气象局官网数据分析提示,2017年6-7月最高气温达39.6 ℃,高温天气(35 ℃以上)累计21 d,2018年同期最高气温40.5 ℃,高温天气累计23 d,2019年同期最高气温39.7 ℃,高温天气累计17 d。文献[6]报道日本2018年登记的热相关疾病人数是2017年的两倍。极端天气是热射病流行病学的重要因素之一。本研究纳入连续三年同一医院ICU中收治的诊断为热射病的患者12例发病于7月,1例于8月初,且2018年病例数明显增多(7例),提示各地区在极端天气到来前和过程中,应加强宣教、提高重视,做到早期预防,方可事半功倍[7]。
王立军等[8]研究报道,2017年7月天津市21所医院(5所二级医院和16所三级医院)上报的473例中暑患者中,热射病59例(12.47%),其中劳力型31例,占热射病总数的52.54%;非劳力型28例(47.46%),死亡患者26例,热射病病死率为44.07%。60岁及以上中暑死亡患者41例(56.16%)。室外建筑工人、农民仍是发生中暑的主要人群。国外资料显示,经典型热射病在夏季热浪期间人群的发病率为(1.76~2.65)/万,住院病患者病死率为14%~65%,合并低血压的劳力型热射病病死率>30%,而ICU患者病死率>60%[9-11]。本研究中热射病患者13例(劳力型7例),死亡7例(劳力型4例),60岁以上患者10例,而劳力型热射病患者7例均为农民工在工作中发病,这一特征与文献相符。
3.2 病理生理改变机制的研究 热射病的主要发病机制是从一个可补偿的体温调节期过渡到一个不可补偿期,此时心输出量不足以应付高体温调节需要,因此核心体温持续升高,导致直接细胞毒性作用和炎症反应,形成恶性循环,最终导致多器官衰竭。许多热射病的老年患者在发病后1~3 d内住院或死亡,并且老年人死亡率超过50%。尸检研究表明,中暑后终末器官衰竭的主要原因是热诱导坏死和凋亡细胞死亡,伴有广泛的微血栓形成、出血和炎症损伤,多器官系统功能障碍和衰竭(劳累性中暑比典型中暑更明显)可能在24~48 h内达到高峰[4]。
类脓毒症的炎症反应学说。中暑相关的炎症反应类似于全身炎症反应综合征(SIRS)。有人认为SIRS是由循环信使RNA介导的,它触发细胞因子和高迁移率族蛋白B1(HMGB1)的释放,导致白细胞和内皮细胞过度活化。与感染性休克类似,SIRS可导致临床状况迅速恶化,导致弥散性血管内凝血(DIC)、多器官衰竭和死亡[12-14]。
胃肠道完整性和内毒素血症。中暑引起的肠道血流减少导致胃肠道缺血,对细胞活力和细胞壁通透性产生不利影响。由此产生的氧化应激和亚硝化应激损伤细胞膜,打开紧密的细胞间连接,使内毒素和可能的病原体漏入全身循环,抑制肝脏的解毒能力,导致内毒素血症。虽然中暑和内毒素血症之间的联系并不新鲜,但许多医生往往忽略或曲解适用的实验室发现。这会进一步加重中暑患者的临床病情,使预后恶化[15]。
3.3 早期诊断和治疗 早期诊断在很大程度上主要根据病史和临床表现做出,核心温度升高>40 ℃作为诊断的必要条件,但也不能据此而延误热射病的诊断[3]。脓毒症、中风等疾病是重要的鉴别诊断,但有时这些疾病复杂且难以明确[6]。临床上仍缺乏特异性强和精准的手段诊断热射病。目前一些生物化学指标的研究旨在更好的提示器官衰竭、促进准确诊断和及时治疗,包括HMGB1,中性粒细胞明胶酶相关脂蛋白,心肌肌钙蛋白Ⅰ,尿热休克蛋白与尿肌酐的比值,组蛋白,和密码素2肽(一种肠α防御素)[4]。
由于病死率与体温过高及持续时间密切相关,因此,快速、有效、持续降温是首要治疗措施。如果初始降温延迟30 min,即便后期降温达到目标,损害也不会停止,建议现场降温目标核心温度在30 min内迅速降至39.0 ℃以下,2 h内降至38.5 ℃以下。降温方法的选择应因地制宜,蒸发降温、冷水浸泡、冰敷降温和体内降温法。院内有效控温方法有控温毯、血管内热交换降温、连续性血液净化治疗[16]。
及时对热射病患者进行风险评估,早期的气管插管给予气道保护和机械通气可以改善预后。休克患者血管活性药的使用则应尽早,首选去甲肾上腺素,若仍不达标可联合使用肾上腺素,多巴胺可以作为快速心律失常风险低的替代药[17]。对于凝血功能的监测初期需要每4小时一次指导病情稳定,并给予替代治疗。连续性血液净化治疗(CBP)对于热射病患者的治疗中具有重要意义,包括:(1)实现有效的血管内降温,是住院热射病患者最为有效的降温手段之一;(2)对于合并急性肾损伤的重症热射病患者可辅助实现精确容量管理;(3)纠正电解质紊乱和酸中毒,维持内环境稳定;(4)清除致病介质,如CRRT治疗横纹肌溶解症、血浆置换治疗高胆红素血症,减轻继发性损伤[4]。中医大黄能减轻炎症反应,促进热相关急性肝肾损伤的康复而起到辅助治疗的作用。这些潜在的治疗方法处于不同的研究阶段,笔者对中暑的病理生理学和以机制为基础的治疗方法的认识还不完全[4]。本研究中病例未接受CBP治疗是否影响死亡率,需扩大样本量后进一步研究。
对于热射病的与预后相关的评分系统尚需建设。目前使用的是APACHEⅡ、SOFA和JAAM-DIC评分预测医院死亡率,在多变量分析的研究中,GCS和血小板是死亡率的独立预测因子[6]。DIC和凝血異常与热射病患者降温后仍进展恶化有相关意义[18-20]。国内研究报道中部分南方城市ICU收入的热射病患者APACHE Ⅱ评分显示存活组17.50(13.25,22.75),死亡组20.00(17.00,24.75)[21],本研究中纳入的ICU热射病患者APACHEⅡ评分较文献偏高可能与高病死率相关。
综上所述,热射病的高病死率和致残率给人民的健康生活构成了极大的威胁,研究其发病机制,早期诊断和规范化治疗可以改善其预后,尤其在热射病发病率较低的地区,更应该提高重视。未来对于热射病的相关研究可能集中在三个方面:识别发现人应对热应激能力的遗传特征,寻找能更好地预测热射病短期和长期预后的新生物标记物,以及开发能有效控制炎症反应和对抗多器官并发症的治疗手段。
参考文献
[1]张华,范华.对中国急诊医护人员热射病相关知识的调查研究[J].中华现代护理杂志,2019,25(25):3222-3225.
[2] Mahri S A,Bouchama A.Heatstroke[J].Handb Clin Neurol,2018,157:531-545.
[3]全军热射病防治专家组,全军重症医学专业委员会.中国热射病诊断与治疗专家共识[J].解放军医学杂志,2019,44(3):181-196.
[4] Epstein Y,Yanovich R.Heatstroke[J].N Engl J Med,2019,380(25):2449-2459.
[5]速读《2019年中国气候公报》[N].中国气象报,2020-02-28(3).
[6] Lawton E M,Helen P,Gabb G M.Review article: Environmental heatstroke and long-term clinical neurological outcomes: A literature review of case reports and case series 2000-2016[J].Emerg Med Australas,2019,31(2):163-173.
[7]王洪萍,莎宁,秦秀菊,等.热射病的发病学特点及流行病学进展[J].中华危重病急救医学,2015,27(8):702-704.
[8]王力军,寿松涛,柴艳芬,等.2017年天津市成人中暑患者调查分析[J/OL].中华危重症医学杂志(电子版),2018,11(5):347-349.
[9] Misset B,De Jonghe B,Bastuji-Garin S,et al.Mortality of patients with heatstroke admitted to intensive care units during the 2003 heat wave in France: a national multiple-center risk-factor study[J].Crit Care Med,2006,34(4):1087-1092.
[10] Armed Forces Health Surveillance Bureau.Update: Heat illness, active component, U.S. Armed Forces,2016[J].MSMR,2017,24(3):9-13.
[11] Carter R,Cheuvront S N,Williams J O,et al.Epidemiology of hospitalizations and deaths from heat illness in soldiers[J].Med Sci Sports Exerc,2005,37(8):1338-1344.
[12] Rhodes A,Evans L E,Alhazzani W,et al.Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016[J].Intensive Care Medicine,2017,43(3):304-377.
[13] Ganesan S,Reynolds C,Hollinger K,et al.Twelve hours of heat stress induces inflammatory signaling in porcine skeletal muscle[J].Am J Physiol Regul Integr Comp Physiol,2016,310(11)::1288-1296.
[14] Snipe R M J,Khoo A,Kitic C M,et al.The impact of exertional-heat stress on gastrointestinal integrity, gastrointestinal symptoms, systemic endotoxin and cytokine profile[J].Eur J Appl Physiol,2018,118(2):389-400.
[15]梁泳欣,童华生.肠道菌群在重症中暑发病中的作用研究进展[J].解放军医学杂志,2019,44(12):1051-1055.
[16] Hamaya H,Hifumi T,Kawakita K,et al.Successful management of heat stroke associated with multipleorgan dysfunction by active intravascular cooling[J].Am J Emerg Med,2015,33(1):124.e5-124.e7.
[17] Rhodes A,Evans L E,Alhazzani W,et al.Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J].Intensive Care Med,2017,43(3):304-377.
[18]陈昕鸣.脓毒症血流感染患儿血清PLT、CRP、LDH水平与PCIS评分、PRISM评分的关系[J].中国医学创新,2020,17(15):23-27.
[19] Hifumi T,Kondo Y,Shimazaki J,et al.Prognostic significance of disseminated intravascular coagulation in patients with heat stroke in a nationwide registry[J].J Crit Care,2018,44:306-311.
[20] Matsumoto H,Takeba J,Umakoshi K,et al.Successful treatment for disseminated intravascular coagulation (DIC) corresponding to phenotype changes in a heat stroke patient[J].Journal of Intensive Care,2019,7:2.
[21]李亞杰,俞建峰,周仪,等.早期血小板变化对重症中暑患者28d死亡的预测价值[J].天津医药,2020,48(4):279-283.
(收稿日期:2020-09-07) (本文编辑:姬思雨)
