阿帕替尼治疗晚期非小细胞肺癌疗效与安全性的Meta分析
2021-05-10况春丽李明郑泰浩
况春丽,李明,郑泰浩
(重庆医科大学附属永川医院 肿瘤内科,重庆402160)
肺癌是全球发病率及病死率最高、增长速度最快的恶性肿瘤之一,其中非小细胞肺癌(nonsmall cell lung cancer, NSCLC)占80%~85%[1-2]。肺癌早期无明显症状,即使有症状也因其临床表现的非特异性而影响诊断的及时性和准确性,故发现时多数为晚期[3]。目前,对驱动基因阳性的晚期NSCLC 一线治疗为靶向治疗,而对于驱动基因阴性的晚期NSCLC 患者一线治疗可选择含铂两药联合化疗,但较多NSCLC 患者因无法耐受含铂两药联合方案或耐药而更换方案。临床上对一线治疗失败的晚期NSCLC 患者尚无治疗标准[4]。阿帕替尼是我国自主研发的一种小分子酪氨酸激酶抑制剂,对多种实体瘤均有较好的治疗效果,紫杉醇/多西他赛也是临床上常用的紫杉类抗肿瘤药物[5-6]。本研究采用系统评价的方法评估阿帕替尼对比紫杉醇/多西他赛治疗晚期NSCLC 的疗效及安全性,以期为临床用药提供参考。
1 资料与方法
1.1 文献检索
检索时间均从建库至2019年8月,分别于中国知网、维普网及万方数据库检索中文文献,于PubMed、Cochrane Library 检索英文文献。中文检索词包括“阿帕替尼”、“紫杉醇”、“多西紫杉醇”、“多西他赛”、“艾坦”及“晚期非小细胞肺癌”,英文检索词包括“Apatinib”、“paclitaxel”、“docetaxel”及“advanced non-small cell lung cancer”。
1.2 纳入与排除标准
纳入标准:①研究类型为全文发表的随机对照试验,语种限定为中文或英文,纳入研究单组数>20 例;②研究对象病理学诊断为明确的非小细胞肺癌患者,并由影像学或其他相关检查证实为晚期的非小细胞肺癌患者;③干预措施试验组口服阿帕替尼500~850 mg,1 次/d,对照组静脉滴入紫杉醇/多西他赛单药静脉化疗;④疗效相关指标为客观缓解率、疾病控制率,对完全缓解(complete response, CR)、部分缓解(complete response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)进行评价,其中客观缓解率=CR+PR,疾病控制率=CR+PR+SD。同时采用健康状况评分及生活质量评分进行评估,健康状况评分采用卡式(KPS)评分评定,生活质量评分采用健康调查简表(SF-36)进行评定。安全性相关指标包括:骨髓抑制(白细胞减少、血小板减少和贫血),胃肠道不良反应(恶心、呕吐和腹泻)、高血压、蛋白尿、口腔黏膜炎及手足综合征。排除标准:①回顾性研究;②重要信息不完整的研究(如缺失疗效和毒副作用具体数据);③新闻、个案研究及病例报告。
1.3 信息资料提取
由2 名研究人员独立进行文献筛选、数据提取,并对纳入的信息进行交叉核对,若遇分歧通过求助第三方讨论解决,数据提取的内容主要包括:①纳入研究标题、作者、文献出处及发表日期;②试验组和对照组年龄、干预措施及试验实施情况;③研究类型和偏倚风险评估的相关要素;④结局指标及结果。
1.4 文献质量评价
根据Cochrane 国际协作网进行文献质量评价,评价内容包括随机序列的产生、分配隐藏、盲法的实施、退出与失访情况及其他偏倚。见图1。
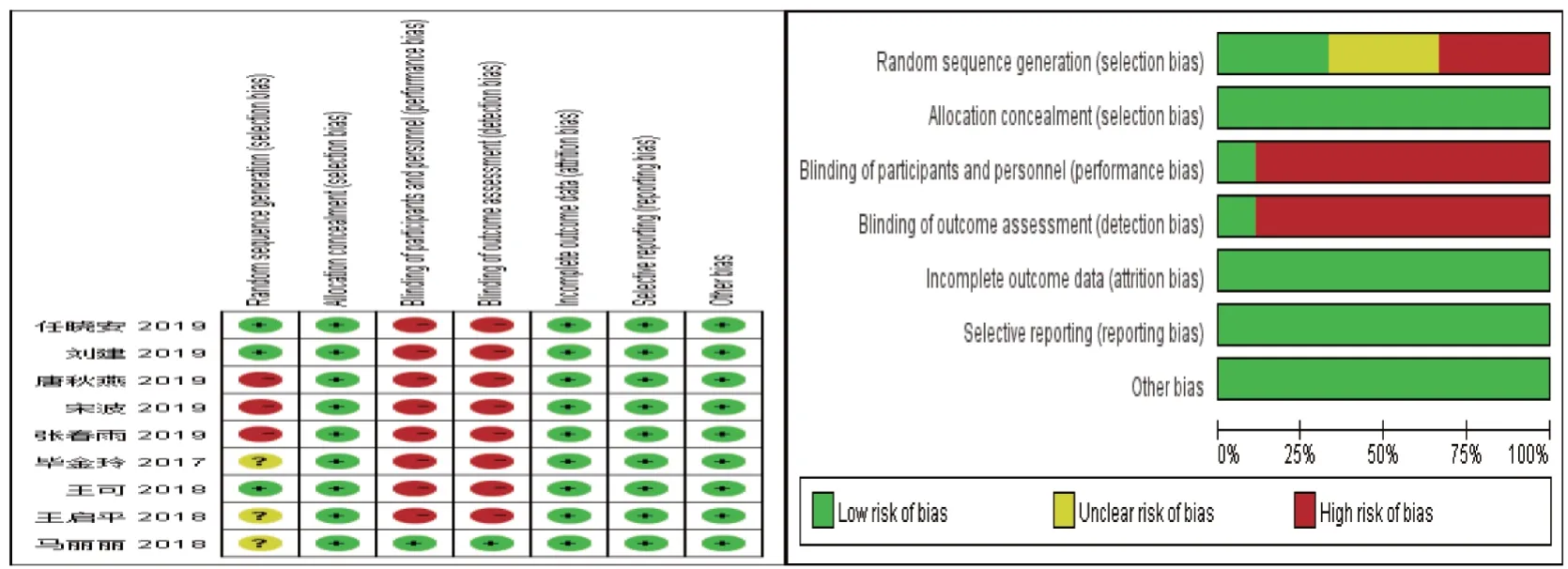
图1 纳入文献质量评价
1.5 统计学方法
采用RevMan 5.3 软件进行Meta 分析。二分类变量采用比值比(odds ratio, OR^)或相对危险度(relative risk, RR) 及其95% CI 作为效应统计量。连续型变量采用均数差及其95% CI 作为效应统计量。比较用卡方检验,同时结合I2值判断异质性大小,统计学同质性较好(P>0.10,I2<50%)的研究采用固定效应模型进行Meta 分析,而有统计学异质性(P≤0.10,I2≥50%)则采用随机效应模型进行Meta 分析。
2 结果
2.1 文献检索结果
根据制定的检索策略对相应的数据库进行检索,通过阅读文献,按纳入与排除标准,最终纳入9 篇文献[7-15],均为随机对照试验,共637 例患者,其中试验组321 例,对照组316 例。见表1和图2。
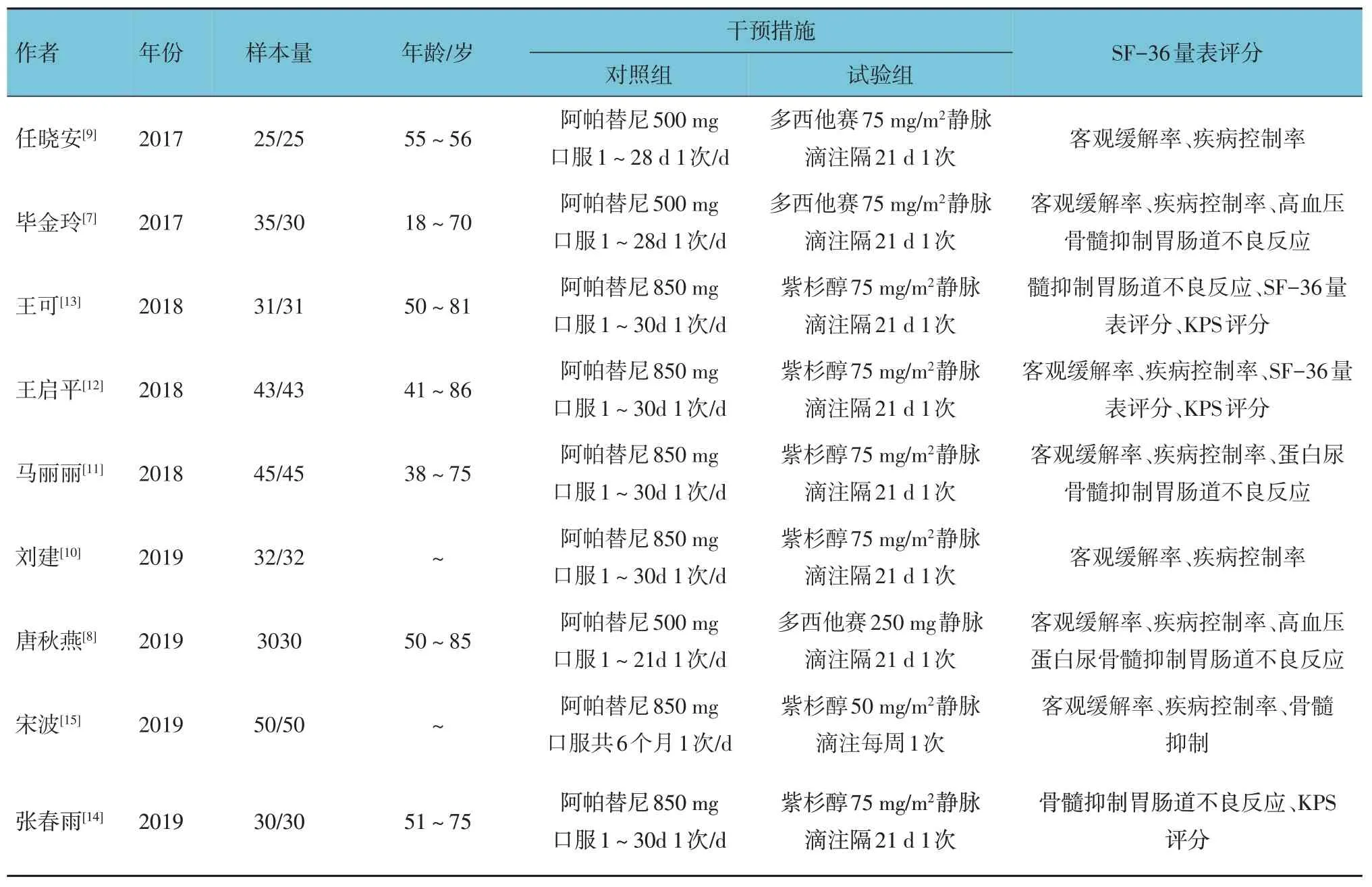
表1 纳入研究的基本特征
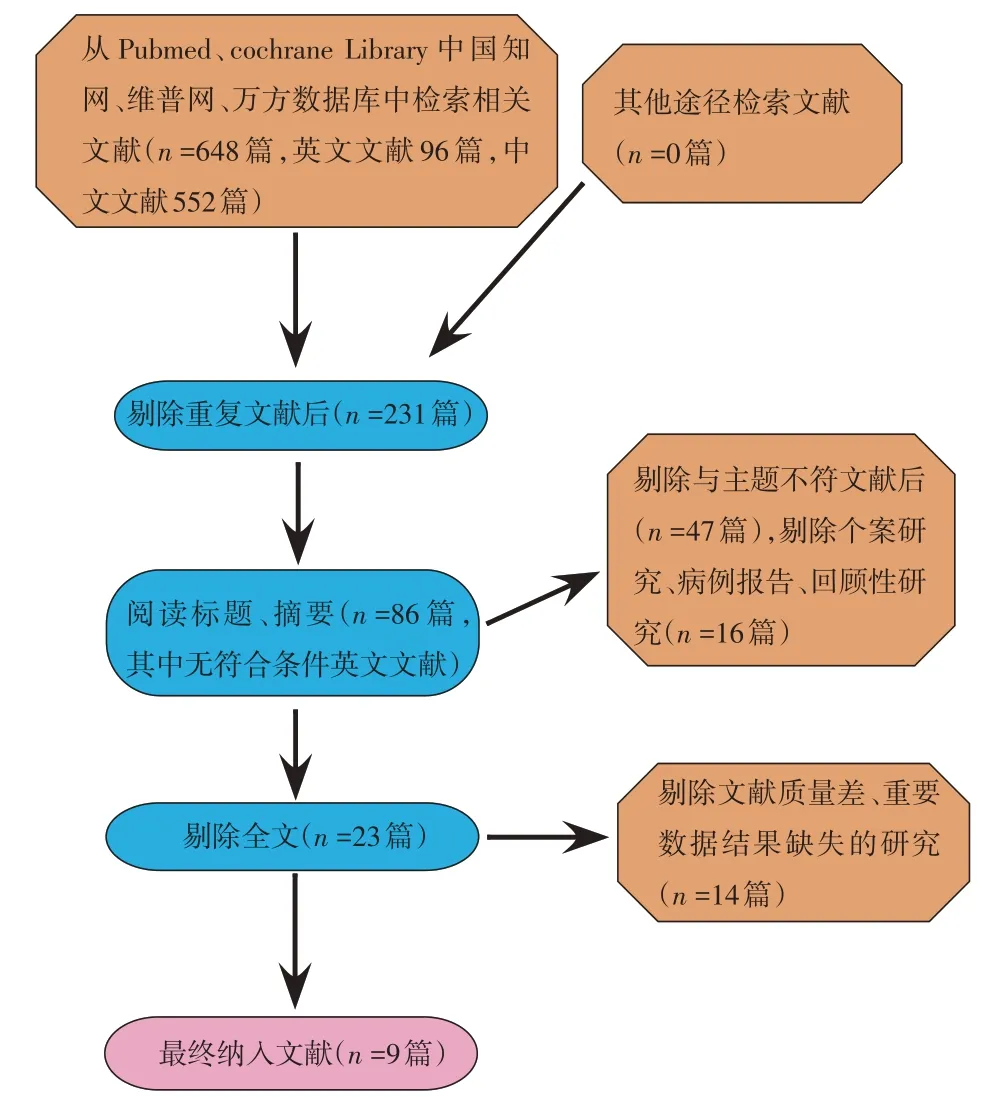
图2 文献筛选流程图
2.2 疗效指标分析
2.2.1 客观缓解率在纳入的9 篇文献中,7 篇文献[7-12,15](试验组260 例,对照组255 例)报道了客观缓解率,合并纳入的7 篇文献,各研究间异质性检验结果为P=0.860,I2=0%。采用固定效应模型,Meta 分析显示,阿帕替尼组客观缓解率高于紫杉醇/多西他赛组[OR^=1.77,(95% CI:1.15,2.72),P=0.009]。见图3。
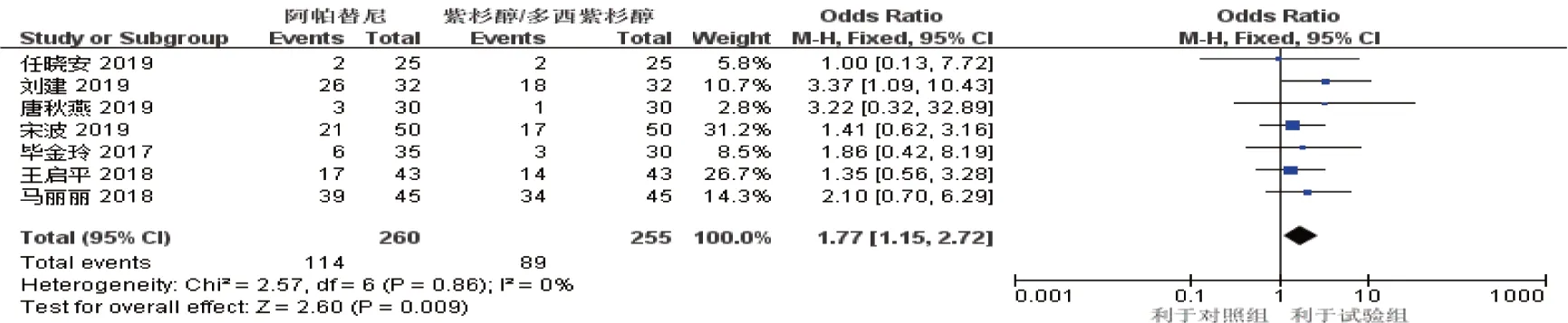
图3 客观缓解率的Meta分析森林图
将4 篇紫杉醇对比阿帕替尼的研究[10-12,15](试验组170 例,对照组170 例)进行亚组分析,结果显示阿帕替尼亚组客观缓解率高于紫杉醇亚组[O R^=1.76,(95% CI=1.10,2.82),P=0.020],3 篇多西他赛对比阿帕替尼的研究[7-9](试验组:90 例,对照组:85 例)行亚组分析,结果显示,差异无统计学意义[OR^=1.80,(95% CI:0.63,5.12),P=0.270]。见图4。
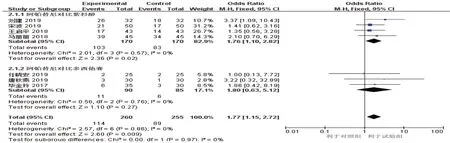
图4 客观缓解率亚组分析的Meta分析森林图
2.2.2 疾病控制率在纳入的9 篇文献中,7 篇文献[7-12,15](试验组260 例,对照组255 例)报道了疾病控制率,合并纳入的7 篇文献,各研究间异质性检验结果为P=0.460,I2=0%。采用固定效应模型,Meta 分析结果显示,阿帕替尼组疾病控制率高于紫杉醇/多西他赛组[OR^=2.15(95% CI:1.42,3.24),P=0.000]。见图5。
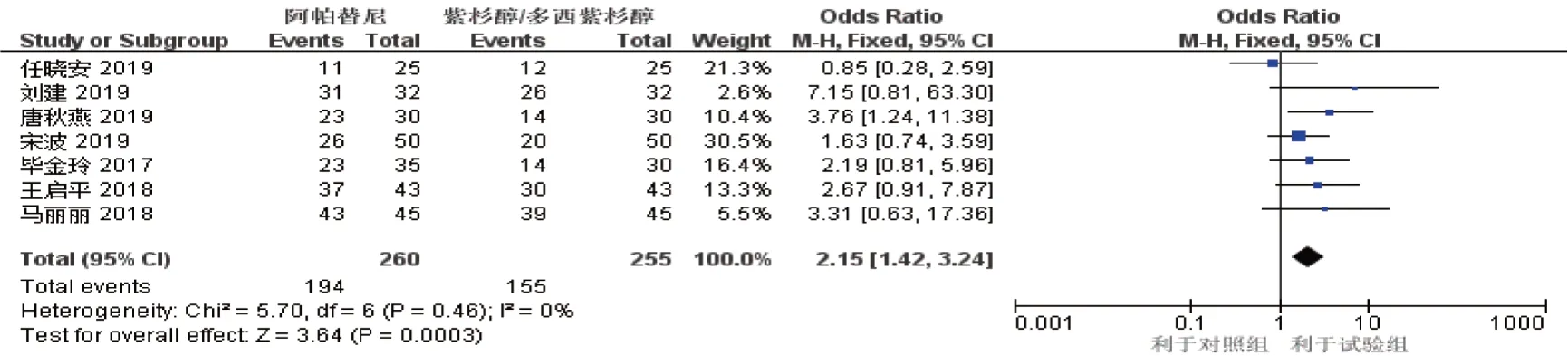
图5 疾病控制率的Meta分析森林图
将4 篇紫杉醇对比阿帕替尼的研究[10-12,15](试验组:170 例,对照组170 例)与3 篇多西他赛对比阿帕替尼的研究[7-9](试验组90 例,对照组85 例)分别进行亚组分析,结果显示,阿帕替尼亚组疾病控制率高于紫杉醇亚组[O R^=2.35 (95% CI:1.34,4.12),P=0.003],阿帕替尼亚组疾病控制率亦高于多西他赛亚组[O R^=1.93 (95% CI=1.06,3.54),P=0.030]。见图6。
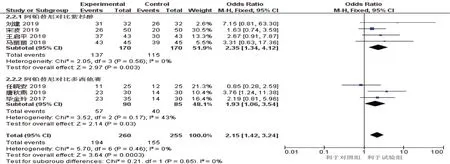
图6 疾病控制率亚组Meta分析森林图
2.2.3 KPS 评分3 项研究[12-14]报道了阿帕替尼组对比紫杉醇组治疗后KPS 评分情况(试验组104 例,对照组104 例),各研究间异质性结果为P=0.000,I2=88%,存在异质性。采用随机效应模型进行Meta 分析结果显示,阿帕替尼组KPS 评分高于紫杉醇组[均数差=6.84 (95% CI:4.84,8.84),P=0.000]。见图7。
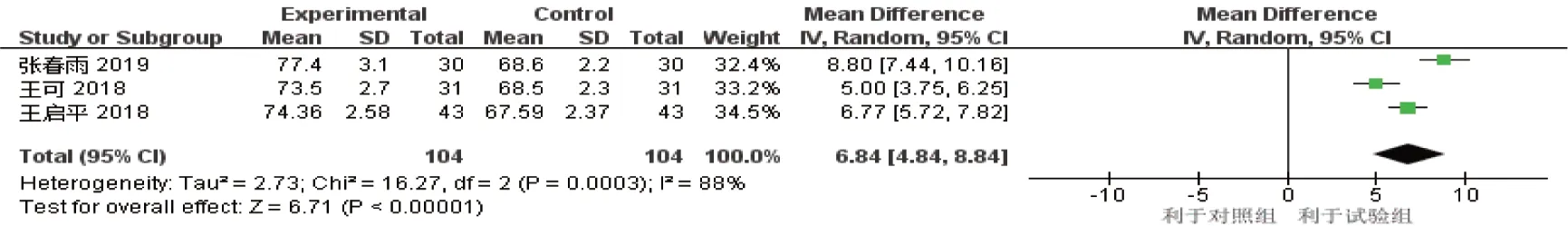
图7 KPS评分Meta分析森林图
2.2.4 SF-36 量表评分2 项研究[12-13]报道了阿帕替尼组对比紫杉醇/多西他赛组治疗后SF-36 量表评分情况(试验组74 例,对照组74 例),各研究间异质性结果为P=0.000,I2=96%,存在异质性。采用随机效应模型进行Meta 分析结果显示,阿帕替尼组SF-36 量表评分高于紫杉醇/多西他赛组[均数差=12.67(95%CI:10.19,15.15),P=0.000]。见图8。
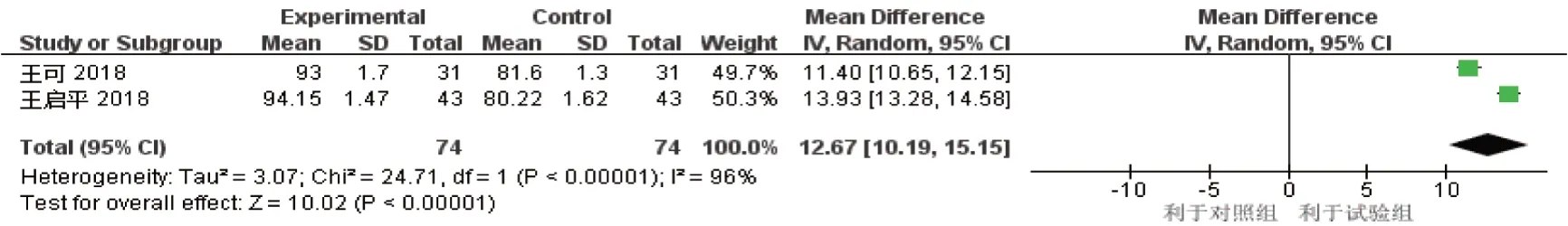
图8 SF-36量表评分Meta分析森林图
2.3 安全性指标分析
2.3.1 骨髓抑制6项研究[7-8,11,13-15](试验组221 例,对照组216 例)报道了不同治疗方案后骨髓抑制发生情况,各研究间异质性检验结果为P=0.150,I2=38%。采用固定效应模型,Meta 分析结果显示,阿帕替尼组骨髓抑制发生情况低于紫杉醇/多西他赛组[RR^=0.39(95% CI:0.26,0.57),P=0.000]。如图9。
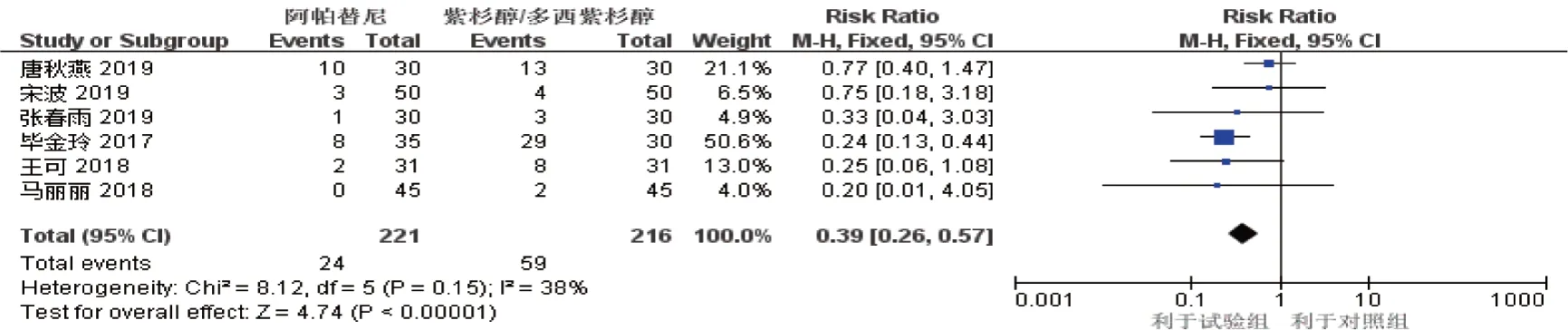
图9 骨髓抑制的Meta分析森林图
2.3.2 胃肠道不良反应6 项研究[7-8,11,13-15](试验组221 例,对照组216 例)报道了不同治疗方案后胃肠道不良反应发生情况,各研究间异质性检验结果为P=0.130,I2=41%,采用固定效应模型,Meta 分析结果显示,阿帕替尼组胃肠道不良反应发生情况低于紫杉醇/多西他赛组[RR^=0.50(95% CI:0.33,0.76),P=0.001]。见图10。
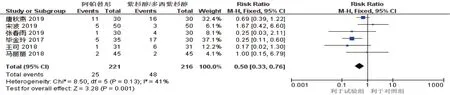
图10 胃肠道不良反应的Meta分析森林图
2.3.3 蛋白尿2 项研究[8,11]报道了蛋白尿的发生情况(试验组75 例,对照组75 例),Meta 分析结果显示,差异无统计学意义(R R^=1.80 (95% CI:0.40,8.05),P=0.440)。见图11。
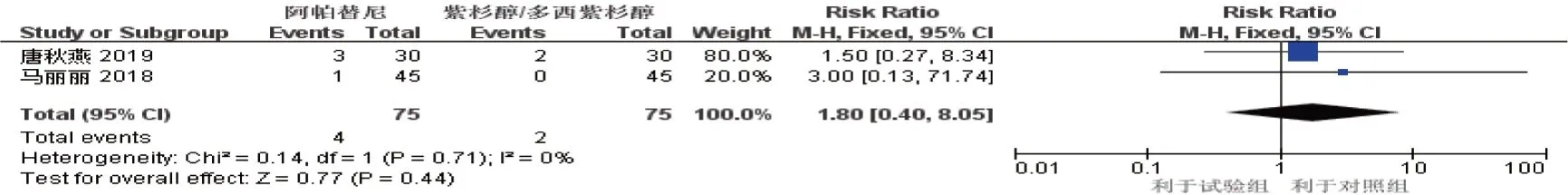
图11 蛋白尿的Meta分析森林图
2.3.4 高血压2 项研究[7-8]报道了高血压的发生情况(试验组65 例,对照组60 例),Meta 分析结果显示,差异无统计学意义[RR^=1.90,(95%CI:0.75,4.78),P=0.170]。见图12。
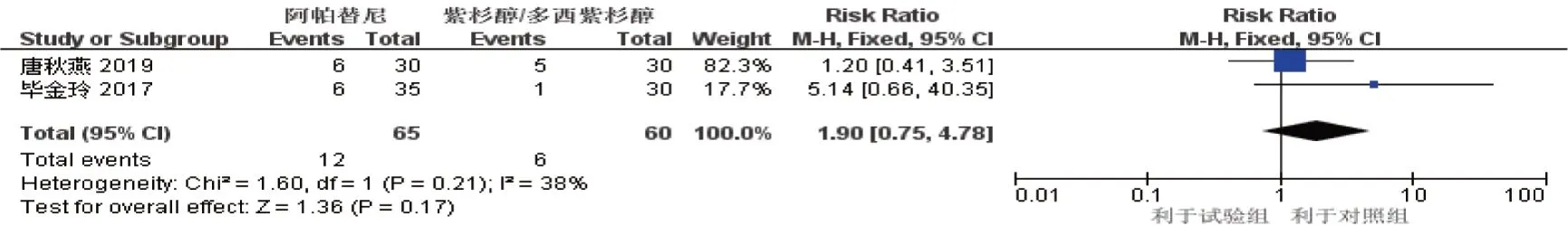
图12 高血压的Meta分析森林图
2.3.5 口腔黏膜炎2项研究[7,15]报道了口腔黏膜炎的发生情况(试验组85 例,对照组80 例),Meta 分析结果显示,差异无统计学意义[RR^=0.98(95% CI:0.40,2.43),P=0.970]。见图13。
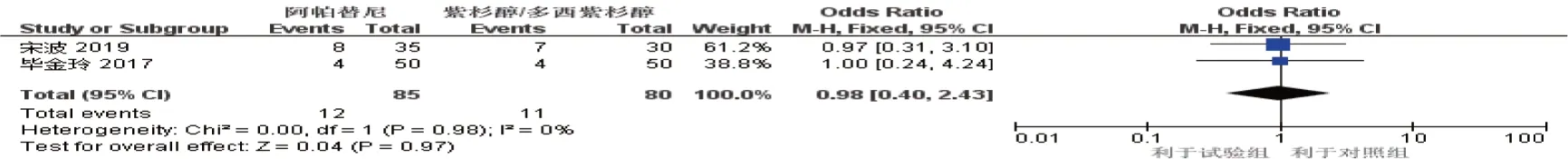
图13 口腔黏膜炎的Meta分析森林图
2.3.6 手足综合征2 项研究[7-8]报道了手足综合征的发生情况(试验组65 例,对照组60 例),Meta 分析结果显示,差异无统计学意义[RR^=0.76(95% CI:0.31,1.89),P=0.560]。见图14。
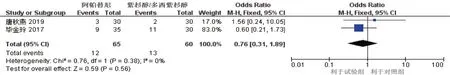
图14 手足综合征的Meta分析森林图
2.4 漏斗图
研究间是否具有发表偏倚采用漏图进行分析。见图15~18。
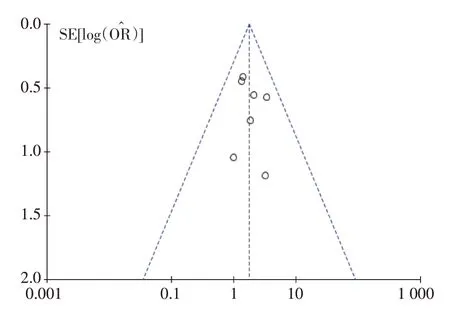
图15 客观缓解率客观缓解率的Meta分析漏斗图
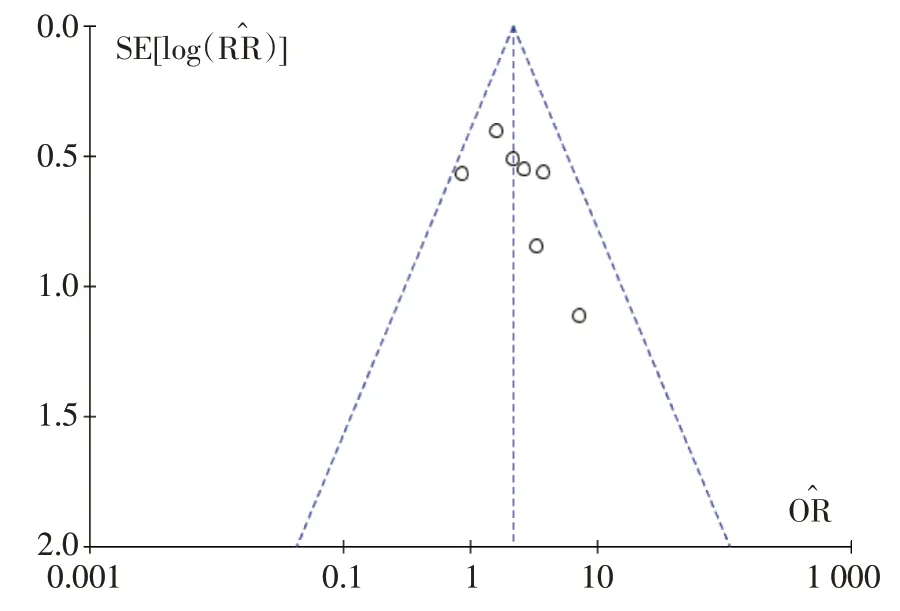
图16 疾病控制率疾病控制率的Meta分析漏斗图
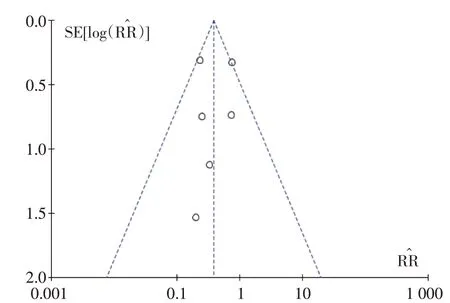
图17 骨髓抑制的Meta分析漏斗图
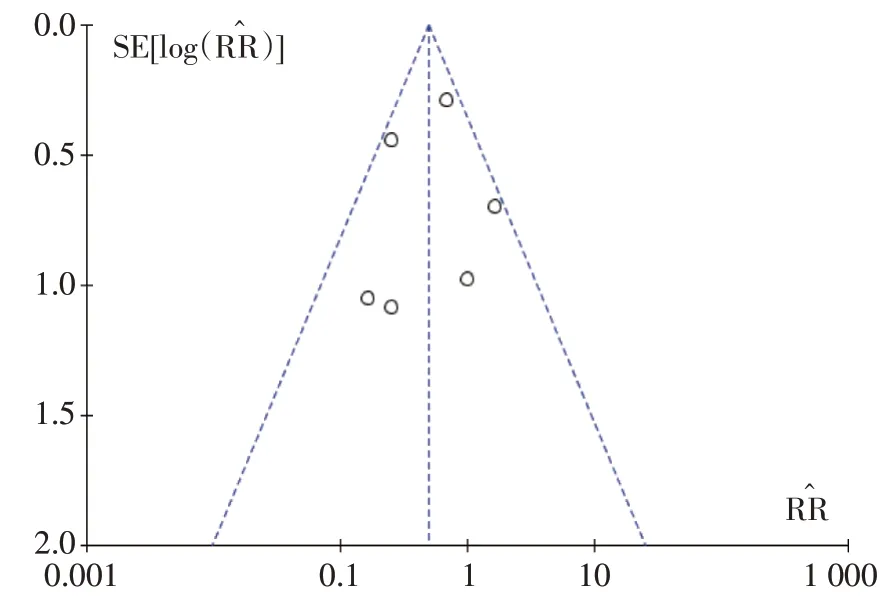
图18 胃肠道不良反应的Meta分析漏斗图
3 讨论
肺癌是目前全球最常见的和致死率最高的恶性肿瘤,2018年全球肺癌新发病例高达209 万余例,肺癌造成的死亡人数高达176 万余例,而肺癌的所有类型中NSCLC 占比>80%[16]。治疗晚期非小细胞肺癌常采用含铂双药化疗,但是经过相关研究总结发现,以铂类为基础的双药化疗方案5年生存率依然很低,低于5%且不良反应重[17]。紫杉醇及多西他赛均为紫杉类抗肿瘤药物,其作用机制是促进微管聚合,抑制解聚,阻断肿瘤细胞的合成,发挥抗肿瘤作用[18-19]。晚期非小细胞肺癌后线亦常采用紫杉醇或多西他赛单药化疗,但有效率低,约16%~27%,预后欠佳,传统化疗已达瓶颈阶段。随着对晚期NSCLC 的研究,靶向治疗、免疫治疗及抗血管生成治疗都有着很大的进展。可通过确定晚期NSCLC 患者的基因突变状况为患者制定出适合的靶向治疗药物,但在治疗10~14 个月后往往会出现疾病进展,而免疫治疗因其治疗周期长、价格昂贵,导致受众患者少。20世纪以来,一系列临床研究证实肿瘤的血管生成是肿瘤发展中的重要过程,血管内皮生长因子(vascular endothelial growth factor, VEGF)通路在肿瘤血管生成过程中发挥了重要作用,而在血管内皮细胞生长因子受体 (vascular endothelial growth factor receptor, VEGFR)家族中VEGFR-2 最为重要,被认为与肿瘤血管生成最为相关。VEGF-2 通过激活丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK) 信号通路,促进血管内皮细胞增殖[20-21]。阿帕替尼是我国自主研发的抗血管生成药物,作为VEGFR2 酪氨酸激酶抑制剂,可抑制VEGF/VEGFR2 信号通路,减少MAPK 形成,从而抑制血管内皮细胞增殖,达到抗肿瘤的作用[22]。目前,阿帕替尼已被中国批准用于晚期胃腺癌或胃-食管结合部腺癌的三线治疗,其在胆管细胞癌、肝细胞癌、结肠癌及非小细胞肺癌的体内外实验中也显示了较强的抗瘤活性,为晚期驱动基因阴性的NSCLC 患者带来新希望。阿帕替尼和紫杉醇/多西他赛单药化疗在晚期小细胞肺癌患者后线治疗过程中都具有一定的临床疗效,但阿帕替尼为口服给药,给药途径方便,患者依从性更佳。
本研究通过对9 篇文献的10 项结局指标进行Meta 分析,结果显示,阿帕替尼组的客观缓解率及疾病控制率显著高于紫杉醇/多西他赛单药化疗组,且胃肠道不良反应及骨髓抑制发生率明显低于紫杉醇/多西他赛组。
本研究存在的不足:①漏斗图提示本研究可能存在发表偏倚,这可能与本研究仅纳入公开发表的中英文文献有关;②本研究纳入的文献较少,多为单中心、小样本研究,且9 篇文献均未报道分配隐藏及盲法的具体实施方法,总体文献质量不高;
综上所述,阿帕替尼对比紫杉醇/多西他赛单药化疗,其疗效及用药安全性更值得肯定,具有更为显著的临床应用价值,但本研究所得结论尚需更多大样本随机双盲试验加以验证。
