氯离子通道蛋白-3对宫颈癌细胞生长、转移的影响
2021-05-10刘晓英沈鑫张静荣晅邓卓
刘晓英,沈鑫,张静,荣晅,邓卓
(陕西省人民医院 妇科,陕西 西安710068)
最常见的宫颈癌类型是鳞状细胞癌(squamous cell carcinoma, SCC),其由低级别鳞状上皮内病变和高级别鳞状上皮内病变形成的。宫颈癌的主要危险因素是乳头瘤病毒(human papillomavirus,HPV)感染[1]。有研究发现,膜离子通道在恶性肿瘤的进展和转移中起着重要作用,例如,氯离子通道可促进肿瘤细胞的侵袭,以及原发性脑肿瘤和神经胶质瘤的脑转移[2]。氯离子通道蛋白-3(CIC-3)是电压门控性氯离子通道家族的成员,与恶性肿瘤细胞行为的调控有关,如增殖、迁移、侵袭和凋亡[3-5],提示CIC-3 可能是肿瘤转移的关键启动子。有研究报道,CIC-3 在异位子宫内膜细胞的迁移和侵袭中起着关键作用[3],并且可能是肿瘤扩散的预后生物标志物[6]。CIC-3 的异常表达可能导致各种病理状况,最近一些研究表明,CIC-3基因表达的变化可能会增加子宫内膜癌、鼻咽癌、乳腺癌和神经胶质瘤等癌症的发生风险[7-8]。并且,CIC-3 通过调控多种分子信号途径来促进恶性肿瘤的侵袭和转移[9]。然而,目前CIC-3 在宫颈鳞癌中的表达模式仍有待进一步揭示,并且尚不清楚靶向调控CIC-3 的表达是否可以调控肿瘤生长和转移。因此,本研究检测CIC-3 在宫颈鳞癌中的表达及其与预后的相关性,并且通过上调或下调CIC-3的表达进一步研究对宫颈鳞癌细胞生长和转移的影响,旨在为宫颈癌的治疗提供新的分子靶标。
1 材料与方法
1.1 材料
选取体重为20~25 g、7 周龄左右的雄性BALB/c-nu/nu 裸小鼠[动物许可证号:SYXK(陕)2016-006],由陕西省人民医院提供。人宫颈鳞癌细胞系SiHa 和人宫颈上皮永生化细胞系H8 购自美国ATCC 公司,胎牛血清购自美国HyClone 公司,DMEM 培养基购自美国Gibco 公司,Trizol 试剂购自日本TaKaRa 公司,M-MLV 逆转录酶购自美国Life Technologies 公司,AceQ qPCR SYBR Green Master Mix 购自南京诺唯赞生物科技有限公司,CIC-3、PI3K、total-AKT 和p-AKT 抗体购自英国Abcam 公司,3,3'-二氨基联苯胺(DAB)购自北京索莱宝科技有限公司,RIPA 裂解液购自德国Roche 公司,BCA 分析试剂盒购自江苏凯基生物技术股份有限公司,聚偏二氟乙烯膜、Transwells 美国Millipore 公司,Bcl-2、p21 和β-actin 抗体购自美国Cell Signaling Technology 公司,HRP 标记的二抗、ECL 化学发光系统、CCK-8、Annexin V-FITC凋亡检测试剂盒购自上海碧云天生物技术研究所,Matrigel 购自美国BD Biosciences公司。
1.2 方法
1.2.1 标本收集和细胞培养选取2016年9月—2018年9月在陕西省人民医院就诊的宫颈鳞癌患者60 例。收集患者宫颈癌组织、配对癌旁组织及临床基线资料。组织收集前,患者未接受任何新辅助化疗或放疗。将SiHa 和H8 细胞加入含有10%胎牛血清(FBS)、100 u/ml 青霉素和100 μg/ml 链霉素的DMEM 培养基中,在含5% CO2的湿润环境中37℃条件下培养。本研究经医学伦理委员会批准,患者签署知情同意书后再收集病理标本进行收集。
1.2.2 实时荧光定量聚合酶链反应使用Trizol 试剂提取组织和细胞中的总RNA,并使用M-MLV 逆转录酶进行逆转录。使用AceQ qPCR SYBR Green Master Mix 在CFX96Touch 实时荧光定量聚合酶链反应(qRT-PCR)系统进行,引物如下:CIC-3正向引物:5'-TTGCCTCTCACAACAGCACGAAATCAATC-3',长度 27bp;反向引物:5'-ATTCTCTCCAGCTAAACTTATTTCAAGAA-3', 长 度29 bp;GAPDH 作为内部参考,正向引物:5'-GAGTCTAAGTCGGCATCGGGTCCAAAGATT-3', 长度 30bp; 反向引物:5'-GATTCTCAGCTGGCCAAGAGTAGTCCTTAG-3', 长度30 bp。反应条件:95℃预变性5 min,95℃变性10 s,60℃退火10 s,72℃拉伸30 s,共40 个循环。通过2-ΔΔCt法计算相对表达量。
1.2.3 免疫组织化学法对石蜡包埋的宫颈组织样品进行常规的脱蜡和再水化。在92 ~98℃、10 mmol 柠檬酸钠缓冲液(pH=6.0)中进行10 min的抗原回收。然后将样品经0.3% H2O2处理15 min。正常山羊血清孵育20 min,PBS 洗涤后,将样品在小鼠抗CIC-3 抗体(1∶500 稀释)中4℃过夜孵育。将切片用PBS 洗涤,并在生物素化的二抗中孵育60 min(1∶1 000 稀释)。然后经DAB 处理5 min,用苏木精复染。阳性染色为细胞膜或细胞质中的棕色染色。将切片在倒置显微镜下观察。使用Image-Pro Plus 6.0 图像分析软件分析。根据染色强度和阳性细胞百分比计算CIC-3 的染色评分。染色强度分为4 个等级:0~3 分依次代表无染色、弱染色、中等染色和强染色。阳性细胞百分比评分分为4 个等级:0~3 分依次代表<10%、10%~25%、25%~50%和>50%。
1.2.4 Western blotting将宫颈组织样本和细胞在含有蛋白酶抑制剂的RIPA 裂解液中裂解,使用BCA 试剂盒评估蛋白相对表达量。按照试剂盒说明书,在8% SDS-PAGE 凝胶中分离蛋白质,并将其转移至聚偏二氟乙烯膜。在室温下用5%脱脂奶将膜封闭2 h。随后,将膜与CIC-3(1∶1 000 稀释)、PI3K (1∶1 000 稀 释)、total-AKT (1∶3 000 稀释)、p-AKT(1∶3 000 稀释)、Bcl-2(1∶500 稀释)、p21(1∶2 000 稀释)和β-actin 一抗(1∶1 000 稀释) 在4℃环境下孵育过夜。然后将膜在HRP 标记的二抗(1∶500 稀释)中室温孵育2 h。通过使用ECL 系统进行显影,以β-actin 作为内参蛋白。
1.2.5 siRNA转染靶向CIC-3 的siRNA(si-CIC-3)和对照siRNA(si-NC)由上海吉玛制药技术有限公司设计合成, si-CIC-3 正向序列:UAUGCGCAUUUUCAACUCAGAG,长度22 bp;反向序列:CUACGGAAGUUGAGAAUGACCAUU,长度 24 bp; si-NC 正向序列 :UCGACCAGGGGUGUACGACGAUUA,长度24 bp;反向序列: UUUCACGAAGUGAGCAGCGGCUCC,长度24 bp。将SiHa 细胞分为对照组、si-NC 组和si-CIC-3 组。对照组不进行转染;使用Lipofectamine 2000 瞬时转染si-CIC-3 (si-CIC-3组)或si-NC(si-NC 组)SiHa 细胞。
1.2.6 CCK-8法使用CCK-8 对细胞增殖进行评估。将5×103个SiHa 细胞接种到96 孔板中,每孔加入10 μl CCK-8 溶液,分别培养24 h、48 h 和72 h后使用BIO-TEK 酶标仪检测450 nm 波长处的光密度值(OD)。
1.2.7 流式细胞术使用Annexin V-FITC 凋亡检测试剂盒通过流式细胞术评估细胞凋亡。将1×105个SiHa 细胞用PBS 洗涤3 次后,将细胞加入含10 μl Annexin V-FITC 和5 μl 碘化丙啶(PI)的500 μl 结合缓冲液,在黑暗环境中孵育20 min。通过BD FACSCalibur 流式细胞仪检测细胞凋亡。
1.2.8 伤口愈合实验将按1×105个/孔SiHa 细胞接种到6 孔板中,达到90%融合时,用移液枪在细胞表面划1 个划痕。用PBS 洗涤细胞3 次,将细胞在新鲜培养基中孵育24 h,在显微镜下以100 倍放大倍数观察并拍照伤口愈合情况。
1.2.9 细胞迁移和侵袭测定在孔径为8 μm的24个孔Transwell 中进行迁移实验。将2×105个SiHa 细胞加入含有1% FBS 的200 μl DMEM 中,并添加到上室,将含有10% FBS 的600 μl DMEM 添加到下室。孵育24 h 后,除去上室中的未迁移细胞,用4%多聚甲醛固定并用Giemsa 染色,然后计数迁移细胞。将上室中细胞预先用Matrigel 涂覆后用于考察细胞的侵袭能力。
1.2.10 体内肿瘤异种移植模型将小鼠饲养在25℃、55%相对湿度的环境中,自由进食。分别将5×106个si-CIC-3 或si-NC 转染的SiHa 细胞注入裸鼠背部,复制10 个肿瘤异种移植模型。每隔1 周监测1 次肿瘤生长,共4 周,肿瘤体积=0.5×短径2×长径。
1.3 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验、方差分析或重复测量设计的方差分析,进一步的两两比较用LSD-t检验;计数资料以率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 CIC-3在宫颈鳞癌组织和细胞系中高表达
免疫组织化学染色结果显示,CIC-3 蛋白主要表达于子宫颈鳞状上皮细胞胞质区。宫颈鳞癌组织和癌旁组织中CIC-3 的阳性染色评分分别为(7.05±0.56)分和(1.13±0.08)分,经t检验,差异有统计学意义(t=8.004,P=0.001),癌组织较癌旁组织高。宫颈鳞癌组织和癌旁组织中CIC-3 mRNA 相对表达量分别为(5.45±0.42)和(1.00±0.03),经t检验,差异有统计学意义(t=11.853,P=0.000),癌组织较癌旁组织高。宫颈鳞癌组织和癌旁组织中CIC-3/β-actin 相对表达量分别为(0.89±0.07)和(0.24±0.03),经t检验,差异有统计学意义(t=9.986,P=0.001),癌组织较癌旁组织高(见图1、2)。
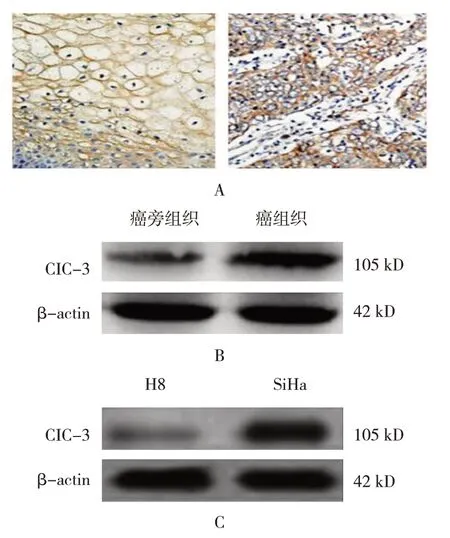
图1 CIC-3在宫颈鳞癌组织和细胞系中的表达
人宫颈鳞癌细胞系SiHa 细胞的CIC-3 mRNA 相对表达量为(3.27±0.39),人正常宫颈上皮H8 细胞为(1.00±0.07),经t检验,差异有统计学意义(t=10.537,P=0.001),SiHa 细胞较H8 细胞高。人宫颈鳞癌细胞系SiHa 细胞的CIC-3 蛋白相对表达量为(0.56±0.05),人正常宫颈上皮H8 细胞为(0.31±0.02),经t检验,差异有统计学意义(t=13.245,P=0.000), SiHa 细胞较H8细胞高(见图3)。
2.2 不同因素宫颈鳞癌患者的CIC-3 高表达率比较
不同年龄患者CIC-3 高表达率比较,差异无统计学意义(P>0.05),不同肿瘤直径、TNM 分期和是否有淋巴结转移患者CIC-3 高表达率比较,差异有统计学意义(P<0.05)。见表1。
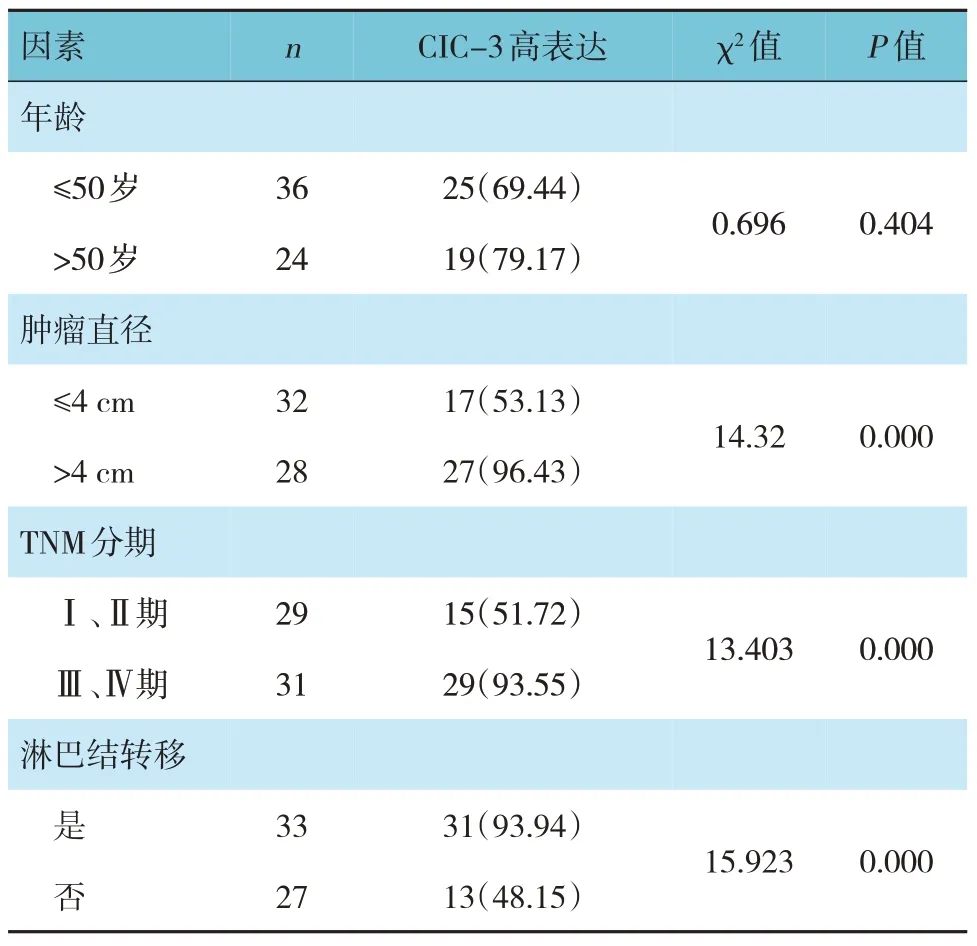
表1 不同因素的宫颈鳞癌患者CIC-3高表达率比较例(%)
2.3 下调CIC-3 可抑制宫颈鳞癌细胞的生长和转移
对照组SiHa 细胞中CIC-3 mRNA 相对表达量为(1.00±0.05),si-NC 组为(0.97±0.05),si-CIC-3组为(0.17±0.01),经方差分析,差异有统计学意义(F=335.630,P=0.000)。对照组SiHa 细胞中CIC-3 蛋白相对表达量为(0.87±0.04),si-NC 组为(0.91±0.05),si-CIC-3 组为(0.21±0.01),经方差分析,差异有统计学意义(F=274.740,P=0.000),转染靶向CIC-3 的siRNA 可下调SiHa 细胞中CIC-3 mRNA 和CIC-3 蛋白相对表达量(见图4)。对不同时间的CCK-8 实验数据进行重复测量数据的方差分析,球形检验的P值为0.154,满足球形分布假设,说明重复测量数据间无相关性。对照组SiHa细胞在培养48 h 后OD 值为(0.31±0.02),si-NC 组为(0.32±0.03),si-CIC-3 组为(0.22±0.01),经单因素方差分析,差异有统计学意义(F=98.540,P=0.000);对照组SiHa 细胞在培养72 h 后OD 值为(0.61±0.04),si-NC 组为(0.64±0.05),si-CIC-3组为(0.41±0.03),经单因素方差分析,差异有统计学意义(F=142.700,P=0.000),下调CIC-3 能抑制SiHa细胞的增殖(见图5)。
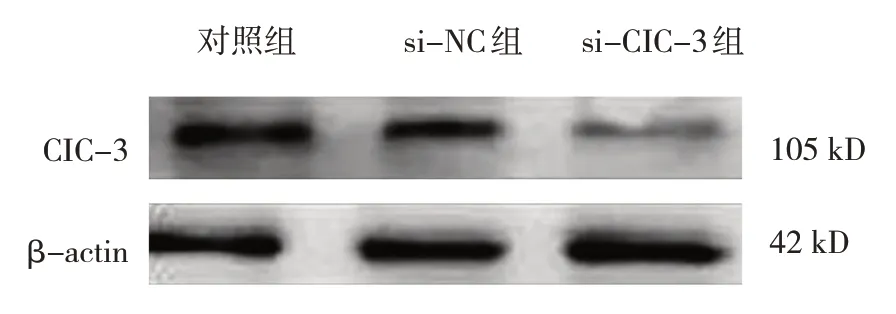
图4 转染CIC-3 siRNA下调SIHA细胞中CIC-3的蛋白表达
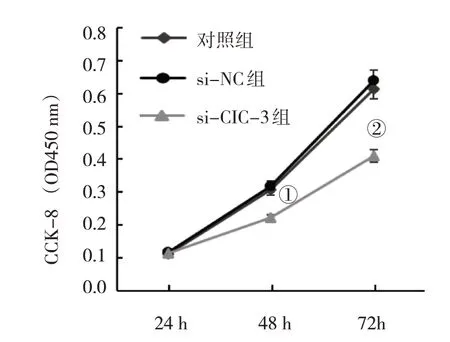
图5 下调CIC-3对SIHA细胞增殖的影响
流式细胞术结果显示,对照组SiHa 细胞的凋亡率为(2.31±0.12)%,si-NC 组为(2.47±0.13)%,si-CIC-3 组为(13.25±0.70)%,经单因素方差分析,差异有统计学意义(F=255.650,P=0.000),下调CIC-3 可促进SiHa 细胞的凋亡(见图6)。伤口愈合实验和Transwell 实验显示,对照组SiHa 细胞的伤口愈合率为(42.43±2.23)%,si-NC 组为(44.21±2.33)%,si-CIC-3 组为(21.08±1.11)%,经单因素方差分析,差异有统计学意义(F=61.220,P=0.000);对照组迁移细胞数为(104.2±5.48)个,si-NC 组为(110.5±5.82) 个, si-CIC-3 组为(56.4±2.97)个,经单因素方差分析,差异有统计学意义(F=315.580,P=0.000),对照组侵袭细胞数为(92.3±4.86),si-NC 组 为(90.4±4.76),si-CIC-3组为(44.5±2.34),经单因素方差分析,差异有统计学意义(F=178.430,P=0.000),下调CIC-3可抑制SiHa细胞的迁移和侵袭能力(见图7)。

图6 SIHA细胞的流式细胞图
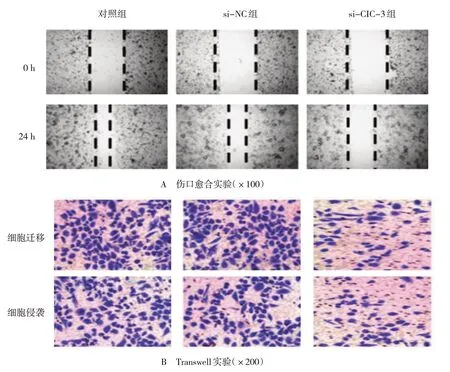
图7 下调CIC-3对SIHA细胞迁移和侵袭的影响
2.4 下调CIC-3 抑制肿瘤异种移植模型裸鼠的肿瘤生长
在体外肿瘤异种移植实验中,对不同时间的肿瘤体积进行重复测量数据的分析,球形检验的P值为0.334,满足球形分布假设,说明重复测量数据间不存在相关性。si-NC 组在14 d、21 d 及28 d 的肿瘤体积分别为(49.12±3.12)mm3、(71.88±5.32)mm3和(102.79±7.64)mm3,si-CIC-3组分别为(33.26±1.73)mm3、(45.04±3.28)mm3和(63.96±4.85)mm3,经t检验,差异有统计学意义(t=5.914、10.001 和12.737,P=0.004、0.001 和0.000),si-CIC-3 组较si-NC 组低。
2.5 CIC-3对PI3K-AKT信号通路的调控作用
各组SIHA 细胞中的PI3K、p-AKT、Bcl-2 和p21蛋白相对表达量比较,差异有统计学意义(F=173.02、166.20、141.39 和159.91,均P=0.000),si-NC 组和si-CIC-3 组下调CIC-3 可抑制PI3K、p-AKT 和Bcl-2 的蛋白表达,但促进p21 的表达(见表2和图8)。
表2 下调CIC-3对SIHA细胞中PI3K-AKT信号通路及下游分子的影响 (±s)
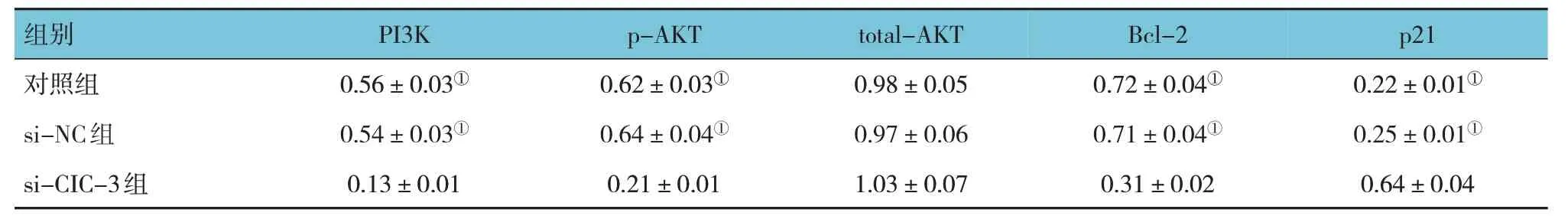
表2 下调CIC-3对SIHA细胞中PI3K-AKT信号通路及下游分子的影响 (±s)
注:①与si-CIC-3组比较,P <0.05。
组别p21 PI3K p-AKT total-AKT Bcl-2对照组si-NC组si-CIC-3组0.22±0.01①0.25±0.01①0.64±0.04 0.56±0.03①0.54±0.03①0.13±0.01 0.62±0.03①0.64±0.04①0.21±0.01 0.98±0.05 0.97±0.06 1.03±0.07 0.72±0.04①0.71±0.04①0.31±0.02
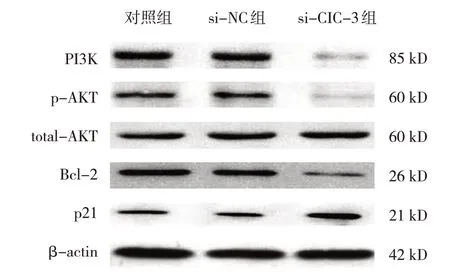
图8 SIHA细胞中PI3K-AKT信号通路及下游分子的蛋白表达
3 讨论
CIC-3 在多种细胞功能中起着重要作用,并且与多种肿瘤进展有关。WANG 等[4]发现CIC-3 在神经胶质瘤组织中高表达,与组织学分级呈正相关[4]。CIC-3 表达较低的脑胶质瘤患者生存时间较长,而CIC-3 表达较高的脑胶质瘤患者的生存时间较短[9]。XU 等[6]还报道细胞质CIC-3 过表达与宫颈癌的转移呈正相关,在细胞质中CIC-3 表达水平较高的患者生存率较差。然而,目前尚缺乏CIC-3 在宫颈癌进展中的作用研究。本研究分析CIC-3 在人宫颈鳞癌中的表达水平及其与预后的关系,发现CIC-3 在人宫颈鳞癌组织和SiHa 细胞系中被上调,并且与患者的肿瘤大小、TNM 分期和淋巴结转移有关,在肿瘤直径>4 cm、TNM 分期为Ⅲ期、Ⅳ期和淋巴结转移的患者中,CIC-3 主要表现为高表达。因此,CIC-3 高表达是宫颈鳞癌恶化的生物标志物。
为进一步揭示CIC-3 在宫颈鳞癌发生、进展中的作用,本研究通过转染靶向CIC-3 的siRNA 来敲除SiHa 细胞系中CIC-3 的表达。结果显示,下调CIC-3 可抑制宫颈鳞癌细胞的生长,促进细胞凋亡。Bcl-2 是一种抗凋亡蛋白[10-11],p21 是一种促凋亡蛋白[12]。本研究也显示,下调CIC-3 可抑制Bcl-2的表达,促进p21 的表达,说明CIC-3 对宫颈鳞癌细胞凋亡的调控作用部分通过Bcl-2 和p21 介导。此外,在体内实验中,本研究发现下调CIC-3 可抑制肿瘤异种移植模型裸鼠的肿瘤生长。因此,上述结果提示靶向调控CIC-3 的表达可通过影响宫颈鳞癌的细胞生长来干预肿瘤进展。
肿瘤细胞的迁移和侵袭是肿瘤转移的主要过程[13-15]。有研究表明,CIC-3 参与细胞体积变化和氯离子电流的调节,该电流与癌细胞的细胞迁移和侵袭呈正相关[16-17]。另外,神经胶质瘤细胞通过改变CIC-3 离子通道的活性来改变侵袭性。CIC-3在人类神经胶质瘤细胞血浆膜上高表达,其活性受Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ磷酸化的调控[18]。在本研究中,下调可CIC-3 抑制宫颈鳞癌细胞的迁移和侵袭。因此,CIC-3 在宫颈鳞癌发生、发展中参与肿瘤的转移。
PI3K-Akt 信号通路是一种经典的细胞存活通路,PI3K-Akt 的激活可抑制细胞凋亡,促进增殖[19-20]。有研究报道,PI3K-Akt 信号通路及其下游信号分子在乳腺癌、肝癌、胃癌、结肠癌等多种癌症中异常激活,并且直接调控细胞的生长和侵袭[21-22]。虽然PI3K-AKT 信号通路也调节宫颈癌细胞功能[23],但是目前尚不清楚CIC-3基因是否在宫颈鳞癌中调节PI3K-AKT 信号通路。本研究发现,下调CIC-3 可抑制宫颈鳞癌细胞中PI3K-AKT 信号通路的活性。另外,Bcl2 和p21 均是PI3K-AKT 信号通路的下游分子[24]。因此,本研究表明通过抑制PI3K-AKT 信号通路可抑制CIC-3 对宫颈鳞癌细胞的促凋亡作用。
综上所述,本研究表明CIC-3 在宫颈鳞癌中高表达,下调CIC-3 可抑制宫颈鳞癌的生长和转移。CIC-3 对宫颈鳞癌细胞凋亡的调控作用部分通过PI3K-AKT 信号通路介导。因此,靶向CIC-3 可能是诊断和治疗宫颈鳞癌的新策略。
