颈动脉斑块内出血与斑块位置的高分辨率磁共振成像研究
2021-05-06杨晋名耿道颖
张 波 杨晋名 杨 嬗 唐 烨 潘 磊 冯 喆 曹 鑫 耿道颖 张 军
颈动脉粥样硬化斑块脱落可形成栓子,阻塞颅内动脉造成远端脑组织缺血导致脑梗死发生。高分辨率磁共振成像(high-resolution magnetic resonance imaging, HR-MRI)可清晰地显示斑块的外部形态特征、内部结构成分和位置分布信息。斑块内出血(intraplaque hemorrhage, IPH)被美国心脏学会(American Heart Association, AHA)列为易损斑块的特征性表现之一。有研究[1]结果表明,IPH可作为判定斑块易损性的新型标志物。IPH的发生与斑块钙化[2]、纤维帽破裂[3]、富含脂质的核心体积[4]、局部的血流动力学[5]和血流剪应力[6]等因素有关。壁切应力(wall shear stress,WSS)是指单位面积上由血管内壁表面流动的液体产生的接近管壁的切向摩擦力,管壁不同位置的斑块所承受的WSS有所不同。同步非增强血管造影和IPH(simultaneous non-contrast angiography and intraplaque hemorrhage, SNAP)成像序列利用物质相位信息进行成像,提高了出血信号与管腔内血流信号和周围管壁之间的对比度,可同时获得IPH位置分布信息[7],为实现IPH的精准识别与评估提供了技术支持。本研究通过三维(3D)HR-MRI分析颈动脉IPH与斑块位置的关系,旨在探讨斑块所处位置可能引起IPH的潜在机制。
1 对象与方法
1.1 研究对象 选择2019年4月—2020年1月在复旦大学附属华山医院神经内科就诊的缺血性脑卒中患者92例,均符合AHA/美国卒中学会(ASA)急性缺血性卒中早期管理指南2019版[8]诊断标准,近两周出现缺血性脑卒中症状或短暂性脑缺血发作,通过颈动脉超声检查发现双侧颈动脉存在至少1枚动脉粥样硬化斑块。患者合并1项或多项动脉粥样硬化危险因素,包括高血压、高脂血症(总胆固醇>5.7 mmol/L或三酰甘油>1.71 mmol/L)、糖尿病、冠心病、吸烟等。患者均行常规头颅CT和MRI检查[包括T1加权成像(T1WI)、T2加权成像(T2WI)、T2液体衰减反转恢复序列(T2-FLAIR)、弥散加权成像(DWI)]。所有患者的临床资料均来自其病历,影像学资料从放射科影像归档和通信系统(PACS)中提取。排除标准:①经头颅CT检查发现有颅内出血、颅内肿瘤或其他非缺血性脑血管病;②经头颅MRI检查发现烟雾病、颅内动脉多发斑块、动静脉畸形、动脉夹层、动脉瘤等血管性疾病;③单侧或双侧颈动脉闭塞;④有颈动脉内膜剥脱术(carotid endarterectomy, CEA)或血管支架植入术等手术史;⑤因患者不自主运动产生的伪影或其他原因导致MRI图像未能达到质量要求;⑥因幽闭恐惧症等个人原因未能完成所有序列检查。本研究获得医院伦理委员会审核和批准(批准号为KY2013-332),所有患者或其家属均已签署知情同意书。
1.2 扫描设备和参数 使用3.0T Philips Ingenia MRI扫描仪(美国飞利浦公司)搭配8通道颈部专用线圈(中国北京清影华康公司)和32通道头颈联合线圈(美国飞利浦公司)对所有患者行头颈动脉一体化3D HR-MRI和时间飞跃法(time of flight,TOF)-MRA,均采用头先进仰卧位。MRI扫描参数如下。①MRA:横轴位扫描重复时间(TR)/回波时间(TE)为23/3.5 ms,成像野(FOV)为160 mm×160 mm×40 mm,空间分辨率为0.6 mm×0.6 mm×2 mm,翻转角为20°,扫描时间为5 min 20 s;②3D T1WI:冠状位扫描TR/TE为600/5 ms,FOV为230 mm×160 mm×60 mm,空间分辨率为0.8 mm×0.8 mm×0.8 mm,翻转角为90°,层厚为1 mm,扫描时间为3 min 14 s;③3D T2WI:冠状位扫描TR/TE为2 500/235 ms,FOV为230 mm×160 mm×60 mm,空间分辨率为0.8 mm×0.8 mm×0.8 mm,翻转角为90°,层厚为1 mm,扫描时间为3 min 55 s;④3D SNAP:冠状位扫描TR/TE为11/5 ms,FOV为230 mm×160 mm×60 mm,空间分辨率为0.8 mm×0.8 mm×0.8 mm,翻转角为11°,层厚为1 mm,扫描时间为4 min 28 s;⑤增强T1WI:经肘前正中静脉注入钆喷酸葡胺注射液10 mL,再行3D T1WI扫描,扫描参数同3D T1WI。
1.3 方法 应用ITK-SNAP软件3.6.0(www.itksnap.org/)对原始图像进行横断面和矢状面多平面重建(multi-planner reformation, MPR)。
1.3.1 勾画感兴趣区(region of interest,ROI) 逐一在3D HR-T1WI和3D HR-T2WI的横轴位、冠状位、矢状位的每幅图像上,沿着可见边界画出斑块的最大范围,外围以动脉管壁为界,内侧以斑块与黑色血流的交界线为界,使ROI覆盖整个斑块。斑块在TOF-MRA原始图像上表现为动脉管壁的增厚,在MRA血管重建图像上表现为管腔的局限性变细,T1WI和T2WI因成分不同而信号不同,见图1A~1D。在3D SNAP图像上识别出IPH的特异性明显高信号,见图1E;沿着高信号边界勾画ROI覆盖全部IPH,如未见明显高信号则表示该斑块无IPH。由两位有5年以上工作经验的放射科医师对同一病灶分别勾画ROI,并应用软件测量斑块体积和IPH体积,计算IPH体积/斑块体积的比值,取平均值,相关结果由1位主任医师评估审核。
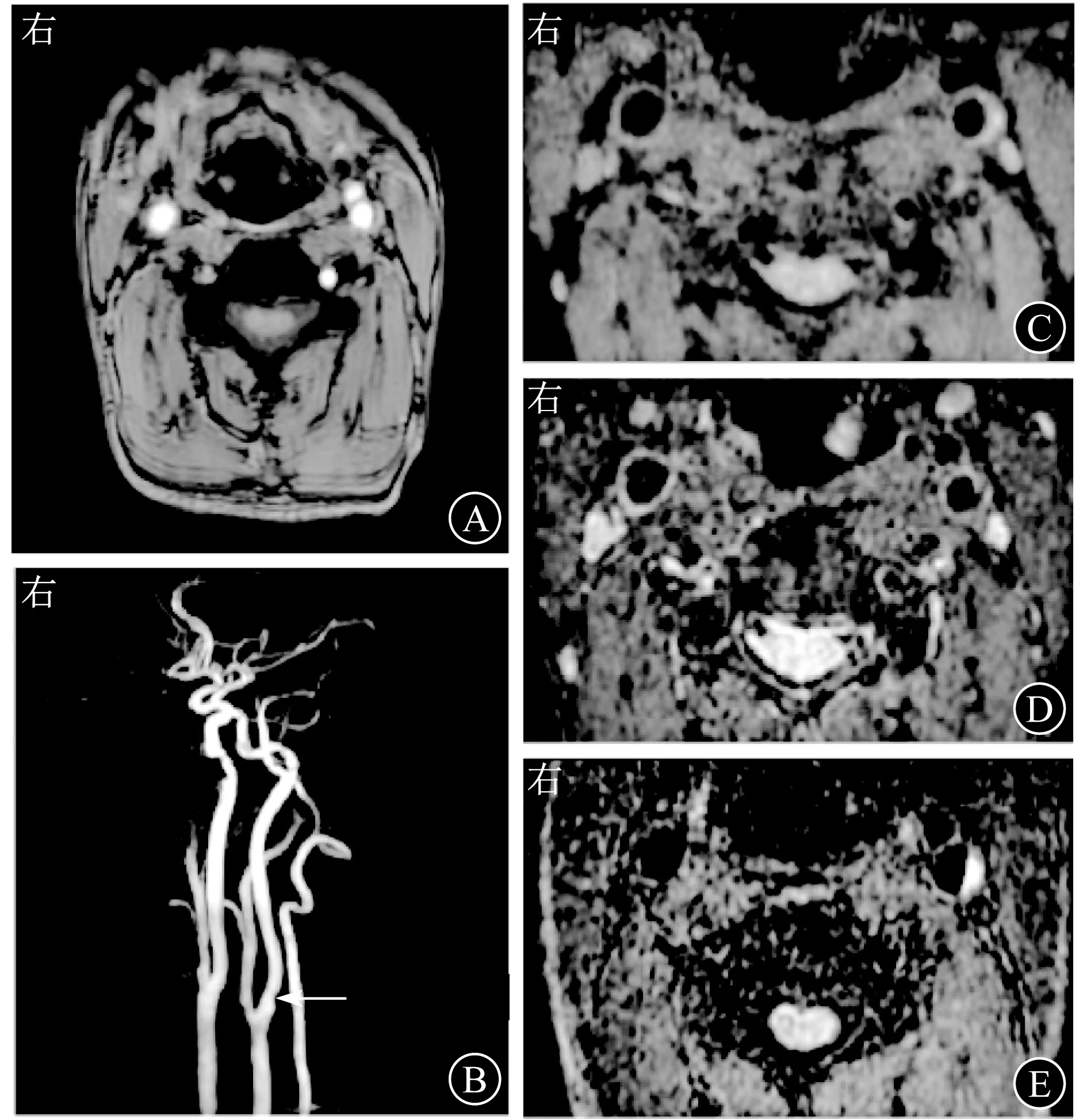
A TOF-MRA原始图像,左侧颈内动脉起始部外侧壁增厚,管腔中度狭窄 B MRA血管重建图像示左侧颈内动脉起始部局限性变细 C 斑块T1WI呈稍高信号 D 斑块T2WI呈稍低信号 E 3D SNAP图像,IPH呈明显高信号图1 57岁男性患者,发作性右侧肢体麻木10 d,左侧额顶叶脑梗死
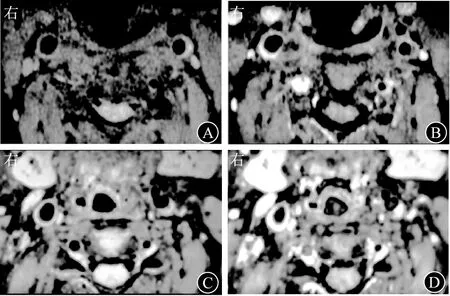
1.3.2 颈动脉斑块分布象限划分 在颈动脉T1WI横轴位图像上,取颈内动脉与颈外动脉起始部血管横断面的中心点连线,以颈内动脉的中心为中点,做圆的三等分,每个象限120°。设定外侧的120°扇形区域为第Ⅰ象限(即颈内动脉起始部的外侧壁),与颈外动脉相对的为第Ⅱ象限(即颈内动脉起始部的后侧壁),内侧为第Ⅲ象限(即颈内动脉起始部的内侧壁),见图2A、2B;沿颈总动脉走行方向行MPR,以清晰显示颈总动脉的管腔和管壁,将颈总动脉末端至分叉部的区域定为第Ⅳ象限,见图2C、2D。其他管壁区域为其他象限。斑块的分布象限定为其最大部分所在象限。由2名放射科医师分别判定斑块分布位置,若产生分歧则由上级主任医师会诊后确定。

A 右侧颈内动脉横轴位T1WI图像 B 左侧颈内动脉橫轴位T1WI图像 C 双侧颈总动脉分叉部的横断面T1WI图像,该区域的斑块属于第Ⅳ象限 D 左侧颈总动脉MPR图像,颈总动脉末端至分叉部之间的区域为第Ⅳ象限图2 颈动脉斑块分布象限划分的示意图
1.3.3 颈动脉斑块强化 对比斑块3D T1WI图像与3D T1WI增强图像,见图3。根据两者信号差异,以增强后垂体信号为参照标准将斑块强化分为3级:0级为无强化,即斑块增强前后无明显信号差异;1级为轻度强化,强化程度弱于正常垂体;2级为明显强化,强化程度强于正常垂体[8]。将有强化的斑块(1级、2级)记作阳性,无强化的斑块(0级)记作阴性。
1.4 观察指标 根据斑块在SNAP的MRI信号特点判断有无IPH,记录斑块位置所处象限。观察斑块增强前后的信号差异,判断增强的程度。
A 57岁男性患者的左侧颈内动脉起始部斑块3D T1WI图像 B 57岁男性患者的3D T1WI增强图像,强化程度为1级(轻度强化) C 58岁女性患者的左侧颈内动脉起始部斑块3D T1WI图像 D 58岁女性患者的3D T1WI增强图像,强化程度为2级(明显强化)图3 颈动脉斑块强化示例图

2 结 果
2.1 一般资料 92例患者中,排除一侧或双侧颈内动脉闭塞8例、颅内动脉重度粥样硬化7例、合并其他颅脑疾病或脑血管病变4例、图像质量未达到评价标准4例、因自身原因未能完成所有序列检查3例,最后纳入研究的患者共66例。其中男56例、女10例;年龄范围55~73岁,年龄为(64.06±9.10)岁。其中高血压患者占90.91%(60/66),糖尿病患者占36.36%(24/66),高血脂患者占33.33%(22/66),冠心病患者占46.97%(31/66),有长期吸烟史者占68.18%(45/66)。
2.2 有无IPH斑块的强化情况 52例患者双侧颈动脉各有1枚斑块,14例患者仅单侧有1枚斑块,共计118枚斑块。有IPH斑块28枚,IPH体积/斑块体积的比值为0.23±0.16,所有斑块均有强化。无IPH的斑块90枚,其中56枚有强化。有IPH斑块的强化率为100%(28/28),显著高于无IPH斑块的62.22%(56/90,P<0.05)。
2.3 有无IPH斑块的患者一般情况和斑块位置 无IPH斑块的男性患者74例、女性患者16例,年龄为(63.53±9.50)岁;有IPH斑块的男性患者24例、女性患者4例,年龄为(67.07±7.61)岁。有无IPH斑块的患者性别构成、年龄的差异均无统计学意义(P值均>0.05)。无IPH斑块的位置:第Ⅰ象限6个(6.67%),第Ⅱ象限28个(31.11%),第Ⅲ象限16个(17.78%),第Ⅳ象限40个(44.44%)。有IPH斑块的位置:第Ⅰ象限6个(21.43%),第Ⅱ象限8个(28.57%),第Ⅲ象限0个,第Ⅳ象限14个(50.00%)。有IPH斑块在第Ⅰ象限内所占比例显著高于无IPH斑块(P<0.05),而在第Ⅲ象限内所占比例显著低于无IPH斑块(P<0.05)。
3 讨 论
本研究结果显示,分布在第Ⅰ象限的有IPH斑块所占比例(21.43%)显著高于无IPH斑块(6.67%),分布在第Ⅲ象限的有IPH斑块所占比例(0)显著低于无IPH斑块(17.78%);结果表明,颈动脉斑块的位置可能会影响IPH的发生。
IPH被认为是易损斑块的特征性表现之一,出血的颈动脉斑块是引发脑梗死的“罪犯斑块”[9]。因斑块组成成分不同,在MRI图像上可显示不同信号,IPH在急性期呈T1WI高信号,T2WI高或低信号,随着时间的延长,信号会发生改变。SNAP判断出血成分的灵敏度和特异度较高,SNAP图像上IPH呈明显高信号,与周围组织对比明显。以往的研究[10]认为,高WSS可能是促进IPH、形成易损斑块的影响因素,其可引起内皮细胞发生特异性改变,加剧炎症反应,刺激动脉粥样硬化的进展。有学者提出,较高的WSS与IPH发生有一定关联[6],有IPH的斑块所承受的WSS高于无IPH的斑块[11]。另有研究[12]结果表明,局部高WSS会同时影响血管内皮的完整性和斑块的易损性;其机制可能是较高的WSS促进血管内皮生长因子表达,诱导斑块内微血管生成,由于缺乏结缔组织和基膜的支撑,血管脆性大,控制血流的能力有限,较大的压力会引起脉管系统渗透增加[13],这或许是引发血管破裂,导致IPH发生的原因之一。梁婷等[14]在其研究中将颈动脉不同部位的血管管壁划分为颈总动脉远端前、后壁和颈内动脉起始部前、后壁。本课题组考虑到颈动脉分叉部的形态变异和颈内动脉旋转角度存在个体差异,参照国内其他学者对基底动脉的斑块位置象限划分[15],针对颈动脉特有的管腔结构形态,更科学、合理地改良了象限划分方式,有利于构建更加符合人体血管解剖结构的物理模型。相较于第Ⅲ象限对应的颈内动脉起始部内侧壁,第Ⅰ象限对应的颈内动脉起始部外侧壁所承受的WSS较大,故斑块稳定性更差,更有可能发生IPH,且易破裂形成血栓,与本研究结果相符。这不仅可指导血管外科医师更精准地实施颈动脉斑块剥脱术,还可提示神经内科医师及早关注高危部位斑块的破裂风险,将缺血性脑卒中的防治端口前移。
本研究结果显示,有IPH斑块的强化率(100%)显著高于无IPH斑块(62.22%),表明IPH与斑块强化间存在一定联系,而斑块强化已被证实是急性缺血性脑卒中发生的独立危险因素[16]。斑块强化的机制复杂,可受多种因素影响。研究[17]发现,斑块的对比度增强与血管新生化和炎症反应有关。动脉粥样硬化斑块内的微血管内皮功能障碍[18],导致钆剂堆积在血管周围的空隙,在MRI的T1WI图像上形成明亮的高信号。由于WSS的大小与血管狭窄程度[19]、血流形式、斑块形状[20]等因素有关,未来应结合流体力学和血流动力学建立物理模型,对该内容进行更深入的研究。
综上所述,该研究通过3D HR-MRI分析发现,颈动脉斑块的位置可能会影响IPH的发生,这或许由颈动脉血管壁不同部位所受WSS的大小不一所致,该结论可为制订有针对性、个体化的临床诊疗方案提供影像学客观依据;此外,有IPH斑块的强化率高,为进一步研究易损斑块形成的病理机制,以及缺血性脑卒中的发病机制提供了新思路。
