Alport综合征一例
2021-05-06欧三桃
费 敏 欧三桃
1 临床资料患者男,25岁,因“发现蛋白尿3年余,加重4 d”入院。3年前患者因面色萎黄、体重减轻于当地医院就诊,无水肿、泡沫尿、皮肤紫癜、腰痛等症状。实验室检查结果示:尿蛋白(+++),24 h尿蛋白定量4.151 g,肾功能正常,故诊断为“肾病综合征”,未行肾脏穿刺活组织检查(简称活检)。后服用中药2年余,期间多次复查尿蛋白(+++)。5个月前发现血压升高,最高值为161/103 mmHg(1 mmHg=0.133 kPa),未服药。4 d前复查尿常规示:尿蛋白(++++),隐血(++),尿红细胞143/μL,尿蛋白/尿肌酐比值为763.18 mg/mmol,门诊拟“肾病综合征”收入院。自患病以来,患者一般情况较好,尿量正常。其1位直系亲属和1位旁系亲属分别在10年前因“尿毒症”死亡。余亲属无特殊家族史。
入院后体格检查示:神志清楚,体温36.6 ℃,心率80次/min,脉搏80次/min,呼吸频率18次/min,血压161/103 mmHg。心、肺、腹、神经系统体格检查未见异常,双下肢无水肿。实验室检查示:24 h尿蛋白定量3.404 g,尿蛋白/尿肌酐比值为257.07 mg/mmol,TC7.07 mmol/L,三酰甘油2.67 mmol/L, 白蛋白37.7 g/L,尿素氮6.28 mmol/L,血清肌酐97.7 μmol/L;估算的肾小球滤过率93.3 mL/min,尿酸440.2 μmol/L。尿常规示尿蛋白(+++),隐血(++),红细胞62/μL。乙型肝炎标志物定量和自身抗体谱等检查结果均无异常。行肾脏穿刺活检,光学显微镜(简称光镜)检查结果提示,增生硬化性肾小球肾炎;电子显微镜(简称电镜)检查结果提示,基底膜弥漫性撕裂、分层,脏层上皮细胞肿胀、空泡变性(图1),疑诊为 Alport综合征(Alport syndrome,AS)。基因检测结果显示:COL4A5基因位点NM_000495.4:exon39:c.3518G>A(p.Gly1173Asp)突变(图2),经二代测序验证其为新发现的变异位点(图3)。根据上述症状、体征和实验室检查结果,结合基因诊断结果,患者AS诊断明确。经仔细询问病史,该患者未出现感音性听力损害和眼部异常等肾外损害表现,故未对患者眼、耳行进一步检查。

A 基底膜致密层呈撕裂、分层改变,基底膜厚薄不一(×400,白色箭头所示为肾脏基底膜) B 肾小管上皮细胞呈空泡变性(× 400,白色箭头所示为肾小管上皮)图1 肾脏穿刺活检组织的电镜图像
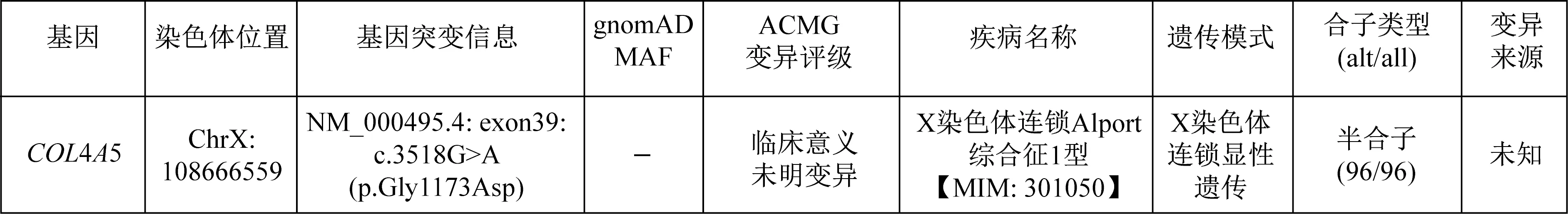
gnomAD MAF为基因组聚合数据库来源的次要等位基因频率;ACMG为美国遗传学与基因组学学会;“-”为gnomAD MAF数据库尚未收录突变图2 基因检测结果
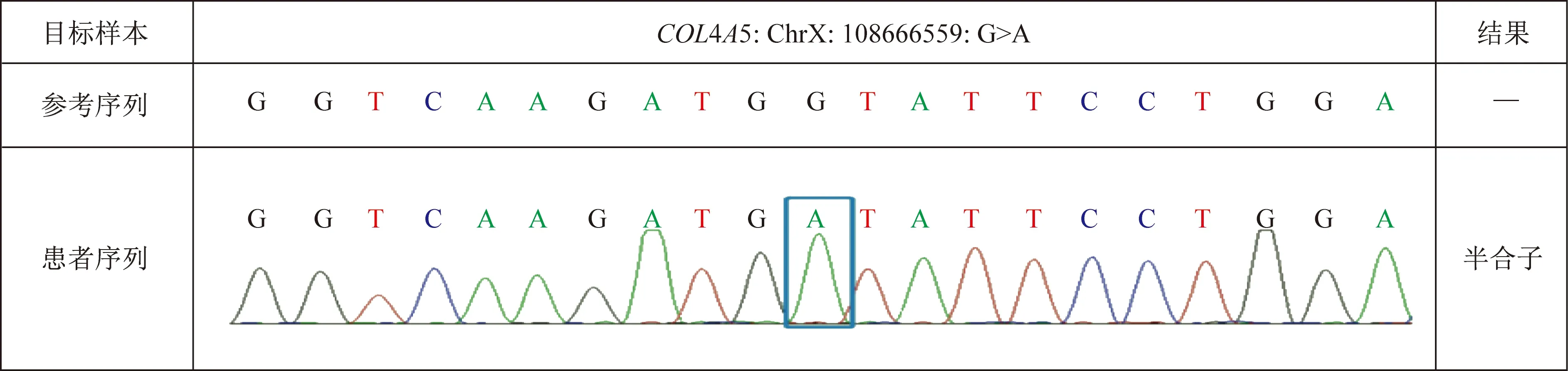
该患者存在c.3518G>A半合子突变图3 二代测序验证结果
病程中,患者因肾功能减退未加用钙调神经磷酸酶抑制剂(calcineurin inhibitor, CNI) 类药物,予缬沙坦胶囊 80 mg(1次/d)、阿托伐他汀钙片10 mg(1次/夜)、肾炎康复片1.92 g(3次/d)、百令胶囊1 g(3次/d)、阿魏酸哌嗪片200 mg(3次/d),治疗1周后复查尿常规示:尿蛋白(++++),隐血(++),红细胞161/mL,24 h尿蛋白定量 2.922 g;病情稳定出院,嘱患者继续口服药物并于门诊长期随访。门诊随访3月余,尿常规检查示:尿蛋白(+++~++++),隐血(++~+++),红细胞192~462/mL,患者病情无明显缓解,予盐酸贝那普利片 10 mg(1次/d)、阿托伐他汀钙片10 mg(1次/夜)、百令胶囊1 g(3次/d)口服治疗。门诊随访至截稿时,患者病情无明显缓解,但也未因病情加重再次住院治疗。
2 讨 论AS是一种由编码基底膜Ⅳ型胶原α链的基因(COL4A3或4或5)突变而导致的遗传异质性疾病。当编码α链的基因发生突变时,该三聚体的结构会被破坏,从而导致相应的肾功能损害、感音性听力损害和眼部异常等[1]。已有研究[1,2-5]证实AS存在3种遗传方式:最常见的是X染色体连锁显性遗传,约占80%~85%;其次为常染色体连锁隐性遗传,约占10%~15%;较罕见的是常染色体连锁显性遗传,约占5%。本例患者经外显子组测序显示,存在1个X染色体连锁的杂合COL4A5基因变异[即NM_000495.4:exon39:c.3518G>A(p.Gly1173Asp)位点突变],患者家族中有两位亲属因“尿毒症”死亡,限于当时医疗和家庭经济条件,两位亲属均未行相关基因检测查明病因。外显子聚集联盟(Exome Aggregation Consortium)、基因组聚合数据库(Genome Aggregation Datebase)等多个人类基因数据库并未收录该基因突变类型,而人类基因突变数据库(Human Gene Mutation Database, HGMD)提示该突变多见于AS患者。SIFT、Polyphen2等多个蛋白质预测软件预测该变异可损伤机体,SPIDEX预测提示该突变对RNA剪切有影响,FATHMM-score软件预测该变异可改变肾小球基底膜Ⅳ型胶原蛋白在内的多种蛋白质结构和功能。因此,根据ACMG指南,变异可被分为致病性或疑似致病性变异。本例突变为碱基替换导致的Ⅳ型胶原蛋白α5链第39位外显子c.3518G>A半合子的错义突变,使得Ⅳ型胶原α5链第1 173位的甘氨酸被天冬氨酸替换,且二代测序结果证实了上述突变的存在。COL4A5基因是编码Ⅳ型胶原蛋白α链的基因,该基因含有51个外显子,其编码产物是由1 685个氨基酸组成的α链,其中,Ⅳ型胶原蛋白的中间胶原区由富含甘氨酸重复保守序列的三联结构(Gly-X-Y)构成,该中间胶原区对Ⅳ型胶原蛋白的三螺旋结构的稳定性具有重要作用。所以笔者推测,基因的错义突变导致Ⅳ型胶原蛋白稳定性降低,并影响该蛋白质的功能,从而导致疾病发生。该突变位点的发现丰富了AS的疾病突变诊断谱。
目前AS患者的诊断主要基于典型的临床表现、肾脏穿刺活检和突变基因位点检测结果[2,6],AS患者肾组织的光镜和免疫学荧光检查结果往往缺乏特征性的病理学改变,而电镜结果常提示肾小球基底膜不规则、肾小球基底膜弥漫性增厚,或厚薄不均,或变薄、致密层撕裂分层、篮网状改变等,因此在没有基因诊断前,电镜结果是诊断AS的“金标准”。然而,典型超微结构仅见于约60%的AS患者[7]。而基因检测对于诊断X染色体连锁显性遗传的AS的灵敏度>90%[6]。本例患者无论是病史、电镜改变,抑或基因检测均符合AS的诊断。
AS以肾损害为主要表现,可见血尿和(或)蛋白尿、进行性肾功能减退,最终发展为终末期肾病(end stage renal disease, ESRD),耳聋、眼部异常、食管平滑肌瘤是其常见的肾外症状[1,5]。患者临床表现因不同的基因突变而存在异质性,X染色体连锁显性遗传和常染色体连锁隐性遗传的AS患者几乎100%有镜下血尿,其中男性较女性更为常见[1-2]。X染色体连锁显性遗传和常染色体连锁隐性遗传的AS患者均可在疾病早期出现蛋白尿,且随着年龄增长症状不断加重[1-2,8-10]。据相关研究[1-2,8-15]报道,90%的X染色体连锁显性遗传的AS患者在40岁之前进展为ESRD,进展为ESRD的中位年龄为25岁;常染色体连锁隐性遗传的AS患者进展为ESRD的中位年龄为21岁,常染色体连锁显性遗传的AS患者症状相对较轻。本例患者的两位亲属均在40岁以前因尿毒症死亡,该AS患者症状符合X染色体连锁显性遗传表现。主要为大量蛋白尿,逐渐出现高血压和肾功能异常,治疗效果欠佳,预估发展至ESRD的进程较快,预后欠佳。
目前,AS尚无特异性的治疗方法,多数X染色体连锁显性遗传的AS男性患者、常染色体连锁隐性遗传和部分常染色体连锁显性遗传的AS患者均会进入ESRD阶段[16]。AS治疗主要通过降低尿蛋白、减缓肾间质纤维化和肾小管萎缩来延缓疾病进程。AS的治疗目前可归纳为3类:药物治疗、基因治疗和肾脏替代治疗[2,16]。国内推荐ACEI类药物作为AS的一线治疗药物,ARB类和醛固酮受体拮抗剂作为二线用药[2,15]。国外也将RAAS抑制剂纳入治疗用药,但尚未获得FDA批准[17]。本例患者确诊后予以ACEI降尿蛋白,经复查后尿蛋白下降不明显,可能与患者尿蛋白程度较重和治疗时间较短有关,需进一步密切随访。
CNI如环孢素A、他克莫司(FK506)也被应用于AS的治疗中。Callís等[18]发现,使用环孢素A治疗AS患者8个月后尿蛋白明显降低、肾功能长期稳定,接受环孢素A治疗患者的预后优于同家族未接受环孢素A治疗的患者,但其治疗效果仍存在争议。Charbit等[19]发现,使用环孢素A治疗AS 患者4~8周后,可降低患者尿蛋白,但也存在肾毒性等不良反应。所以环孢素A使用的利弊仍需要进一步的大样本量研究明确。他克莫司也被用于AS的治疗[2,20],姚小丹等[20]使用他克莫司治疗5例AS患者后发现,他克莫司可降低其蛋白尿,改善血清白蛋白水平(>35 g/L),但也存在肾毒性、糖代谢异常、腹痛、腹泻等不良反应,因此,他克莫司应用于AS治疗尚待进一步研究明确。本例患者此次就诊时已出现肾功能损害,且他克莫司治疗AS证据有限,因此未加用此类药物。近年来,基质金属蛋白酶-12(MMP-12)抑制剂、巴多索隆(bardoxolone)、微RNA-21拮抗剂、帕立骨化醇(paricalcitol)、降脂药(lipid-lowering agents)、西他生坦(sparsentan)等被作为AS治疗用药的研究新方向[2,16-17],有望从动物实验进入临床试验阶段。骨髓干细胞移植术的应用也为AS的治疗提供了契机[2,16,21]。当AS患者进展至ESRD时,肾脏替代治疗或可成为延缓病情的有效方案之一。
综上所述,本例患者为典型的AS病例,结合基因检测结果,发现COL4A5基因突变的1个新位点,丰富了AS基因突变谱。在临床中遇到类似患者时,应提高警惕,仔细甄别,避免漏诊和误诊,慎重选择治疗方案。
