内源性一氧化碳呼气试验检测高原红细胞增多症患者红细胞寿命
2021-05-06普布旺堆罗布卓玛巴顿许彭鹏李军民李啸扬
普布旺堆 方 洁 罗布卓玛 巴顿 许彭鹏 郑 宇 李军民 李啸扬
高原红细胞增多症(high altitude polycythemia,HAPC)是由于高原低氧环境引起的机体红细胞过度代偿性增生的一种慢性高原病。与同海拔高度的健康人相比,HAPC患者以红细胞、血红蛋白、血细胞比容显著增高,动脉血氧饱和度降低为主要特征[1]。根据2004 年第6届高原医学国际会议的标准,对于长期居住于海拔>2 500 m的居民,血红蛋白男性>210 g/L,女性>190 g/L者应考虑为HAPC[2]。我国西藏地区平均海拔>4 000 m,该地区 HAPC 患病率约为3%~5%[3]。近年来,国内外学者对 HAPC的发病机制、流行病学、治疗手段等进行了广泛研究,以期减少HAPC发生,改善患者预后。本研究采用快速内源性一氧化碳(CO)呼气试验检测HAPC患者的红细胞寿命,以探讨HAPC发生的病理学机制和红细胞代谢动力学的改变。
1 对象与方法
1.1 研究对象 回顾性分析2020年4—9月由日喀则市人民医院血液科收治并确诊的50例HAPC患者。所有入选患者经仔细询问病史、体格检查,完善外周血细胞计数和涂片分类,肝、肾功能,动脉血气分析,JAK2基因、CALR基因、MPL基因、BCR-ABL融合基因的定性检测等检查,排除真性红细胞增多症和继发性红细胞增多症,均符合HAPC诊断标准[2]。正常对照组10例,均为健康志愿者;既往无慢性病史,体格检查未发现异常体征,血常规、肝肾功能、心肺功能等检查结果均无异常,且在纳入研究之前至少4周内无急性疾病史、用药史、吸烟史。本项目经医院伦理委员会审核和批准(批准号为2020RSYLL1001),所有患者均签署知情同意书。
1.2 红细胞寿命测定 采用内源性CO呼气试验检测红细胞寿命[4],检测设备为深圳先亚生物科技有限公司生产的RBCS-01型红细胞寿命测定仪。采气前24 h内禁止吸烟,清晨起床后受检者保持空腹、静息状态,采气时间限定在上午9:00-12:00。采气时受检者首先深吸气,屏气10 s以上,随之口含密封铝箔肺泡气收集袋的单向导气管并深呼气,去除呼吸道死腔气体后,收集呼出气;同时,应用手动气泵采集同室空气样本。2份气样同时送检,上机测定CO浓度[5]。仪器操作严格按照使用说明进行。
1.3 红细胞单采术 应用COBE Spectra血细胞分离机(美国泰尔茂比司特公司)进行红细胞单采术。全血处理量约为1 000~1 500 mL,全血流速为40~60 mL/min,复方枸橼酸钠溶液(ACD-A)抗凝剂平均用量为350 mL,处理时间为(74±21) min。单采浓缩红细胞时,以同样速度输入等量的乳酸林格液和低分子右旋糖酐。治疗前先静脉推注10%葡萄糖酸钙10 mL,治疗后根据ACD-A用量决定是否追加10%葡萄糖酸钙,以预防枸橼酸盐中毒反应[6]。

2 结 果
2.1 一般资料 50例初诊为HAPC的患者均为男性,年龄范围28~76岁,中位年龄为48岁,其中藏族41例,汉族9例。患者在入院后均接受持续低流量吸氧和改善循环治疗,并行红细胞单采术,藏、汉两族患者初诊时血红蛋白等的差异无统计学意义(P值均>0.05)。见表1。
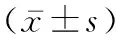
表1 50例HAPC患者的一般资料比较
高原地区血液检查正常参考值: 红细胞计数为(4.3~5.8)×1012/L,血红蛋白为130~175 g/L,血细胞比容为0.40~0.50,白细胞计数为(3.5~9.5)×109/L,血小板计数为(125~350)×109/L,网织红细胞绝对值为(22~83)×109/L,血清总胆红素为3.4~17.1 μmol/L,血清间接胆红素为0~22 μmol/L,乳酸脱氢酶为110~245 U/L10例正常对照者均为男性,其中藏族8例,汉族2例,年龄范围25~64岁,中位年龄为37岁,血红蛋白水平(149.8±10.0) g/L。
2.2 红细胞寿命测定 HAPC患者治疗前血红蛋白为(229.1±13.9) g/L,内源性CO呼气试验测得红细胞寿命为(69.4±34.5) d,较正常对照组的(101.5±14.9) d显著缩短(P=0.001)。其中,藏族患者治疗前红细胞寿命为(58.1±24.5) d,较正常对照组显著缩短(P=0.001);汉族患者治疗前红细胞寿命为(114.6±31.9) d,与正常对照组的差异无统计学意义(P=0.255)。接受红细胞单采术治疗后1周,总体患者血红蛋白为(170.3±19.7) g/L,红细胞寿命为(80.3±28.1) d,后者较治疗前显著延长(P值均<0.05)。其中,藏族患者治疗后红细胞寿命为(74.6±27.1) d,较治疗前显著延长(P=0.005);汉族患者治疗后红细胞寿命为(103.0±19.5) d,与治疗前的差异无统计学意义(P=0.340)。见图1。
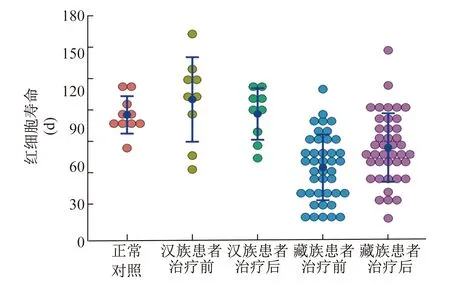
图1 HAPC患者治疗前后与正常对照组红细胞寿命情况
2.3 影响红细胞寿命的相关因素分析 初诊HAPC患者红细胞寿命的相关因素分析结果显示,HAPC患者红细胞寿命与外周血血小板计数呈正相关(r=0.320,P=0.023),与血清维生素B12水平呈负相关(r=-0.325,P=0.021);与患者现实年龄、初始发病年龄、病程[发现红细胞增多(或)出现症状至检测红细胞寿命时]、外周血白细胞计数、外周血白细胞分类、红细胞计数、血红蛋白水平、血细胞比容、网织红细胞绝对值、网织红细胞比例、总胆红素、间接胆红素、血清促红细胞生成素(EPO)水平、可溶性转铁蛋白受体水平、血清铁、铁蛋白、叶酸等均无显著相关性(P值均>0.05)。
3 讨 论
呼气CO来源于血红素降解、非血红素代谢和外源吸入。内源性CO的86%来自血红素降解,14%为非血红素代谢产生。而产生CO的血红素85%来自于红细胞降解,15%来自于其他物质降解。因此,内源性 CO 呼气试验检测红细胞寿命的原理是快速检测肺泡呼出气体中CO浓度来反映即时机体红细胞的血红蛋白分解,以间接推算红细胞存活情况[7]。Zhang等[4]采用该方法检测正常人红细胞寿命为(126±26) d,范围82~215 d,与传统标记法检测结果相当。溶血性贫血、真性红细胞增多症(PV)、再生障碍性贫血、慢性肾病等患者的红细胞寿命显著缩短[4-5,7-9]。本研究采用内源性CO呼气试验法测得正常对照组的红细胞寿命为(101.5±14.9) d,与上述文献报道的正常人红细胞寿命相似,进一步验证了本方法在高原地区应用的可行性和结果的可靠性。
红细胞寿命检测一直被应用于红细胞增多症病因及其发病机制的研究中。Huff等[10]检测PV患者时发现,其红细胞寿命缩短。国内学者于2019年首次报道采用内源性 CO 呼气试验检测PV患者红细胞,结果显示其红细胞寿命较正常人显著缩短[5]。由于存在基因突变,PV患者体内的克隆性红细胞大量增殖,缩短红细胞寿命或是机体代偿性减少过量生成的红细胞的代偿性反应。
HAPC的发病机制与PV不尽相同,高原地区的居民长期处于低氧环境,对缺氧的关键生理反应是EPO水平升高,这会导致红细胞生成增加。EPO基因受大气中氧含量调控[11]。而EPO水平升高是HAPC的主要发病机制,但与红细胞寿命的关系仍不清楚。
Bogdanova等[11]发现,EPO过表达小鼠的红细胞增多,小鼠红细胞中加速老化标志物增多,红细胞寿命缩短,提示可能是机体对红细胞绝对数量增加做出的代偿性反应。国内研究[12]显示,慢性低氧环境下,大鼠体内被标记的成熟红细胞增多,表明红细胞在高原缺氧环境下衰亡减缓、寿命延长。两组研究均是模拟高原环境中小鼠红细胞变化。本研究直观地检测日喀则市部分HAPC患者体内的红细胞寿命,结果显示藏族HAPC患者红细胞寿命显著缩短,而汉族患者红细胞寿命接近正常。这可能与藏汉两族HAPC患者发病机制存在差异有关。
藏族HAPC患者由于世代生活在高原地区,机体已适应缺氧环境。在血液中的含氧量降低时,藏族HAPC患者体内常见的EPAS1基因被激活,通过上调缺氧诱导因子1-EPO通路触发生成更多的红细胞[13]。这一机制使藏族HAPC患者发病类似于PV,即都是由基因功能激活导致细胞增殖上调,因此藏族HAPC患者红细胞寿命显著缩短。汉族HAPC患者在慢性低氧条件下,红细胞膜表面磷脂酰肌醇外翻程度降低,红细胞内CD47的表达增加,从而使得巨噬细胞识别红细胞功能下降,导致红细胞寿命不缩短[14-15]。
本团队在前期工作中采用红细胞单采术治疗HAPC患者,取得了良好的疗效[3]。本研究发现,红细胞单采术治疗后患者的红细胞寿命显著回升,可能原因是该治疗将部分寿命缩短的红细胞清除,而新生正常寿命红细胞的补充使得整体红细胞寿命延长。
同时,本研究显示HAPC患者的红细胞寿命与血清维生素B12水平呈负相关,但维生素B12与红细胞寿命相互影响的机制尚不明确;患者的血小板计数与红细胞寿命呈正相关,这与PV患者情况类似,可能与髓系细胞发育过程中,红细胞增殖活跃后反馈性抑制血小板生成有关。
综上,本研究发现内源性CO呼气试验检测HAPC患者的红细胞寿命较正常人缩短约1/3,汉族HAPC患者外周血血红蛋白水平显著增高可能是因为红细胞衰亡平衡被打破,使得红细胞寿命无法代偿性缩短,从而导致红细胞数量失衡。缺氧环境中基因功能的变化或是发生HAPC的根本原因。
