艾灸对佐剂性关节炎大鼠滑膜组织TLR4/NF-κB信号通路影响
2021-05-06卢曼晨庞静雯
卢曼晨,庞静雯
(安徽中医药大学,合肥 230000)
类风湿关节炎(rheumatoid arthritis, RA)是一种以对称性、侵蚀性滑膜炎为主要病理学特点的慢性、炎症性、系统性自身免疫疾病。临床以关节肿胀、疼痛为主要表现,甚者可至关节破坏、畸形和功能障碍,影响患者健康和生活质量。该病发病机制尚不明确,病情反复且病程缠绵,研究证实其与自身免疫系统关系密切,同时与炎性因子密切相关[1-3]。近年来的研究表明,RA与局部某些信号通路的激活或抑制有关,Toll 样受体 4/核因子-κB(Toll-like receptor 4/nuclear factor κB, TLR4/NF-κB)信号通路在 RA的发生发展中扮演着重要角色,研究发现RA患者的滑膜组织、免疫细胞等都存在TLR表达的改变[4]。
在现代研究中,佐剂性关节炎(adjuvant arthritis, AA)大鼠模型与RA病理特点相似,常作为研究RA发病和治疗的动物模型。AA大鼠模型是在20世纪50年代由细菌学家Freund创立,又称弗氏佐剂关节炎,以炎细胞浸润、软骨破坏、基因连锁等为特点,被广泛应用于 RA相关研究[5]。有研究表明,艾灸“足三里”等穴可通过调节细胞因子、提高局部痛阈等途径来缓解滑膜炎症和关节疼痛[6-8]。本研究从艾灸的抗炎免疫效应出发,观察 TLR4/NF-κB信号通路在 AA模型大鼠滑膜炎症和滑膜细胞增殖中的作用,探讨艾灸通过 TLR4/NF-κB途径改善关节滑膜组织局部炎症的机制。
1 材料与方法
1.1 实验动物及其分组
健康雄性SD大鼠30只,由安徽省实验动物中心提供,许可证号为 SCXK(皖)2017-001,体质量(250±20)g,适应性喂养 1周后,按照《卫生统计学》[9]随机数字表随机分为正常组、模型组和艾灸组,每组10只。各组大鼠12 h明暗交替、(25~28)℃环境饲养,每日添加水食。实验过程中严格遵循中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》相关规定对动物进行处置。
1.2 主要试剂与仪器
完全弗氏佐剂 (SLBW7430,Sigma), 水合氯醛(20180305,国药集团化学试剂有限公司),异丙醇(20160614,上海苏懿化学试剂有限公司),DEPC-H2O(D1007, Generay Biotech),大鼠 IL-1β ELISA 试剂盒(I05018350, Cusabio),大鼠 TNF-α ELISA 试剂盒(G22018349, Cusabio),Trizol(15596026, Life technogies), 逆转录试剂盒 (K1622, Thermo Scientific),无水乙醇、二甲苯(国药集团),苏木素(BA-4097,贝索试剂),伊红(BA-4099,贝索试剂)。趾容积测量仪(成都泰盟软件有限公司),酶标仪(Molecular Devices, SpectraMax M2e),GL-88B 漩涡混合器(其林贝尔仪器制造公司),倒置荧光显微镜(日本尼康 Nikon Ti),石蜡切片机(RM2245,德国 Leica),普通PCR仪(K960,杭州晶格科学仪器有限公司),荧光定量 PCR 仪(PIKOREAL 96, Thermo Scientific),微孔板迷你离心机(MINI-P25,杭州奥盛仪器有限公司)。
1.3 模型制备
AA大鼠模型构建参考文献方法[10],模型组和艾灸组大鼠皮下注射完全弗氏佐剂(complete freund's adjuvant, CFA)。用75%乙醇溶液对左后足消毒,按每只0.1 mL的剂量进行皮下注射CFA,观察3 d。左后肢出现不同程度的红肿、结节和活动受限表示模型成功。正常组大鼠不作任何处理。
1.4 干预方法
艾灸组参照《实验针灸学》[11]的动物穴位图谱取“足三里”穴,于造模后第4天开始采用直径0.9 cm纯艾条(南阳市卧龙汉医艾绒厂)对大鼠左后肢“足三里”穴进行温和灸,艾条距离皮表2 cm,每次20 min,每日1次,连续灸15 d。正常组和模型组大鼠于艾灸组干预的同时间段仅进行抓取,并固定在特制的悬空木架上,不做任何干预,每次固定20 min,每日1次,连续15 d。
1.5 检测指标
1.5.1 足趾关节肿胀度
末次干预后次日,使用足趾容积测量仪测量 3组大鼠左后足趾容积。于大鼠踝关节处做标记,使用足趾容积测量仪测量大鼠左后肢足趾容积,连测 3次取平均值,作为评估各组足趾关节肿胀度的数据。
1.5.2 大鼠滑膜组织形态学观察
末次干预后次日,采用 10%水合氯醛溶液进行腹腔注射麻醉(每100 g体质量注射0.3 mL)后处死,取左后肢足趾关节组织若干块(每块大小0.5 cm3),立刻固定于4%多聚甲醛溶液中12 h,经梯度乙醇溶液脱水,石蜡包埋,组织切片机切片,40℃~45℃水浴锅展片、贴片,经脱蜡至水后,切片放入苏木精中染色约2 min。用清水洗涤、分化、漂洗、分别用低浓度到高浓度的乙醇溶液脱水,滴加 0.5%伊红乙醇溶液 0.2 mL,静置1~3 min,再将切片放入无水乙醇1 min左右,最后放入95%乙醇溶液,直到无红色染料残留。将切片浸入二甲苯溶液中3~5 min,滴加中性树胶0.5 mL,于阴凉处静置凝固,显微镜下观察滑膜组织形态结构。
1.5.3 趾关节滑膜组织IL-1β、TNF-α含量检测
按上法处死大鼠,取左后肢足趾关节滑膜组织 100 mg,剪碎,液氮研磨,加入 1 mL生理盐水匀浆, 3000 r/min离心15 min,再取上清液,液氮速冻,-80℃保存备用。检测时,从-80℃冰箱中取出关节液梯度复温融化,试剂盒在室温中平衡20 min后,按酶联免疫吸附法(ELISA)说明书中的步骤进行标准品(S0-S6)制备、加样、抗体孵育等操作,加入终止液后用酶标仪在450 nm波长检测每孔光密度值(OD值)。由S0-S6的OD值和浓度绘出标准曲线和标准方程,将每孔OD值代入标准方程求出每个样本IL-1β和TNF-α的浓度。
1.5.4 趾关节滑膜组织IκB激酶复合物(IκB kinase complex, IκK)β 、 NF-κBp65 、 NF-κB 抑制蛋白(inhibitor of nuclear factor kappa B kinase, IκB)α、髓样分化因子 88(myeloid differentiation factor88, Myd88)、TLR4 mRNA 检测
按上法取大鼠左后肢关节足趾关节滑膜组织100 mg,剪碎,液氮研磨,加入1 mL TRIzol匀浆。用4℃离心机12 000 r/min离心匀浆10 min,保证脂肪和组织被去除。取上清液于离心管(eppendorf, EP)中,加入0.2 mL氯仿溶液,剧烈震荡EP管15 s,室温静置3 min后,将液体用4℃离心机12 000 r/min离心15 min,取0.5 mL上清液加入另一EP管中,再向EP管中加入0.5 mL异丙醇溶液,轻轻颠倒几下混匀,室温静置10 min,用4℃离心机12 000 r/min离心10 min,用移液器吸去上清液。向沉淀中加入1 mL 75%乙醇溶液[用焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)处理过并经高温高压灭菌的超纯水配制],轻柔吹打混匀,用4℃离心机12 000 r/min离心5 min,轻轻吸去上清液。于阴凉处室温放置30 min,待RNA沉淀干燥。向沉淀中心加 20 μL DEPC水,放置在 55℃水浴锅中 10 min,-80℃保存备用。将总 RNA(质量为 1 μg)加入0.2 mL的EP管中,再加入10 μm寡聚胸腺嘧啶引物[Oligo(dT)]1 μL,加入 DEPC 水将管内液体体积补足至12 μL后,轻轻弹EP管壁混匀、点动离心。然后用PCR仪加热5 min,温度设置65℃,加热结束后立即冰浴3 min。按照试剂盒说明,在上述EP管中加入相关缓冲液和预混溶液。放置PCR仪中,设置程序,取出上述反应液保存备用。取出cDNA作为荧光定量的模板,按照反应体系,在相应反应条件下进行40个循环。各检测指标引物详见表1。
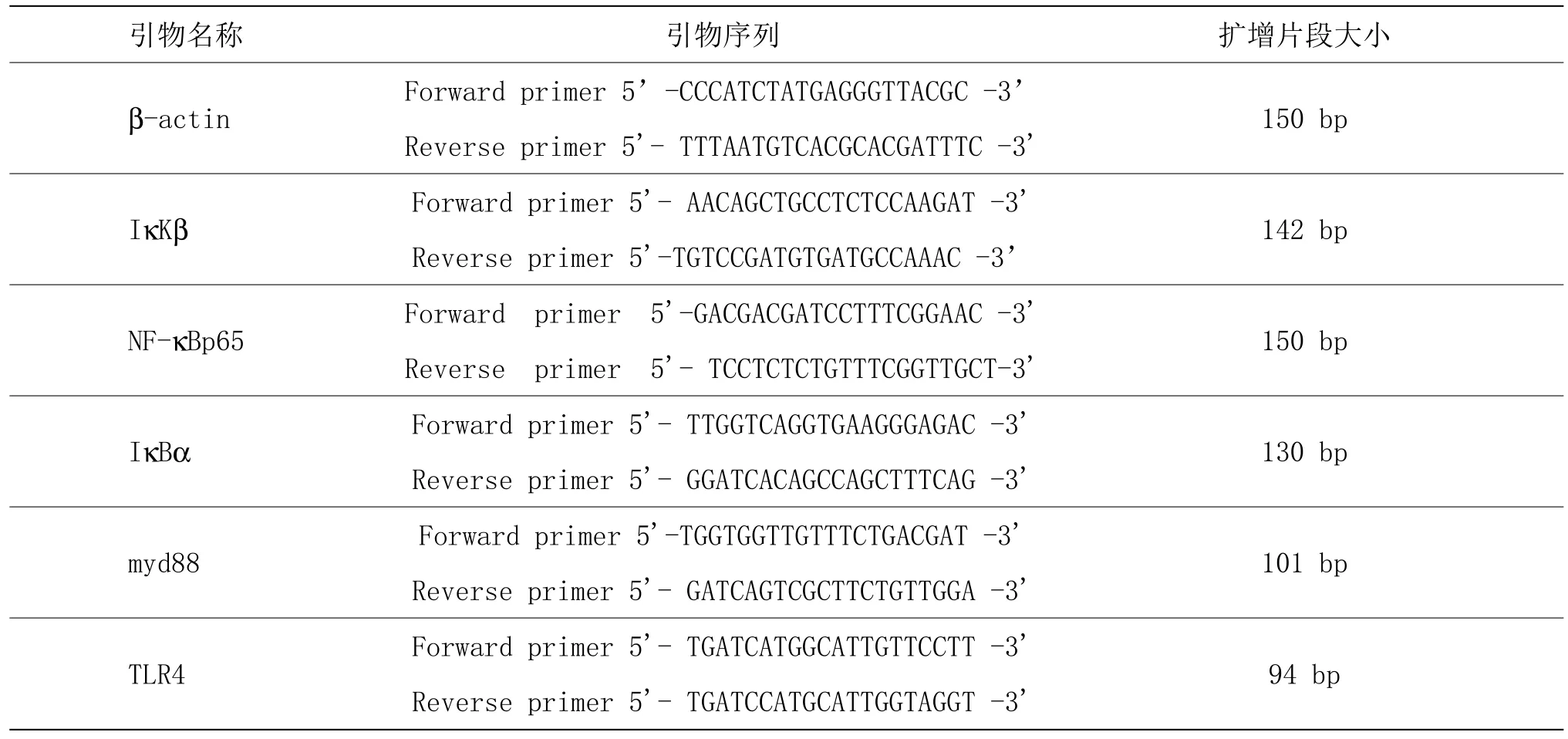
表1 各检测指标引物序列
1.6 统计学方法
采用SPSS21.0软件对数据进行统计分析。符合正态分布的计量资料采用均数±标准差表示;多组间比较采用单因素方差(one-way ANOVA)分析;若方差齐,组间两两比较采用LSD法,若方差不齐则采用Games-Howell分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 3组大鼠左后肢足趾容积比较
与正常组比较,模型组中大鼠足趾容积明显增加(P<0.01);与模型组比较,艾灸组大鼠足趾容积明显降低(P<0.01)。表明艾灸可明显缓解AA大鼠足趾肿胀。详见图1。
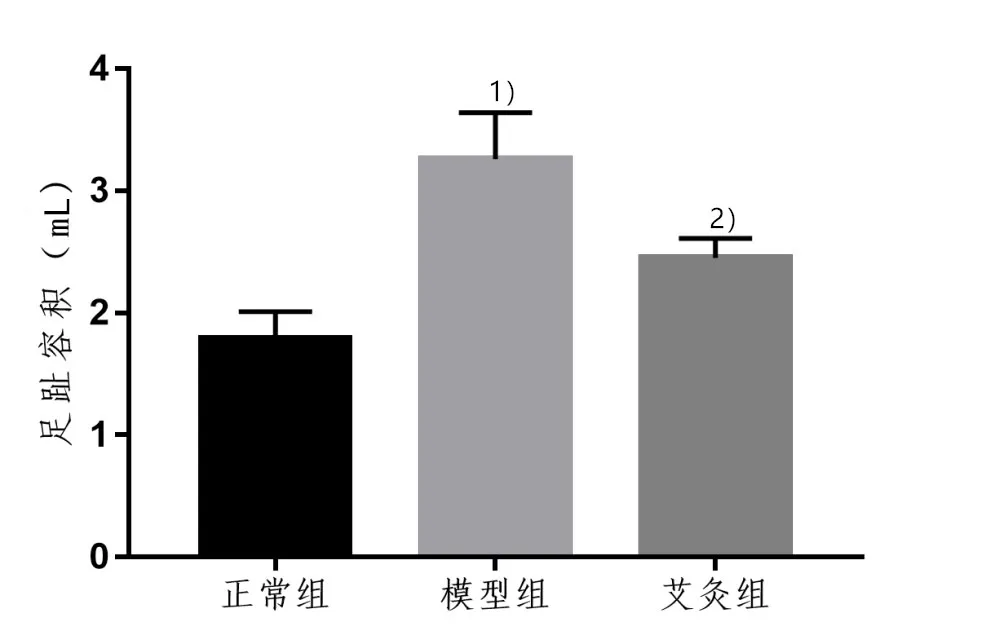
图1 3组大鼠左后肢足趾容积比较(n=10)
2.2 3组大鼠滑膜组织形态学比较
正常组大鼠的滑膜细胞大多排列较为规则,呈现单层形态,未观察到炎细胞浸润,滑膜表面平滑整齐;模型组大鼠滑膜细胞出现增生,组织中可见大量炎细胞浸润,滑膜表面细胞排列不整齐;艾灸组与模型组比较,炎细胞浸润减少,滑膜细胞的增生情况缓解。详见图2。
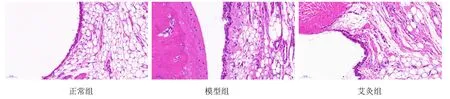
图2 3组大鼠滑膜组织形态学比较(HE染色,×400)
2.3 3组大鼠滑膜组织中IL-1β和TNF-α浓度比较
与正常组比较,模型组大鼠滑膜组织中 IL-1β和TNF-α的浓度均升高,差异具有统计学意义(P<0.01);与模型组比较,艾灸组IL-1β和TNF-α的浓度均降低(P<0.01)。详见图3。
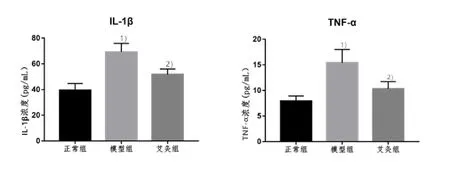
图3 3组大鼠滑膜组织中IL-1β和TNF-α的浓度比较(n=10)
2.4 3组大鼠滑膜组织中TLR4和Myd88 mRNA的表达比较
与正常组比较,模型组大鼠滑膜组织中 TLR4、Myd88 mRNA表达量均升高,组间差异具有统计学意义(P<0.01);与模型组比较,艾灸组大鼠滑膜组织中TLR4、Myd88 mRNA表达量均降低,差异具有统计学意义(P<0.01)。详见图 4。
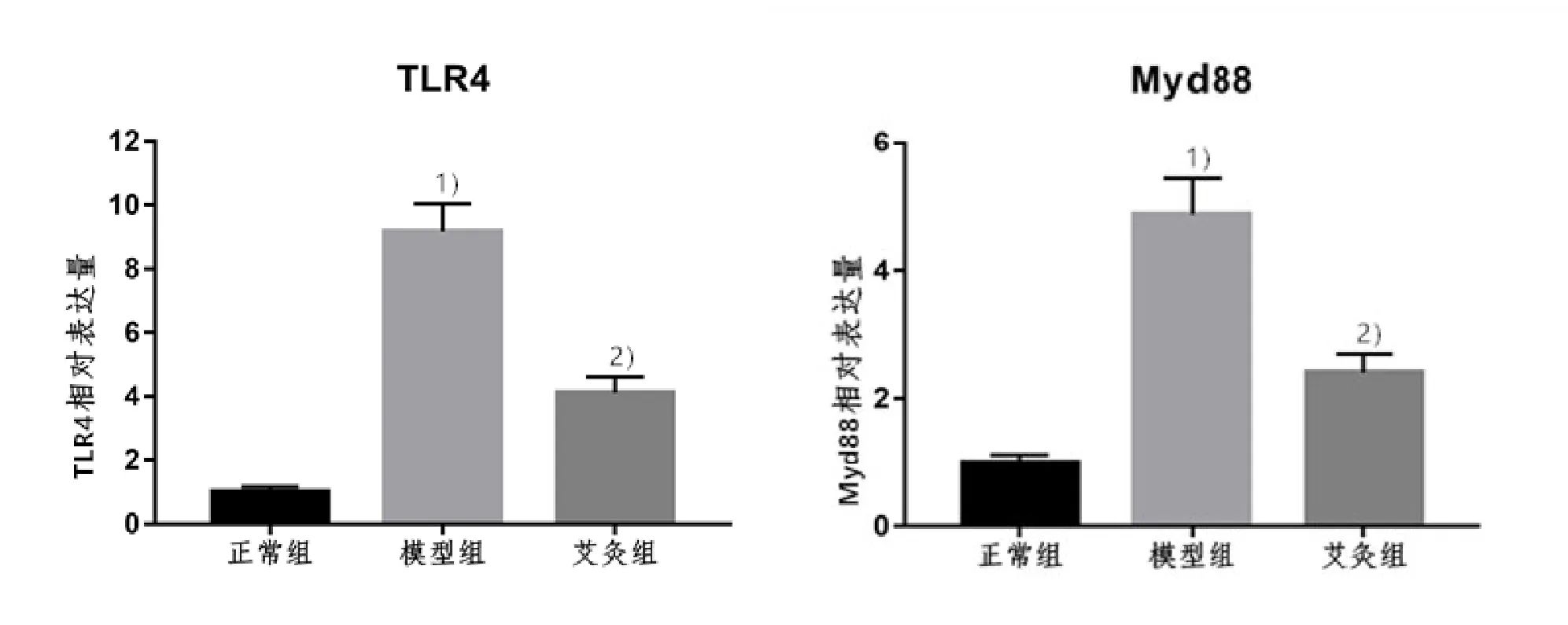
图4 3组大鼠滑膜组织中TLR4和Myd88 mRNA的表达比较(n=10)
2.5 3 组大鼠滑膜组织中 NF-κB p65、IκBɑ和IκKβ mRNA 的表达比较
与正常组比较,模型组大鼠滑膜组织NF-κB p65、IκBα和 IκKβ mRNA的表达均升高,差异有统计学意义(P<0.01);与模型组比较,艾灸组大鼠 NF-κB p65、IκBα和 IκKβ mRNA的表达量均降低,差异有统计学意义(P<0.01)。详见图 5。

图5 3 组大鼠 NF-κB p65、IκBα、IκKβ mRNA 的表达比较(n=10)
3 讨论
类风湿关节炎是一种病因尚未明确的慢性、进行性、侵蚀性自身免疫性疾病,特征性表现为滑膜炎。IL-1β、TNF-α等炎性细胞因子、炎性抗体以及 T、B细胞在该病发展过程中起着重要作用[12]。其中IL-1β、TNF-α在患者血浆中高表达,发病过程中主要诱导内皮细胞表达黏附分子(ICAM-1),导致局部炎症,抑制糖蛋白合成导致骨和软骨的破坏,且二者具有显著的正相关关系[13-14]。NF-κB信号通路与机体炎症反应密切相关,可调控包括 IL-1β、TNF-α等多种促炎因子的表达,并在RA患者疾病过程中参与滑膜组织增生、骨组织破坏等[15-17]。NF-κB信号通路由包括 NF-κB家族、IκB和IκK等因子组成。NF-κB家族在RA实验研究中最常见的是p50和p65两个亚单位构成的一种异源二聚体;IκBα是 NF-κB 抑制蛋白之一,可与 NF-κB p65 蛋白结合,定位于细胞质中;IκB激酶能够特异磷酸化IκBα,启动基因转录活化NF-κB,是多种肿瘤、炎症发生发展的重要因素[18]。在炎症反应中,参与免疫系统对微生物识别的受体家族 TLRs也会被激活。研究表明,TLR2、TLR4参与早期RA的发生、发展,通过识别后的 TLR4可磷酸化 IκB蛋白,促进其降解,级联反应激活 NF-κB,信号转移至细胞核中,从而发挥其调控炎症作用[19-21]。Myd88处于 TLR信号通路的下游,NF-κB信号通路可使 TLR通过 Myd88途径激活,合成并释放TNF-α、IL-1β等相关炎症介质 ,完成炎性反应信号的传递[22-23]。
因此TLR4/NF-κB信号通路在对RA治疗机制研究中具有较高价值。本实验亦证实AA模型大鼠滑膜细胞炎性增殖严重,滑膜组织 TNF-α、IL-1β的水平上升明显,NF-κB p65 蛋白、IκBα、IκKβ、TLR4、Myd88 mRNA表达水平均显著高于正常组,提示TLR4/NF-κB信号通路的活跃与AA滑膜炎和滑膜细胞增殖有密切联系。
艾灸具有温通气血、培补元气的作用[24],对缓解RA患者临床症状、减轻痛苦、既病防变方面有显著作用。研究表明,艾灸具有抑制RA滑膜细胞异常增殖和微血管增生,减轻炎症反应和缓解疼痛等作用[25-29]。文献研究显示足三里穴是 RA针灸治疗中的首选穴位[30-31]。足三里穴位于足阳明胃经,主治胃肠病证、下肢痿痹、虚劳诸证等,具有强壮作用,是保健要穴。临床研究发现艾灸配伍足三里穴区治疗 RA的总有效率超过95%[32-33]。
本研究发现艾灸AA模型大鼠足三里穴区,能够减轻足趾关节肿胀、缓解滑膜细胞增殖,并降低滑膜组织IL-1β、TNF-α、IκBα、IκKβ、NF-κB p65、Myd88、TLR4 mRNA水平,提示艾灸能有效改善AA大鼠滑膜炎症状,并抑制TLR4/NF-κB信号通路的活跃状态。因此,抑制 TLR4/NF-κB信号通路可能是艾灸发挥抗炎消肿作用的效应机制之一。然而,本研究虽证实TLR4受体成功识别后可级联反应激活NF-κB通路,导致IL-1β、TNF-α等炎性因子释放增加,但是由于缺少 TLR4特异性激活与拮抗对照观察,未能充分阐释二者内在关系,下一步需要开展 TLR4与NF-κB信号通路之间的关联性研究,以及灸法的效应因素与该通路的相关响应靶点的关系,以期进一步揭示艾灸的抗炎免疫效应机制。