miR-9通过Wnt/β-catenin信号通路调控甲状腺癌细胞侵袭和迁移的机制研究
2021-04-30王丹陈红
王丹 陈红
甲状腺癌是内分泌系统中最常见的恶性肿瘤之一,在过去的几十年中,其发病率在许多国家迅速增加[1]。尽管大多数甲状腺癌患者的预后良好,但很大一部分患者在10年内出现局部复发或远处转移[2]。因此,阐明甲状腺癌的发生和发展的分子机制极其重要,这将有助于为甲状腺癌的治疗提供有希望的靶点,对预防甲状腺癌的复发和转移至关重要。作为小型非编码RNA的微小RNA(microRNA,miRNA),由于其在基因或信号通路调控中的重要作用,几十年来一直是学者研究的重点。miRNA的表达具有明显的组织特异性,在肿瘤发生中起重要作用,因此miRNA被认为是癌症良好的生物标志物[3]。据报道,miR-9在人类多种癌症中具有多种表达模式,并且在不同类型的癌症中发挥不同的作用[4,5]。有研究发现,miR-9在复发的甲状腺癌组织中的表达显著低于未复发的患者,提示miR-9可作为甲状腺癌复发的预后生物标志物[6]。但miR-9在甲状腺癌中的作用及其相关机制尚未可知。Wnt/β-catenin信号在癌细胞中被组成性激活,参与多种恶性肿瘤的发生和转移[7,8]。研究表明,miR-9通过调控Wnt/β-catenin信号途径来调节来抑制口腔鳞状细胞癌细胞的增殖[9]。然而,目前尚不清楚miR-9是否通过调控Wnt/β-catenin信号通路在甲状腺癌中发挥作用。因此,本实验旨在探究miR-9对甲状腺癌细胞侵袭和迁移的影响及对Wnt/β-catenin信号通路的调控作用,以期为甲状腺癌的治疗提供新的作用靶点。
1 材料与方法
1.1 细胞系与主要试剂 人正常甲状腺上皮细胞系Nthyori3-1和人甲状腺癌细胞系TPC-1、MDA-T32及SW579(美国ATCC);PRIM-1640培养基、胎牛血清(美国Gibco公司);胰蛋白酶、青霉素和链霉素(美国HyClone公司);miR-9 mimics及mimis control(广州市锐博生物科技有限公司);TRIzol试剂、脂质体Lipofectamine 2000转染试剂(美国Invitogen公司);逆转录试剂盒(大连宝生物工程有限公司);SYBR Green Master Mix检测试剂盒(赛默飞世尔科技有限公司);Transwell小室、Matrigel基质胶(美国BD公司);细胞裂解液、BCA蛋白定量检测试剂盒、ECL发光试剂(上海碧云天生物科技研究所);兔抗人MMP-2、MMP-9、β-catenin和c-Myc一抗及辣根过氧化物酶标记的山羊抗兔二抗(美国CST公司)。
1.2 细胞培养 所有细胞系培养在含10%胎牛血清、1×103U/ml青霉素和100 mg/L链霉素的PRIM-1640培养液中,放置在体积分数为5%CO2、饱和湿度、37℃培养箱中培养。用显微镜观察细胞生长情况,每隔2 d更换1次培养液,待细胞贴壁生长密度达90%以上时,以0.25%胰蛋白酶消化细胞,按照1∶3的比例传代培养。
1.3 细胞转染与分组 对数期的甲状腺癌TPC-1细胞接种到6孔板中,接种密度为2×105个细胞/孔,将6孔板放置在37℃培养箱培养,第2天按照Lipofectamine 2000转染试剂使用说明书将miR-9 mimics及mimics control转染TPC-1细胞,实验分为转染(miR-9)组、阴性对照(NC)组和孔板对照(Control)组,转染6 h后更换培养液。
1.4 Real-time PCR检测miR-9的表达水平 细胞中总RNA采用TRIzol试剂进行抽提,使用超微量核酸蛋白检测仪测定RNA的纯度和浓度,参照逆转录试剂盒说明书将RNA合成第一链cDNA。将cDNA作为模板,U6作为内参基因,使用SYBR Green Master Mix检测试剂盒行Real-time PCR检测。反应程序设为:94℃预变性5 min,随后94℃变性20 s、60℃退火20 s、72℃延伸10 s,循环40次。获取目的基因和内参基因的Ct值,采用2-ΔΔCt法分析各细胞中miR-9相对表达水平。miR-9 上游引物5’-GTGCAGGGTCCGAGGT-3’,下游引物5’-GCGCTCTTTGGTTATCTAGC-3’。U6上游引物5’-CTCGCTTCGGCAGCACA-3’;下游引物5’-AACGCTTCACGAATTTGCGT-3’。
1.5 Transwell实验检测TPC-1细胞侵袭能力 Matrigel基质胶于4℃冰箱融化,加入不含血清的RPMI-1640培养液以1∶8进行稀释,取100 μl稀释的Matrigel胶滴加到Transwell小室的上室,37℃孵育4 h晾干备用。转染后的TPC-1细胞以胰酶消化,以不含血清的培养液悬浮细胞,制成调整细胞密度为2×105个/ml,Transwell小室的上室加入100 μl细胞悬液,下室中加入600 μl含10%胎牛血清的培养液,于常规培养箱培养48 h。用湿润的棉签擦去上室未穿膜的细胞,随后多聚甲醛固定15 min,结晶紫染色20 min,用PBS洗涤3次,晾干,在400倍倒置显微镜下观察并记录侵袭细胞数(随机选取5个视野),实验重复进行3次。
1.6 划痕实验检测TPC-1细胞迁移能力 转染后的TPC-1细胞培养至对数生长期,加入胰酶消化细胞,离心收集细胞,再加入细胞培养液重悬细胞,将细胞悬液接种到24孔板中,于常规培养箱过夜培养,待细胞呈单层汇合时,用灭菌的移液枪枪头在贴壁细胞中作划痕,用PBS洗涤细胞,更换新的培养液,继续培养48 h。在倒置显微镜下观察细胞划痕宽度,计算细胞迁移率,细胞迁移率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h 划痕宽度×100%。
1.7 Western blot检测TPC-1细胞中蛋白表达水平 收集转染48 h后3组TPC-1细胞,加入200 μl细胞裂解液,在冰上裂解30 min抽提总蛋白。用BCA蛋白定量检测试剂盒测定总蛋白浓度,在蛋白样品中价额上样缓冲液,沸水加热使蛋白变性,取30 μg变性蛋白加入到泳道孔,电泳分离蛋白,转膜,封闭,洗膜后加入相应一抗,MMP-2、MMP-9、β-catenin和c-Myc一抗为1∶800稀释,冰上过夜孵育,洗膜后再加入1∶2 000稀释的二抗,滴加ECL显色液,置暗室显影,曝光,使用凝胶成像系统获取图像,以GAPDH进行标定,使用Image J图像软件分析分别计算目的蛋白相对表达水平。
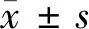
2 结果
2.1 miR-9在甲状腺癌细胞系中下调表达 Real-time PCR检测表明,与人正常甲状腺上皮细胞系Nthyori3-1相比,人甲状腺癌细胞系(TPC-1、MDA-T32和SW579)中miR-9均下调表达(P<0.05)。miR-9在甲状腺癌TPC-1细胞中的表达最低,后续研究选择TPC-1细胞进行相应实验。见表1。

表1 Real-time PCR检测不同细胞系中miR-9的表达水平
2.2 转染miR-9 mimics上调TPC-1细胞中miR-9的表达 Real-time PCR检测表明,与Control组比,NC组TPC-1细胞中miR-9表达水平差异无统计学意义(P>0.05);与NC组比,miR-9组中miR-9表达水平显著上调(P<0.05)。见表2。

表2 转染miR-9 mimis对TPC-1细胞中miR-9表达的影响
2.3 过表达miR-9抑制TPC-1细胞的侵袭能力 Transwell实验显示,与Control组比,NC组侵袭细胞数差异无统计学意义(P>0.05);与NC组比,miR-9组侵袭细胞数明显减少(P<0.05)。见图1,表3。

图1 Transwell实验检测3组TPC-1细胞侵袭能力(结晶紫染色×200)

表3 3组侵袭细胞数比较
2.4 过表达miR-9抑制TPC-1细胞的迁移能力 划痕实验显示,与Control组比,NC组TPC-1细胞迁移率差异不显著(P>0.05);与NC组比,miR-9组TPC-1细胞迁移率明显降低(P<0.05)。见图2,表4。

表4 3组TPC-1细胞迁移率比较

图2 划痕实验检测3组TPC-1细胞迁移能力(×40)
2.5 过表达miR-9抑制MMP-2和MMP-9的表达及Wnt/β-catenin信号通路的激活 Western blot检测显示,与Control组比,NC组TPC-1细胞中MMP-2、MMP-9、β-catenin和c-Myc的表达水平差异均不显著(P>0.05);与NC组比,miR-9组TPC-1细胞中MMP-2、MMP-9、β-catenin和c-Myc的表达水平均明显下调(P<0.05)。见图3,表5。

图3 Western blot检测3组TPC-1细胞中MMP-2、MMP-9、β-catenin和c-Myc蛋白表达

表5 3组TPC-1细胞中MMP-2、MMP-9、β-catenin和c-Myc蛋白水平比较
3 讨论
据报道,miRNA参与多种生物过程,例如细胞生长、凋亡、侵袭、迁移、代谢和细胞分化[10]。研究表明,miRNA表达的改变与甲状腺癌的发生、发展和转移有关,并且可以作为甲状腺癌的诊断标记或治疗剂[11]。例如,miR-146b通过抑制PTEN并激活信号通路(PI3K/AKT)促进甲状腺癌细胞的增殖、迁移和侵袭,并减少细胞凋亡,促进甲状腺癌的进展[12]。Zhao等[13]发现,在甲状腺癌标本中miR-340-5p呈异常过表达,miR-340-5p的过表达明显增强了细胞活力和集落形成。Li等[14]发现,miR-212可通过靶向SIRT1抑制甲状腺癌TPC-1细胞的增殖、迁移和侵袭,在甲状腺癌中发挥抑癌作用。在甲状腺癌组织和正常组织中发现了不同的miRNA表达谱,这种现象表明miRNA在甲状腺癌发生中的关键作用[15]。近期研究发现,miR-9表达下调与宫颈癌、肺癌和乳腺癌的转移复发相关[16-18]。目前已确定miR-9在甲状腺癌组织中表达下调[19]。本研究发现,miR-9在甲状腺癌细胞系中表达下调,在甲状腺癌TPC-1细胞中转染miR-9 mimics,Real-time PCR检测结果发现转染miR-9 mimics能够明显上调miR-9的表达。Transwell和划痕实验显示,miR-9的过表达显著抑制甲状腺癌TPC-1细胞侵袭和迁移。目前多项研究显示,参与甲状腺癌细胞侵袭和迁移的基质金属蛋白酶主要包括MPP-2和MMP-9,MPP-2和MMP-9的表达水平的高低与细胞侵袭和转移能力的大小呈正相关[20,21]。本实验Western blot检测结果表明,过表达miR-9可明显下调MPP-2和MMP-9蛋白表达,这提示过表达miR-9能够降低TPC-1细胞侵袭和迁移能力。本实验以上这些结果表明,miR-9可能是甲状腺癌的潜在治疗靶标。
Wnt/β-catenin信号通路是经典的Wnt信号转导途径,也是目前研究最多的信号通路,在机体的生长和发育中扮演重要角色[22]。β-catenin在Wnt/β-catenin信号通路中处于中心位置,其表达量及状态标志着该信号通路激活与否,当β-catenin表达量升高时转位至细胞核,与相应转录因子形成转录激活复合物,诱导下游分子如c-Myc的表达。当前研究表明,Wnt/β-catenin信号通路在人类多种恶性肿瘤中异常激活,促进肿瘤的浸润和转移[23]。据报道,在甲状腺癌组织和细胞中中β-catenin的表达水平均明显上调,且在分化型甲状腺癌中的表达水平明显高于未分化的型甲状腺癌[24]。Wnt/β-catenin途径在甲状腺癌侵袭和转移中起着至关重要的作用。miRNA的基本功能是通过调控信号通路来实现的。在本项研究中,Western blot检测结果显示,过表达miR-9能够明显降低Wnt/β-catenin信号通路关键分子β-catenin及下游分子c-Myc的表达,这提示过表达miR-9能够抑制Wnt/β-catenin信号通路的激活。表明过表达miR-9后TPC-1细胞侵袭和迁移能力减弱与Wnt/β-catenin信号通路的激活抑制有关。
综上所述,miR-9在甲状腺癌细胞系中下调表达,过表达miR-9降低甲状腺癌TPC-1细胞侵袭和迁移能力,这与抑制Wnt/β-catenin信号通路的激活有关。这些结果表明,miR-9可能是甲状腺癌治疗潜在的治疗靶标。
