miRNA-22在心肌肥厚大鼠中的表达及对PTEN、SERCA的调控作用
2021-04-30邓丹
邓丹
研究心肌肥厚的病理机制,一直都是心血管疾病研究的重点。据报道,心肌肥厚受多种信号通路调节,包括钙调神经磷酸酶/细胞核因子、转化生长因子、肌浆网钙泵(Sarcoplasmic reticulum calcium adenosine triphosphatase,SERCA)、磷酸酶基因(phosphatase and tensin homolog)、钙调神经磷酸酶(Calcineurin,CaN)等,而这些信号通路的促进或抑制作用与微小RNA(microRNA,miRNA)有关[1]。miRNA是一种内源性非编码的单链小RNA,转录后对基因表达具有负性调节的作用。文献显示,miRNA在心肌细胞生理病理过程中扮演着重要角色[2]。微小RNA-22(microRNA-22,miRNA-22)是miRNA家族中的一员,可通过调控靶基因c-Myc、MYCBP信号通路发挥抑癌作用[3],能够增强食管癌细胞放疗的敏感性[4],在癌症中研究较多。研究显示,miRNA-22与心肌肥厚有关[5]。凌琳等[6]研究发现,高表达的miRNA-22能够改善心脏运动能力和收缩功能,抑制心肌细胞纤维化。Xu等[7]研究认为,miRNA-22促进心肌肥大可能与PTEN基因通路有关。Gurha等[8]研究发现敲除miRNA-22的小鼠SERCA活性降低。基于此,本研究采用腹主动脉缩窄术制备心肌肥厚大鼠模型,观察降低或增加miRNA-22表达对PTEN、SERCA及心肌肥厚相关信号通路蛋白的调控作用,以期为阐明心肌肥厚发病机制提供依据。
1 材料与方法
1.1 心肌肥厚大鼠模型的构建 60只雄性Sprague-Dawley大鼠(SPF级),体重180~210(194.5±2.3)g,4~6(5.1±0.2)周龄,随机分为2组,观察组50只,对照组10只,采用腹主动脉缩窄术构建心肌肥厚大鼠模型。观察组采用10%的水合氯醛腹腔麻醉,无菌分离肾动脉和腹主动脉,于肾动脉上方约1 cm处,采用5.0型无菌尼龙缝合线将肾动脉与注射针管(外径0.7 mm)结扎,迅速移除针管。术后每天注射5 U青霉素,持续5 d。对照组处理同观察组,不做丝线结扎。
1.2 心肌肥厚指标测定
1.2.1 术后7周,采用彩色多普勒超声诊断仪测定左心室收缩末期左心室内径(LVESD)、左心室舒张末期内径(LVDd)、左心室后壁舒张末期厚度(LVPWTd)和隔舒张末期厚度(IVSTd)。
1.2.2 观察组50只大鼠随机分为3组,A组20只,用于miRNA-22转染;B组20只,用于mi-RNA-22基因敲除;C组10只,用于心肌肥厚大鼠的表征及mi-RNA-22、SERCA、PTEN的测定。
1.2.3 处死C组和对照组大鼠,快速取出心脏,预冷的0.9%氯化钠溶液冲洗,剪掉心脏周围的组织,滤纸吸干,分离游离臂和室间隔,将左心室称重,然后见成小块,每只取2块采用10%甲醛浸泡,用于组织学检查;剩余置于冻存管中,液氮速冻后,置于-80℃冰箱保存。
1.3 HE染色 将甲醛浸泡48 h的组织样品,采用乙醇脱水,石蜡包埋,旋切机切片后,进行标准的HE染色。然后在显微镜下观察两组的组织病理学表现。
1.4 miRNA-22、PTEN、SERCA表达测定 取冷冻的心肌组织,Trizol法提取总RNA,检测浓度和纯度。Taqman探针法测定miRNA-22,引物设计和合成由Invitrogen公司进行:逆转录反应体系:Taqman探针(10 μmol /L)0.10 μl、rTaq DNA 聚合酶(5 000 kU/L) 0.25 μl、2×Real-time PCR Mix 10 μl、Primer Set(20 μmol/L) 0.40 μl,RNase-free去离子水7.30 μl,逆转录产物2.00 μl,总共20 μl。反应条件:90℃/3 min,95℃/12 s,62℃/40 s,共40个循环。采用实时荧光定量PCR法测定miRNA-22的Ct值,miRNA-22的相对表达量以2-△Ct(miRNA-22-内参)表示。
1.4.1 逆转录/聚合酶链式反应(RT-PCR法)测定PTEN水平:逆转录反应体系:引物各10 pmol/L,KCl 50 mmol/L,pH8.4的Tris-HCl 10 mmol/L, sangon Taq DNA聚合酶2.5U, MgCl22 mmol/L,Dntp 0.2 mmol/L,共50 μl。反应条件:93℃/3 min后进入循环, 94℃/45 s,58℃/30 s,72℃/30 s,共35个循环。采用PTC-100热循环仪扩增,扩增产物进行琼脂糖凝胶电泳分离。采用分析软件ScanImage测定条带密度,采用条带密度比值(PTEN/NADPH)表示PTEN的相对含量。
1.4.2 逆转录/聚合酶链式反应(RT-PCR法)测定SERCA水平。3’;SERCA:上游引物5’-TGAATAAACCGCCTCGG-3’,上游引物5’-CAGCACCATCAG CCACT-3’。严格按照试剂盒说明书操作。cDNA合成37℃/30min,预变性94℃/2min,55℃退火30 s,72℃延伸60 s,共30个循环。最后72℃延伸5 min。采用PTC-100热循环仪扩增,扩增产物进行琼脂糖凝胶电泳分离。采用分析软件ScanImage测定条带密度,采用条带密度比值(SERCA/NADPH)表示SERCA的相对含量。
1.5 miRNA-22转染 A组20只大鼠,心肌肥厚模型构建成功后,在心肌肥厚区域均匀分5点,注射表达microRNA-22 腺病毒/空载体腺病毒(adeno-miR-22/adeno-null,由Invitrogen公司构建并证实转染效率),病毒量约为0.1 ml(2×1012viral particles/L)。病毒转染后常规饲养4周。处死,取心脏组织测定miRNA-22、PTEN、SERCA表达情况。
1.6 基因敲除 B组20只大鼠,心肌肥厚模型构建成功后,进行miRNA-22基因敲除,然后常规饲养4周。处死,取心脏组织测定miRNA-22、PTEN、SERCA表达情况。
1.7 Western blot检测心肌CaN、SERCA2a、CaMKⅡ蛋白表达 取A组、B组和C组冷冻的心肌组织,采用western blot测定CaN、SERCA2a、CaMKⅡ蛋白表达水平。
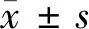
2 结果
2.1 心肌肥厚大鼠组织学表现 显微镜下可见观察组心肌细胞直径增大。见图1。
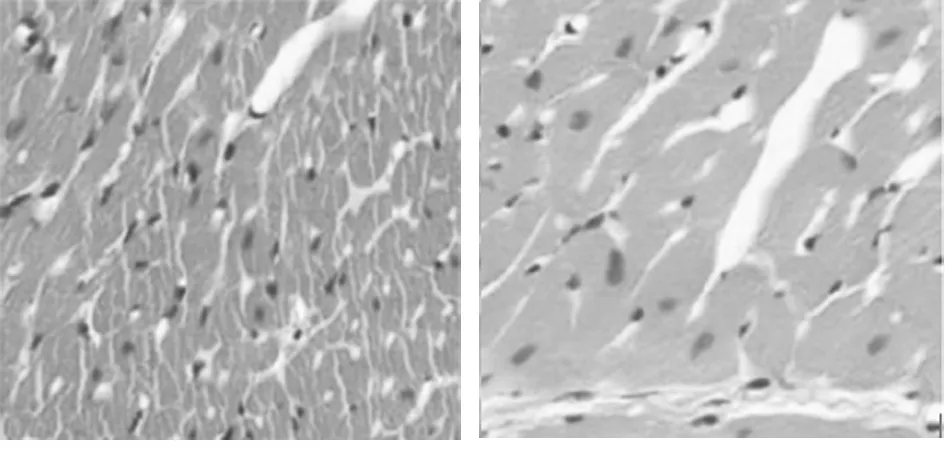
图1 2组造模后大鼠心肌细胞HE染色图(×400);A 对照组;B 观察组
2.2 观察组与对照组心肌指标比价 C组全心质量、左心室质量、LVDd、IVSTd、LVESD、LVPWTd高于对照组,差异具有统计学意义(P<0.05),表明心肌肥厚大鼠造模成功。见表1。
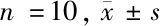
表1 2组大鼠心肌指标比较
2.3 2组大鼠miRNA-22、PTEN、SERCA表达比较 C组miRNA-22表达高于对照组,PTEN、SERCA表达低于对照组,差异有统计学意义(P<0.05)。见表2。
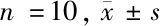
表2 2组大鼠miRNA-22、PTEN、SERCA表达比较
2.4 上调miRNA-22对心肌肥厚大鼠PTEN、SERCA表达的影响 A组miRNA-22表达高于C组(P<0.05),miRNA-22表达显著上调。A组PTEN、SERCA低于C组,差异有统计学意义(P<0.05)。见表3。

表3 2组大鼠miRNA-22、PTEN、SERCA表达比较
2.5 下调miRNA-22对心肌肥厚大鼠PTEN、SERCA表达的影响 B组miRNA-22表达低于C组(P<0.05),miRNA-22表达显著下调。B组PTEN、SERCA高于C组,差异有统计学意义(P<0.05)。见表4。

表4 2组大鼠miRNA-22、PTEN、SERCA表达比较
2.6 miRNA-22表达变化对CaN、SERCA2a、CaMKⅡ蛋白表达的影响 3组大鼠心肌细胞CaN、ANP、SERCA2a、CaMKⅡ蛋白表达差异有统计学意义(P<0.05),组间两两比较显示,CaN、CaMKⅡ比较A组>C组>B组; SERCA2a比较A组 表5 3组大鼠CaN、ANP、SERCA2a、CaMKⅡ蛋白表达水平比较 心肌肥厚是心血管疾病的独立危险因素,也是心功能衰竭的病理基础。抑制心肌肥厚有助于心血管疾病的疾病的防治,降低发病率和死亡率[9]。研究显示,miRNA在心肌肥厚中扮演着重要角色[10]。庞志宇等[11]研究发现,共16种miRNA在心肌肥厚大鼠心肌组织中异常表达,其中包含miRNA-22。动物实验显示,miRNA-22心脏过表达是引起心肌肥厚的重要原因[12],但相关机制研究报道较少。 miRNA-22在卵巢癌、食管鳞状细胞癌、肺癌中特异性表达,广泛参与癌细胞的增殖、迁移和侵袭过程[13]。吴德佩[14]发现miRNA-22靶向PTEN/AKT/mTOR信号通路调控自噬及糖尿病肾病肾间质纤维化。随着研究的深入,人们发现miRNA-22与心脏疾病有关,在主动脉弓缩窄压力负荷模型中,microRNA-22(-/-)小鼠心脏扩张加剧、收缩功能失代偿严重,同时伴有心肌纤维化。凌琳等[6]认为心肌梗死后高表达的miRNA-22能够改善心肌结构和运动能力,减轻心肌纤维化。本研究采用腹主动脉狭窄术制备压力超负荷心肌肥厚动物模型心肌miRNA-22高表达,与前人[15]研究结果一致。生物学信息显示,miRNA-22通过结合T管生物起源关键蛋白的基因3’UTR的保守集合序列影响T管的发育,且葛根素会影响miRNA-22的表达,具体机制尚不明确。因此,miRNA-22在心肌肥厚大鼠中高表达的原因有待于进一步研究。 CaN、SERCA2a、CaMKⅡ蛋白是心肌肥厚发病中的关键因子,其水平的高低显著影响心肌肥厚的疾病进展。本研究观察发现,miRNA-22(+/-)显著影响CaN、SERCA2a、CaMKⅡ蛋白的表达,miRNA-22表达上调的心肌细胞CaN、CaMKⅡ表达上调,SERCA2a表达下调,反之亦然。钙/钙调蛋白激酶/钙调神经磷酸酶(Ca/CaMK/CaN)途径是调控心肌肥厚发病的重要信号通路之一,CaN、CaMKⅡ是该信号通路中的重要蛋白。在该信号通路调控中,随着钙离子内流导致细胞内钙离子浓度升高,从而激活钙调蛋白激酶II(CaMKⅡ)、CaN,导致CaN 、CaMKⅡ活性和表达量增加,促进心肌肥大[16]。SERCA2a则是一种大分子跨膜蛋白,在心肌肥大时发挥维持胞浆钙稳态的作用。已有研究[17]显示,SERCA2a 在终末期心力衰竭患者心脏中表达下调,且与心脏收缩和舒张功能有关。研究显示,心力衰竭、心肌肥大者SERCA2a在mRNA和蛋白水平方面均下调,导致胞浆对钙离子的吸收和摄取减慢,进而影响心肌舒张和收缩能力,并通过激活钙相关通路,促进心肌肥大[18]。 miRNA-22是具有调控作用点作用的非编码RNA,本研究结果显示miRNA-22心脏过表达会引起心肌肥厚,具体机制不明。李国然等[19]采用TargetScan等工具预测,SIRT1、PTEN、NAT5、HDAC4 和SRF可能是miRNA-22调控心肌肥厚的潜在靶基因。亦有研究指出,miRNA-22可通过影响SR钙操纵蛋白参与心肌肥厚进展[20]。本研究观察miRNA-22(+/-)对PTEN、SERCA基因通路的影响,结果显示,心肌肥厚大鼠miRNA-22表达上调,PTENmRNA、SERCAmRNA表达下调,呈负性关系。继续上调心肌肥厚大鼠miRNA-22表达,PTENmRNA、SERCAmRNA表达持续下调,反之PTENmRNA、SERCAmRNA表达增加,提示miRNA-22与PTEN、SERCA基因之间呈负性调节的关系。细胞试验显示,下调miRNA-22表达可通过抑制PTEN、SERCA信号通路而抑制心肌肥大[21,22]。PTEN为磷酸酶,在能够拮抗PI3K,催化PIP3脱磷酸,下调PIP3水平,从而逆转PI3K对PKB/AKT磷酸化,维持胞浆钙稳定。当miRNA-22表达上调,通过特异性作用于靶基因PTEN,PTEN表达下降,PI3K对PKB/AKT磷酸化作用增强,钙离子内流,胞浆钙浓度升高,Ca/CaMK/CaN信号通路激活,因而CaN、CaMKⅡ蛋白表达上调。SERCA是影响钙离子内流的另一信号通路,Gurha等[8]发现基因敲除小鼠SERCA活性及表达量降低,SR钙储存量减少。分析认为,miRNA-22上调抑制富嘌呤元素相关蛋白PURB的表达,使得抑制状态的SRF持续抑制,SRF与SERCA结合减少,导致SERCA基因及SERCA2a蛋白的表达降低。随着SERCA表达的持续减少,胞浆钙增多,相应 CaN、CaMKⅡ蛋白表达上调。 综上所述,miRNA-22在心肌肥厚中高表达,上调miRNA-22能够增加心肌细胞CaN、CaMKⅡ蛋白表达、降低SERCA2a表达,从而促进心肌肥厚,可能与抑制PTEN、SERCA基因通路有关。
3 讨论
