慢性阻塞性肺疾病合并肺间质纤维化患者外周血及诱导痰上清中炎性细胞因子分析及意义
2021-04-26石永传周璇徐丽夏元旦沈美珠沈卫华冒长青肖春海周敏
石永传,周璇,徐丽,夏元旦,沈美珠,沈卫华,冒长青,肖春海,周敏
1.上海市第六人民医院金山分院药剂科,上海201500;2.上海市第六人民医院金山分院呼吸科,上海201500;3.上海市金山区众仁老年护理医院内科,上海201501
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)为阻塞性肺疾病,肺间质纤维化(pulmonary interstitial fibrosis,PIF)则属于限制性肺疾病,各有其自身病理及影像学特征。最新研究成果显示,COPD 后期不再以肺气肿为主要表现,而是逐渐发生了肺间质的纤维化改变,PIF 是COPD 进展到一定程度后必然发生的改变[1]。现在一般认为COPD合并PIF 是支气管、肺反复感染,启动炎症反应过程,由免疫细胞、介质及细胞因子参与而造成的慢性炎症损伤和免疫修复反应[2]。作者通过检测分析COPD 合并PIF 患者的外周血炎性细胞因子水平特点,观察其炎症特征,为COPD 合并PIF 患者的诊断与防治提供依据。
1 资料与方法
1.1 一般资料 选择2015年7月1日-2017年6月30日在上海市第六人民医院金山分院呼吸科就诊符合COPD 诊断[3]同时影像学上符合肺间质纤维化征象诊断为COPD 合并肺间质纤维化的患者纳入研究(设为观察组);选择同期符合慢性COPD 诊断标准的无合并症患者作为对照组。观察组81 例,男性60 例,女性21 例,年龄50~73 岁,平均年龄(61.4±11.1)岁;对照组81 例,男性57 例,女性24 例,年龄60~78岁,平均年龄(69.8±8.3)岁。2 组性别和年龄差异均无统计学意义(P>0.05),具有可比性。进一步将81例COPD 合并肺间质纤维化患者分为老年亚组(≥60岁,46 例)及非老年亚组(<60 岁,35 例)。本研究得到上海市第六人民医院金山分院医学伦理委员会的批准。
1.2 纳入与排除标准 纳入标准:(1)根据COPD 的诊断要求,凡符合肺功能检查标准,即吸入支气管舒张剂后FEV1/FVC<70%即明确存在持续的气流受限,除外其他疾病后可确诊为COPD;(2)参照我国《特发性肺纤维化诊治循证指南》[4]中HRCT 对肺间质纤维化诊断价值的推荐,符合COPD 的诊断标准,在此基础上出现肺部velcro 啰音或见杵状指,肺功能测定结果不完全符合阻塞性或限制性通气功能障碍,且肺HRCT 显示肺气肿和肺间质纤维化双重特点者诊断为COPD 合并肺间质纤维化(COPD+PIF);(3)签署知情同意书。符合上述全部标准的患者纳入本研究。排除标准:(1)有严重心、肝、肾功能不全;(2)血液系统恶性疾病、各系统晚期肿瘤;(3)胸、腹外科大手术后;(4)中途失访无法追踪或未能完成疗程者。具备上述任意1 项标准的患者不纳入本研究。
1.3 观察指标与方法
1.3.1 外周血清及诱导痰上清的制备 以柠檬酸钠真空采血管采患者晨起空腹外周静脉血5 mL,室温下放置30 min 后混合20 min,以3000 r/min 低温离心后保存在-80℃冰箱中待检。采用超声雾化吸入高渗盐水诱导患者咳痰,操作参考中华医学会呼吸病学分会哮喘学组2015年发布的《咳嗽的诊断与治疗指南》[5]将痰液置于旋涡混合器上混匀,加入4 倍体积的0.1%二硫苏糖,以3000 r/min 离心10 min,吸取上清液,按照逐步冷冻法(4℃,10 min;-20℃,30 min;-80℃)长期保存待测。
1.3.2 外周血清及诱导痰上清中细胞因子的检测 ELISA 方法检测与COPD 早期肺泡炎相关的白介素8(interleukin-8,IL-8)及肿瘤坏死因子 (tumor necrosis factors-,TNF-)、与COPD 早期纤维化相关的结缔组织生长因子(connective tissue growth factor,CTGF)、转化生长因子(transforming growth factor-,TGF-)及内皮素1(endothelin-1,ET-1)水平。
1.4 统计学方法 统计学分析数据用SPSS21.0 软件进行统计。以均数±标准差(±s)表示计量资料,经正态性检验与方差齐性检验后,正态分布且方差齐性的计量资料,2 组间比较行独立样本t 检验,组内比较用配对样本t 检验;偏态分布的资料采取秩和检验。以例数和百分率表示计数资料,采用检验。P<0.05表示数据差异有统计学意义。
2 结果
2.1 2 组患者外周血清及诱导痰上清中炎性细胞因子水平比较 观察组外周血清中IL-8、TNF-、TGF-及ET-1 水平高于对照组,但2 组比较差异无统计学意义(P>0.05)。观察组外周血清中CTGF 水平高于对照组,2 组比较差异有统计学意义(P<0.05)。观察组诱导痰上清中IL-8 和TNF-水平高于对照组,但2 组比较差异无统计学意义(P>0.05)。观察组诱导痰上清中CTGF、TGF- 1 及ET-1 水平高于对照组,2 组比较差异有统计学意义(P<0.05)。见表1。
表1 2 组患者外周血清及诱导痰上清中炎性细胞因子水平比较(±s)

表1 2 组患者外周血清及诱导痰上清中炎性细胞因子水平比较(±s)
组别 外周血清(pg/mL)IL-8 TNF- CTGF TGF- 1 ET-1诱导痰上清(pg/mL)IL-8 TNF- CTGF TGF- 1 ET-1观察组( =81)对照组( =81)images/BZ_72_263_760_285_784.png243.17±48.63 226.42±41.74 2.35 0.20 56.14±14.72 53.72±13.13 1.10 0.27 270.01±68.63 187.78±77.82 1.95 0.04 179.26±74.57 169.19±36.86 0.38 0.71 50.49±22.06 43.93±10.79 0.85 0.41 54.20±19.68 45.17±19.69 1.56 0.13 57.63±22.50 53.33±20.15 0.61 0.55 14.65±4.10 10.66±3.05 2.74 0.01 167.10±21.35 110.67±37.53 4.13 0.01 33.85±10.86 22.65±6.33 2.81 0.01
2.2 老年亚组及非老年亚组患者外周血清及诱导痰上清中炎性细胞因子水平比较 老年亚组外周血清中IL-8、TNF-和TGF-水平高于非老年亚组,但2 组比较差异无统计学意义(P>0.05)。老年亚组外周血清中CTGF 和ET-1 水平高于非老年亚组,且2 组比较差异有统计学意义(P<0.05)。老年亚组诱导痰上清中IL-8 和TNF-水平高于非老年亚组,但2 组比较差异无统计学意义(P>0.05)。老年亚组诱导痰上清中CTGF、TGF-及ET-1 水平高于非老年亚组,2组比较差异有统计学意义(P<0.05)。见表2。
表2 2 亚组患者外周血清及诱导痰上清中炎性细胞因子水平比较(±s)
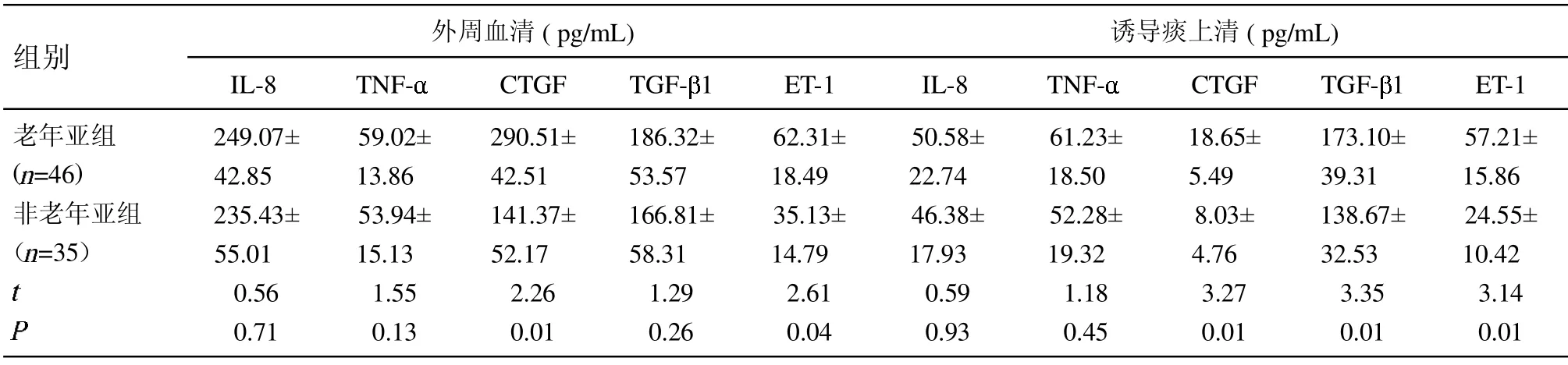
表2 2 亚组患者外周血清及诱导痰上清中炎性细胞因子水平比较(±s)
组别 外周血清(pg/mL)IL-8 TNF- CTGF TGF- 1 ET-1诱导痰上清(pg/mL)IL-8 TNF- CTGF TGF- 1 ET-1老年亚组( =46)非老年亚组(=35)images/BZ_72_263_1345_285_1368.png249.07±42.85 235.43±55.01 0.56 0.71 59.02±13.86 53.94±15.13 1.55 0.13 290.51±42.51 141.37±52.17 2.26 0.01 186.32±53.57 166.81±58.31 1.29 0.26 62.31±18.49 35.13±14.79 2.61 0.04 50.58±22.74 46.38±17.93 0.59 0.93 61.23±18.50 52.28±19.32 1.18 0.45 18.65±5.49 8.03±4.76 3.27 0.01 173.10±39.31 138.67±32.53 3.35 0.01 57.21±15.86 24.55±10.42 3.14 0.01
3 讨论
COPD 是一种慢性咳嗽、咳痰、气喘并进行性加重的以持续性气流受限为特征的慢性气道疾病[3],而PIF 是间质性肺病(interstitial lung disease,ILD)各种类型中的一种,一般起始于肺泡壁炎症,继之肺间质形成大量纤维结缔组织及肺结构紊乱。迄今为止,虽然针对肺间质病变进行了大量基础及临床方面的研究,但由于这类疾病的复杂性,在其发病原因、机制方面还有很多环节模糊不清,治疗方面的局限性在临床上给这类患者带来了极大的不便[6]。
一般认为,COPD 与PIF 这2 种疾病不能共存,COPD 以阻塞性通气功能障碍为特征,而和PIF 表现为限制性通气功能障碍,在临床特点、病理变化、治疗及预后等方面均截然不同。COPD 合并PIF 发生机制迄今为止不甚明确,现在一般认为与支气管、肺反复感染后启动炎症反应过程有关,由免疫细胞、介质及细胞因子参与而造成的慢性炎症损伤和免疫修复反应。在这个过程中炎症损伤和免疫修复导致过量的细胞外基质(ECM)沉积,成纤维细胞增生,在T 细胞、血管内皮细胞等众多炎性细胞及炎性介质参与下,气道黏液过度分泌、气道壁平滑肌的增厚、小气道狭窄、肺间质弹性纤维断裂、肺泡腔扩大等不可逆性病理改变,最终导致肺组织结构重塑,促进肺纤维化形成。IL-6、TNF-及CTGF 被证明是参与早期肺泡炎和后期肺纤维化的形成及维持的重要的细胞因子[7-10];TGF、PDGF、IGF-1、ET-1、IL-4、IL-8 和IL-17等细胞因子与肺间质纤维化的发生发展密切相关[11-12],且TGF-被认为具有核心地位的细胞因子[13-14]。
本次通过对81 例COPD 合并PIF 患者临床研究显示,除COPD 合并肺间质纤维化患者表现为2 者的共有特征外,还有其独特炎症特征。研究表明COPD合并PIF 组患者痰上清中CTGF、TGF- 1 及ET-1 及外周血清中CTGF 水平高于单纯COPD 患者组,且在老年亚组中升高更为明显,这与老年性COPD 临床特征一致,即老年组整体发作的次数明显高于非老年组[15-16]。
综上,我们认为COPD 及肺间质纤维化的形成是一个慢性过程,当肺损伤后,肺泡渗出物包含CTGF、TGF- 1、TNF- 、ET-1 与IL-8 等多种细胞因子的持续存在,逐步向瘢痕转化,引起气道重塑[17],提示我们对COPD 患者应该尽早辨识PIF 的存在并尽早给予积极的防治,早期干预,减轻机体的炎症反应,抑制纤维化的发展,以减缓病程并改善患者的生活质量。本研究囿于观察的样本量,今后将增加观察的样本量,对本研究的结论进行验证和完善。
