LRRC1通过DLG1/YAP信号通路促进肝癌细胞增殖的研究
2021-04-25奚小荔周浩雄杨碧兰吴斌杨逸冬
奚小荔?周浩雄?杨碧兰?吴斌?杨逸冬
【摘要】目的 研究富含亮氨酸的重復序列蛋白1(LRRC1)通过巨盘状蛋白1(DLG1)/Yes相关蛋白(YAP)信号通路调节肝癌细胞增殖的机制。方法 在原发性肝细胞癌患者的癌灶组织及配对癌旁组织中,检测LRRC1的表达水平。使用小干扰RNA(siRNA)抑制HepG2及Huh7中LRRC1的表达后,检测细胞增殖能力及YAP、细胞周期蛋白D1(Cyclin D1)和细胞周期蛋白依赖性激酶4(CDK4)表达水平。通过共聚焦显微镜,定位HepG2细胞中LRRC1与DLG1分布。结果 肝细胞癌患者癌灶中LRRC1表达量较癌旁组织升高。siRNA 抑制HepG2及Huh7细胞中LRRC1基因表达后,细胞增殖能力受到抑制,YAP、Cyclin D1及CDK4表达水平下降。镜下发现HepG2细胞中LRRC1与DLG1均主要分布于细胞膜内侧面,两者分布位置高度重叠。结论 LRRC1通过DLG1/YAP信号通路调控细胞周期,促进肝癌细胞增殖。
【关键词】肝细胞癌;富含亮氨酸的重复序列蛋白1;巨盘状蛋白1;细胞周期;增殖
LRRC1 promotes proliferation of hepatocellular carcinoma cells via DLG1/YAP signaling pathway Xi Xiaoli, Zhou Haoxiong, Yang Bilan, Wu Bin, Yang Yidong. Department of Gastroenterology, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Yang Yidong, E-mail: yangyd6@ mail. sysu. edu. cn
【Abstract】Objective To investigate the mechanism of leucine-rich repeat-containing protein 1 (LRRC1) in regulating the proliferation of hepatocellular carcinoma (HCC) cells through the discs large MAGUK scaffold protein 1/Yes associated transcriptional regulator (DLG1/YAP) signaling pathway. Methods The expression levels of LRRC1 protein in the cancer tissues and paired adjacent tissues of HCC patients were detected by Western blot and immunohistochemistry. After down-regulating the expression levels of LRRC1 protein by using small interfering RNA (siRNA) in liver cancer cell lines HepG2 and Huh7, cell proliferation ability was detected by cell counting kit-8 (CCK-8 kit) for three times. The expression levels of YAP protein, Cyclin D1 and cyclin dependent kinase 4 (CDK4) were detected by Western blot. Finally, the distribution of LRRC1 and DLG1 proteins expressed in HepG2 cells was located by immunofluorescence under confocal microscope. Results The expression level of LRRC1 protein in the cancer tissues of HCC patients was significantly higher than that in the paired adjacent tissues. After down-regulating the expression levels of LRRC1 protein in both HepG2 and Huh7 cell lines by siRNA, the cell proliferation ability was significantly inhibited, and the expression levels of YAP protein, Cyclin D1 and CDK4 were down-regulated. Confocal microscope demonstrated that LRRC1 and DLG1 proteins were mainly distributed on the inner surface of HepG2 cell membrane. The distribution patterns of them were highly overlapped. Conclusions LRRC1 can regulate the cell cycle through the DLG1/YAP signaling pathway, thereby promoting the proliferation of HCC cells.
【Key words】Hepatocellular carcinoma;Leucine-rich repeat-containing protein 1;
Discs large MAGUK scaffold protein 1;Cell cycle;Proliferation
肝细胞癌是肝癌最主要的病理分型,具有高发病率及高病死率的特点,但是,肝细胞癌的具体分子发病机制尚不明确。既往研究显示,肝细胞癌与其他上皮来源的恶性肿瘤类似,组织结构改变以及细胞极性丢失是导致肝细胞癌发生、发展的重要机制,而极性蛋白LAP家族具有维持组织正常结构和细胞极性的重要功能,其功能异常或者异常表达参与了多种肿瘤的发生、发展[1]。富含亮氨酸的重复序列蛋白1(LRRC1)是一种524个氨基酸的蛋白,也称为LANO蛋白,其属于LAP蛋白家族[2]。研究显示,LRRC1在肝癌中具有促进癌细胞增殖的作用,但未对其具体分子机制进行进一步研究[3]。我们既往的肝癌基因芯片表达谱研究显示,LRRC1在肝癌患者癌灶中异常高表达[4]。因此本研究旨在探索LRRC1是否影响肝癌的发生、发展及其可能存在的相关分子机制。
材料与方法
一、材料来源
肝细胞癌组织样品共10例,收集2014年4月至12月在中山大学附属第三医院通过肝细胞癌手术切除的病理组织标本,配对癌旁组织在距离肝癌癌灶边缘2 cm以上区域收集,通过HE染色对所有组织标本进行病理确认。依据中山大学附属第三医院临床医学研究伦理委员会制定的临床伦理学标准进行样本收集,亦获得伦理委员会的批准(中大附三医伦[2014]2-7号),标本收集前已获取患者的知情同意及签署知情同意书。
二、实验试剂及仪器
1.主要试剂及抗体
LRRC1抗体(GeneTex, 美国),巨盘状蛋白1(DLG1)抗体(Santa Cruz, 美国),Yes相关蛋白(YAP)、细胞周期蛋白D1(Cyclin D1)、细胞周期蛋白依赖性激酶4(CDK4)抗体(CellSignaling Technology, 美国),β-actin抗体(Sigma-Aldrich, 美国),LRRC1 小干扰RNA(siRNA)(上海吉玛制药技术有限公司),DAPI试剂(Invitrogen, 美国),DAB显色液(DAKO, 丹麦;CCK-8试剂盒(Dojindo, 日本);Lipofectamin 2000(Invitrogen, 美国)。DMEM培养液(Gibco, 美国)、胎牛血清(Gibco, 美国)、肝癌细胞系HepG2及Huh7由中山大学附属第三医院中心实验室惠赠。
2.主要仪器
NanoDrop2000微量紫外分光光度计(Thermo-Scientific,美国),PCR仪(Labnet,美国),SDS-PAGE电泳槽(BIO-RAD, 美国),转膜仪(BIO-RAD, 美国),显微镜成像系统(Leica, 德國),激光共聚焦显微镜(Leica, 德国)等。
三、实验方法
1.免疫组织化学染色及免疫细胞荧光染色后激光共聚焦显微镜观察
肝癌病理标本切小块,甲醛固定后,经过70%、95%、100%不同浓度乙醇阶梯脱水,二甲苯组织透明后,浸蜡包埋,切片制成石蜡切片。石蜡切片后经二甲苯脱蜡和100%、95%、70%不同浓度乙醇梯度水化后,放置于3%H2O2中10 min消除切片组织中的过氧化物酶,在Tris-EDTA抗原修复液(pH 9.0)中高压抗原修复2 min,加入稀释后的抗LRRC1(1∶100)一抗4℃孵育过夜;磷酸盐吐温缓冲液(PBST)浸泡5 min后,二抗37℃孵育2h,PBST浸泡15 min,滴加DAB进行显色反应,适时以适量超纯水清洗终止显色反应,苏木素染核后,进行树脂封片,并于显微镜下观察。HepG2种于35 mm玻底皿,使用细胞培养液(DMEM和10%胎牛血清)培养,细胞密度达40%后,使用磷酸盐缓冲液(PBS)洗涤3次,使用4%多聚甲醛室温固定20 min,加入0.5%曲拉通;加入稀释后的一抗:抗LRRC1(1∶100)及抗DLG1(1∶100)4℃孵育过夜,PBS洗涤3次后加入488 nm及594 nm波长的二抗,避光条件下37℃孵育2 h,PBS洗涤3次,DAPI染核后,PBS洗涤3次,使用激光共聚焦显微镜观察。
2.细胞培养及处理
将HepG2及Huh7细胞分别接种于6孔板中,使用细胞培养液培养,待细胞密度达60%后,细胞分别予空白对照siRNA(siNC组)及LRRC1基因沉默siRNA(siLRRC1组)处理细胞,每组3个重复孔,转染操作流程按照Lipofectamin 2000试剂盒说明书,转染后48 h收取细胞进行下一步研究。
3.细胞总蛋白、组织蛋白提取以及蛋白电泳
细胞处理后,在6孔板中加入细胞裂解液(细胞裂解液中提前按照1∶100加入蛋白酶抑制剂PMSF),细胞刷轻轻刮下细胞,混匀后冰上裂解30 min,通过BCA法计算裂解液中蛋白浓度,100℃加热5 min变性后,直接电泳或分装后放置于-80℃保存。蛋白电泳操作步骤参考文献[5],按每孔相同的蛋白浓度取适量蛋白标本进行蛋白电泳并转移至硝酸纤维膜后,5%脱脂牛奶封闭2 h,根据目标蛋白的分子量分别将不同条带浸泡至稀释后的一抗稀释液中:抗LRRC1(1∶1000)、抗DLG1(1∶500)、抗YAP(1∶1000)、抗Cyclin D1(1∶1000)、抗CDK4(1∶1000)、抗β-actin(1∶5000),4℃孵育一抗摇床过夜后,Tris-盐酸盐吐温缓冲液(TBST)洗涤2次,每次10 min,常温孵育二抗2 h后,TBST洗涤3次,每次10 min,暗房中ECL发光液发光后压片曝光显像。
4. 细胞活性测定
HepG2及Huh7经siRNA处理后,将细胞从6孔板消化脱落后接种于96孔板,每孔接种细胞数量为1000个,每孔内加入200 μl 细胞培养液,每组设3个重复孔,接种24 h细胞贴壁后,将每孔全部培养液吸出,每个检测孔中加入100 μl检测培养液(含10 μl的CCK-8检测溶液和90 μl的DMEM培养液)。继续在细胞培养箱避光孵育2 h,使用酶标仪测定波长490 nm下每孔的吸光度,记为该检测孔的细胞增殖活性,重复上述实验共3次。
四、统计学处理
运用SPSS 20.0进行统计学分析。正态分布资料以表示,应用独立样本t检验对2组独立样本进行比较,应用配对t检验对配对样本进行比较,P < 0.05为差异有统计学意义。
结果
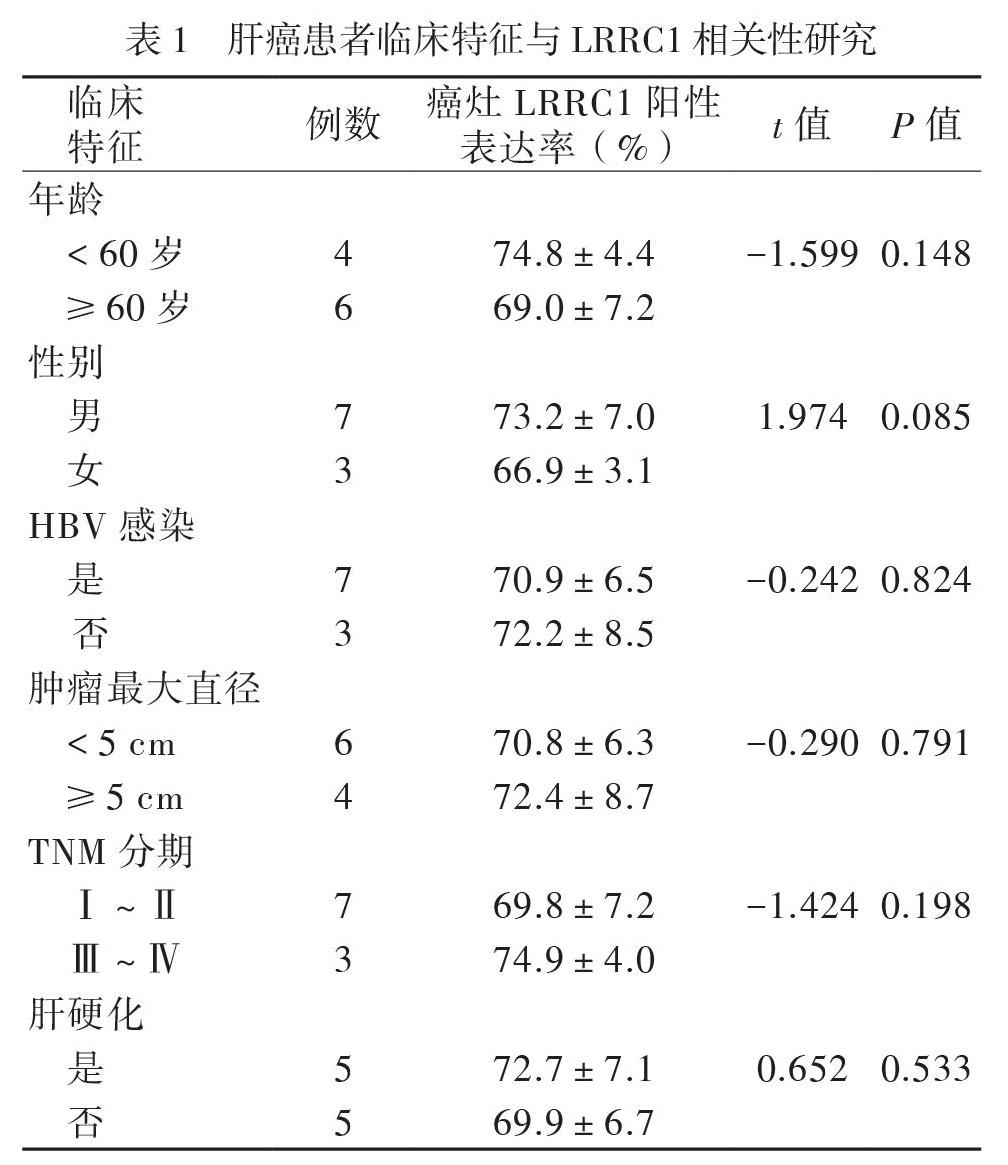
一、人肝癌癌灶组织和配对癌旁组织中LRRC1蛋白表达分析
对人肝癌癌灶组织和配对癌旁组织进行免疫组织化学染色,结果显示在癌灶组织中,LRRC1蛋白阳性信号明显多于其配对的癌旁组织(图1A)。通过对10例肝癌组织样品进行免疫组织化学染色后随机挑选视野计数900个细胞LRRC1蛋白阳性表达情况,统计发现,LRRC1在肝癌癌灶组织[(71.3±8.9)%]中的表达高于配对的癌旁组织[(21.2±11.9)%],t=20.37,P < 0.001。收集肝癌患者的临床资料,分析肝癌癌灶中LRRC1表达与患者年龄、性别、HBV感染、肿瘤大小、TNM分期及肝硬化的相关性,结果显示LRRC1表达与上述临床指标无相关性,组间差异均无统计学意义(P均> 0.05),见表1。对人肝癌癌灶组织和配对癌旁组织进行蛋白免疫印迹检测,结果显示LRRC1在肝癌癌灶组织与配对癌旁组织中的表达差异与免疫组织化学染色结果相一致(图1B)。
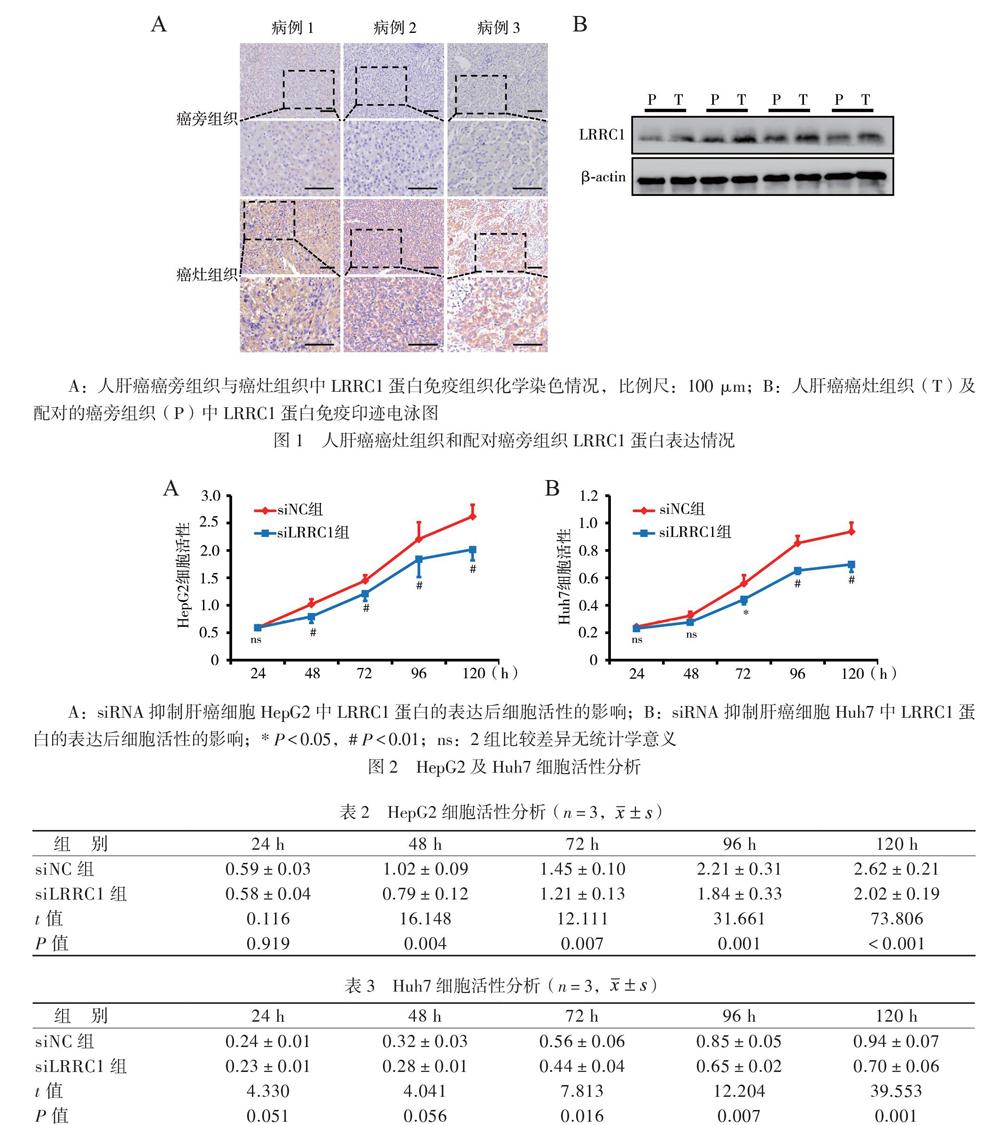
二、抑制LRRC1蛋白表达后肝癌细胞活性分析
使用siRNA抑制肝癌细胞HepG2及Huh7中LRRC1蛋白的表达后,利用CCK-8检测试剂盒进行细胞活性检测,结果显示HepG2及Huh7细胞中LRRC1蛋白表达抑制后,细胞活性下降(图2),见表2、3。
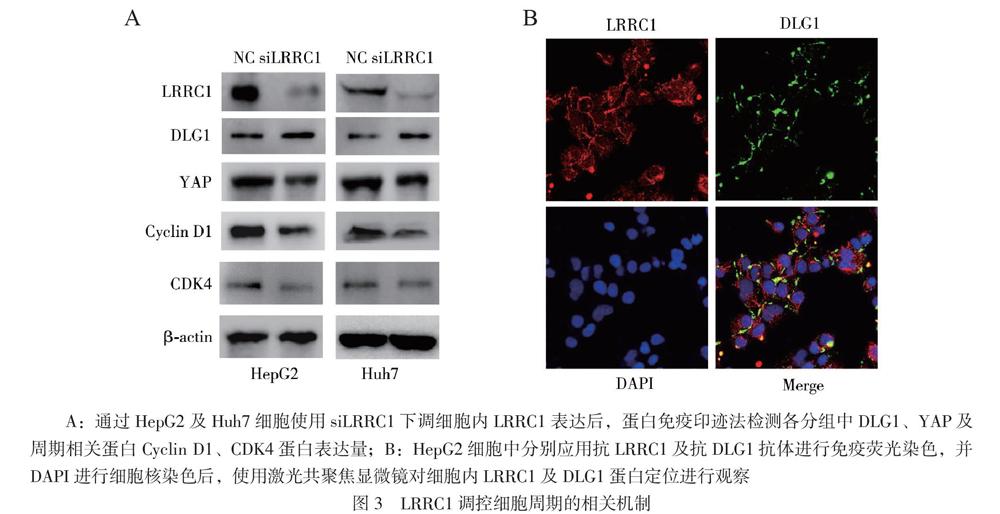
三、抑制LRRC1蛋白表达后肝癌细胞周期相关蛋白表达情况
通过siRNA抑制HepG2及Huh7细胞中的LRRC1蛋白的表达后,通过蛋白免疫印迹法检测各分组中DLG1、YAP及周期相关蛋白Cyclin D1、CDK4蛋白表达量。实验结果显示,siRNA下调细胞中的LRRC1蛋白的表达后,细胞中DLG1蛋白水平并无明显改变,YAP及周期相关蛋白Cyclin D1、CDK4蛋白表达量均下降(图3A)。
四、HepG2细胞内LRRC1与DLG1分布研究
使用共聚焦显微镜对HepG2细胞中LRRC1及DLG1蛋白的分布进行分析,结果显示,LRRC1及DLG1蛋白均主要分布于细胞膜内侧面,小部分游离分布于胞浆中,两者的分布位置高度重叠(图3B)。
讨论
肝细胞癌是高发病率与高死亡率的恶性肿瘤,其具体发病机制有待进一步研究探索。本实验中,我们在肝癌患者病理组织及肝癌细胞系中进行研究,结果显示极性蛋白LRRC1在肝癌癌灶组织中异常高表达,在肝癌细胞中下调LRRC1,可抑制肝癌细胞增殖,进一步的分子机制研究显示,LRRC1可能通过与DLG1相互作用,上调YAP蛋白水平,从而通过调控细胞周期促进肝癌细胞的增殖。
上皮细胞形态具有极性,可分为顶端和基底端,表现为形态的不对称,这种具有极性的形态作为上皮细胞的特点,极性蛋白通过调控细胞间黏附及信号通路级联传导,维持着细胞极性、形态,保持细胞间的紧密连接以及组织的正常三维结构,共同发挥维持上皮组织的形态结构的重要作用[6-7]。肝细胞癌作为上皮来源的恶性肿瘤之一,肝细胞极性丢失伴随增殖异常是导致肝细胞癌发生、发展的重要机制,但肝癌细胞极性蛋白的具体作用机制仍未明了。多项研究提示,极性蛋白LRRC1在肝细胞癌、非小细胞肺癌等多种恶性肿瘤中均异常高表达[8-9]。有研究者认为,LRRC1在肝癌中高表达与细胞中LRRC1基因启动子区域去甲基化相关[9]。我们的前期基因芯片表达谱研究同样发现,极性蛋白LRRC1在肝癌癌灶中异常高表达(GEO: GSE67764)[4]。在本研究中,我们通过免疫组织化学染色及蛋白免疫印迹法检测证实了肝癌中LRRC1蛋白表达上调,提示LRRC1表达上调在肝癌中可能发挥重要作用。在往后的进一步的实验中,肝癌中LRRC1异常高表达的分子机制有待进一步探索。研究显示LRRC1的表达与肝癌患者的预后呈负相关关系,LRRC1可作为肝癌预后评估的标志物之一[3]。在本研究中,我们分析了肝癌癌灶中LRRC1表达与患者年龄、性别、HBV感染、肿瘤大小、TNM分期及肝硬化等临床特征间的相关性,结果显示LRRC1表达与上述临床特征无相关性,考虑到本研究纳入的临床标本较少,今后我们将进一步增加研究样本量,针对LRRC1的临床意义及作为肝癌预后标志物之一的临床价值进行深入挖掘证实。
通过细胞活性实验,我们证实了LRRC1具有促进肝癌细胞增殖的作用,此结果与既往研究结果相符[3]。极性蛋白LRRC1缺乏PDZ结构域,是其区别于LAP家族其他蛋白成员的重要特点,虽然缺乏PDZ结构域,LRRC1可以通过其C端的TSV序列,与具有PDZ结构域的蛋白,如DLG1等相互作用,调控下游信号传导[10]。既往肝癌细胞及肝癌患者组织标本研究已证实DLG1蛋白的表达水平与YAP的活性呈负相关,DLG1蛋白具有抑制YAP活性的功能[11]。Hippo/YAP信号通路在生物生长、发育过程中具有调控细胞生长速度,限制器官体积等作用,YAP蛋白作为Hippo信号通路中的核心效应蛋白,在其上游的LATS1/2作用下导致YAP磷酸化,磷酸化的YAP将滞留于胞浆中泛素化并降解,使YAP下游通路处于静止状态;当受到氧化应激、缺血缺氧、物理因素、G蛋白耦联受体等途径刺激后,可减少YAP降解,增多的YAP与TAZ结合并进入细胞核与转录因子TEADs共同发挥信号转录功能,促进靶基因的表达[12]。Hippo/YAP信号通路的调控异常,可促进细胞异常增殖并拮抗凋亡,导致肿瘤的发生、发展,因此LRRC1通过DLG1调控YAP可能是LRRC1促进肝癌细胞增殖的机制[13]。在进一步的分子机制研究中,我们发现LRRC1蛋白水平与YAP蛋白的表達水平呈正相关;同时,LRRC1的表达水平与周期相关蛋白Cyclin D1及CDK4表达水平也呈正相关关系。通过激光共聚焦显微镜对LRRC1及DLG1蛋白进行细胞内定位,提示两者在细胞内可能存在相互作用。LRRC1及DLG1的相互作用目前未完全明了,部分研究显示正常状态下极性蛋白之间的相互协同作用可增强极性蛋白维持细胞形态及正常的信号传导功能。另有研究显示,在疾病状态下,如肿瘤细胞内,异常增多的极性蛋白之间产生拮抗作用,导致极性蛋白的功能受到抑制[14-16]。本实验的研究结果提示,肝癌细胞内异常增多的LRRC1与DLG1结合后,可能抑制DLG1发挥其正常功能,导致YAP及下游通路的异常活化。在今后进一步的实验中,需要完善免疫共沉淀实验、GST蛋白沉降实验等方法证实LRRC1与DLG1的相互作用,并深入研究对下游YAP蛋白及细胞周期的影响及分子机制。
综上所述,LRRC1在肝癌细胞中异常高表达,可能通过与DLG1相互作用,上调YAP蛋白水平,从而通过调控细胞周期而促进肝癌细胞的增殖。本研究对LRRC1在肝癌的发生、发展的作用及可能机制提供了科学依据。
参 考 文 献
[1] Santoni MJ, Kashyap R, Camoin L, Borg JP. The Scribble family in cancer: twentieth anniversary. Oncogene,2020,39(47):7019-7033.
[2] Saito H, Santoni MJ, Arsanto JP, Jaulin-Bastard F, Le Bivic A, Marchetto S, Audebert S, Isnardon D, Adéla?de J, Birnbaum D, Borg JP. Lano, a novel LAP protein directly connected to MAGUK proteins in epithelial cells. J Biol Chem, 2001, 276(34):32051-32055.
[3] Li Y, Zhou B, Dai J, Liu R, Han ZG. Aberrant upregulation of LRRC1 contributes to human hepatocellular carcinoma. Mol Biol Rep,2013,40(7):4543-4551.
[4] Yang Y, Guo Y, Tan S, Ke B, Tao J, Liu H, Jiang J, Chen J, Chen G, Wu B. β-Arrestin1 enhances hepatocellular carcinogenesis through inflammation-mediated Akt signalling. Nat Commun,2015,6:7369.
[5] 雷一鸣, 杨逸冬, 谭嗣伟, 林显艺, 吴斌. TNF-α通过内质网应激信号通路诱导肝癌细胞自噬并促进增殖的研究. 新医学, 2017, 48(11):770-774.
[6] Choi J, Troyanovsky RB, Indra I, Mitchell BJ, Troyanovsky SM. Scribble, Erbin, and Lano redundantly regulate epithelial polarity and apical adhesion complex. J Cell Biol, 2019, 218 (7):2277-2293.
[7] Schmidt A, Peifer M. Scribble and Dlg organize a protection racket to ensure apical-basal polarity. Proc Natl Acad Sci U S A,2020, 117(24):13188-13190.
[8] Wu H, Mu X, Liu L, Wu H, Hu X, Chen L, Liu J, Mu Y, Yuan F, Liu W, Zhao Y. Bone marrow mesenchymal stem cells-derived exosomal microRNA-193a reduces cisplatin resistance of non-small cell lung cancer cells via targeting LRRC1. Cell Death Dis, 2020, 11(9):801.
[9] Hua S, Ji Z, Quan Y, Zhan M, Wang H, Li W, Li Y, He X, Lu L. Identification of hub genes in hepatocellular carcinoma using integrated bioinformatic analysis. Aging (Albany NY),2020, 12(6):5439-5468.
[10] Yamanaka T, Ohno S. Role of Lgl/Dlg/Scribble in the regulation of epithelial junction, polarity and growth. Front Biosci, 2008, 13:6693-6707.
[11] Wu D, Liu G, Liu Y, Saiyin H, Wang C, Wei Z, Zen W, Liu D, Chen Q, Zhao Z, Zou L, Huang H, Jiang S, Yu L. Zinc finger protein 191 inhibits hepatocellular carcinoma metastasis through discs large 1-mediated yes-associated protein inactivation. Hepatology,2016, 64(4):1148-1162.
[12] Boopathy GTK, Hong W. Role of hippo pathway-YAP/TAZ signaling in angiogenesis. Front Cell Dev Biol,2019, 7:49.
[13] Webb Strickland S, Brimer N, Lyons C, Vande Pol SB. Human Papillomavirus E6 interaction with cellular PDZ domain proteins modulates YAP nuclear localization. Virology,2018, 516:127-138.
[14] Elsum I, Yates L, Humbert PO, Richardson HE. The Scribble-Dlg-Lgl polarity module in development and cancer: from flies to man. Essays Biochem,2012, 53:141-168.
[15] Stephens R, Lim K, Portela M, Kvansakul M, Humbert PO, Richardson HE. The scribble cell polarity module in the regulation of cell signaling in tissue development and tumorigenesis. J Mol Biol,2018, 430(19):3585-3612.
[16] Bonello TT, Peifer M. Scribble: a master scaffold in polarity, adhesion, synaptogenesis, and proliferation. J Cell Biol,2019, 218(3):742-756.
(收稿日期:2020-12-18)
(本文編辑:杨江瑜)
