HPV E6/E7 mRNA检测在宫颈高级别病变筛查中的应用分析
2021-04-25厉瑶胡旻胡美旭陈盼
厉瑶 胡旻 胡美旭 陈盼
子宫颈癌具有高发病率和高致死率。我国目前宫颈癌筛查率仍较低,2010年全国城市筛查率约为29.1%,在农村仅为16.9%[1]。因此,积极寻找合理有效的宫颈病变筛查方法对于防治宫颈癌至关重要。持续高危型HPV感染是引起宫颈病变的主要原因。以往,临床上多采用HPV-DNA检测与TCT相联合的方式进行宫颈病变的筛查与随访。近来一些研究发现,HPV E6/E7 mRNA检测与HPV-DNA检测在筛查宫颈病变中具有相似的灵敏度,而且特异性更高[2]。在有条件的医院,其被逐渐应用于宫颈病变的筛查。但目前尚缺乏大样本的临床研究探讨HPV E6/E7 mRNA检测的应用价值和优势。本研究通过回顾性分析1596例确诊为宫颈高级别病变(CINⅡ+)患者的宫颈筛查结果,以进一步评估HPV E6/E7 mRNA检测在宫颈高级别病变筛查中的优越性和诊断价值。
1 资料与方法
1.1 临床资料 选择2018年1月至2019年12月本院妇科就诊且病理检查确诊为宫颈上皮内瘤变≥Ⅱ级病变(CINⅡ+)的患者1596例,年龄25~66岁,平均年龄(40.75±8.90)岁。(1)纳入标准:①有性生活史;②既往无宫颈病变。③确诊前1年内均在本院行TCT、HPV DNA、HPV E6/E7 mRNA中1项或多项检测,并记录检测结果。(2)排除标准:①妊娠期妇女;②近期有生殖器炎症;③既往曾行宫颈手术或子宫切除手术;④既往曾行盆腔放疗或化学治疗;⑤无法配合检查者。
1.2 方法 (1)取样方法:取样时间必须为非月经期,并且保证取样前3 d内无性生活,2 d内无阴道冲洗或阴道给药。患者取膀胱截石位,置入窥阴器后暴露子宫颈,在子宫颈管内顺时针旋转3~5周子宫颈取样刷,最后将刷头完全浸泡于细胞保存液中。当天送检所有样本。(2)HPV E6/E7 mRNA 检测:采用QuantivirusTM支链DNA杂交捕获原理检测HPV E6/E7 mRNA,试剂盒为宫颈稳态检测试剂盒(购自郑州科蒂亚生物技术有限公司)。可定量检测14种高危型HPV,分别为HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68型。按照说明书进行检测,检测探针是针对上述14种高危人乳头状瘤病毒的E6/E7 mRNA,只要其中任一种存在结果就显示为阳性。(3)HPV-DNA检测:采用购自上海透景公司的检测试剂盒,方法为流式微球法,具体操作步骤按照试剂盒说明书进行。一共检测27种HPV亚型,分别为高危型HPV:HPV-DNA-16、18、26、31、33、35、39、45、51、52、53、56、58、59、66、68、82型和低危型HPV:HPV-DNA-06、11、40、42、43、44、55、61、81、83型,任一阳性即判定为HPV DNA检测阳性。(4)TCT检查:采用全自动液基细胞制片仪(购自杭州海世嘉科技有限公司),对子宫颈脱落细胞进行均化、转移、制片,最后固定及染色后阅片。子宫颈细胞学诊断按照2001年国际癌症协会推荐的Bethesda分类系统(TBS)的标准。TCT检测结果≥未明确意义的不典型鳞状上皮细胞或腺上皮细胞(ASCUS或AGC)者即视为细胞学检测阳性。(5)病理学诊断方法:根据患者阴道镜下宫颈多点活检的病理标本,通过专业病理医师阅片,将病理标本组织学结果明确分为以下5类:①良性细胞改变;②宫颈上皮内瘤变Ⅰ级(CINⅠ);③宫颈上皮内瘤变Ⅱ级(CINⅡ);④宫颈上皮内瘤变Ⅲ级(CINⅢ)或宫颈原位癌;⑤宫颈浸润癌。病理检查结果明确为宫颈上皮内瘤变≥Ⅱ级(CINⅡ+)的患者为入组样本。
1.3 统计学方法 采用SPSS 17.0统计学软件。计数资料以(%)表示,用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 三种筛查方法单独或联合筛查漏检率比较 见表1。
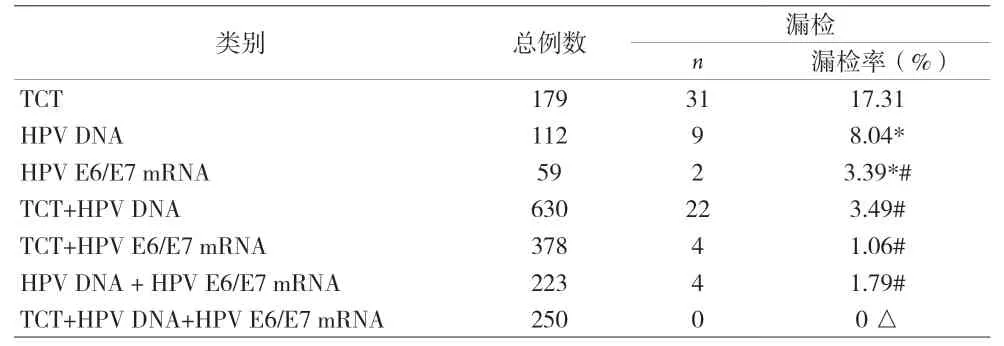
表1 三种筛查方法单独或联合筛查的漏检率
2.2 不同TCT结果下HPV E6/E7 mRNA检出率比较 378例患者行TCT+HPV E6/E7 mRNA联合筛查。TCT阳性312例,HPV E6/E7 mRNA阳性298例。TCT细胞病理结果分级越高,HPV E6/E7 mRNA检出率越高(χ2趋势=13.824,P<0.05)。见表3。
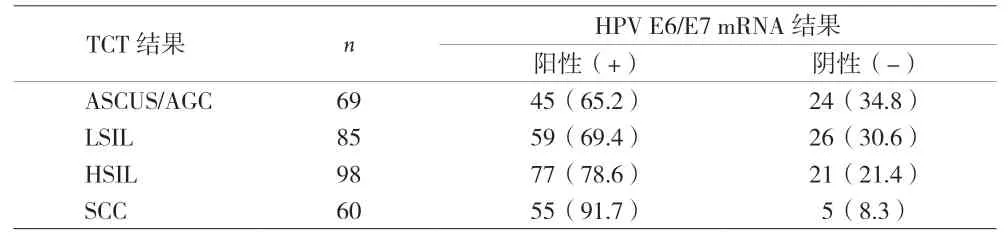
表3 不同TCT细胞病理结果下HPV E6/E7 mRNA检出率[n(%)]
3 讨论
2014年,WHO推荐用HPV分型检测作为子宫颈癌初筛的方法[3]。HPV-DNA检测与细胞学筛查相比,具有更高的可重复性和灵敏度。但由于HPV-DNA检测仅能表明患者有无HPV病毒感染,无法证明宿主细胞中有无病毒整合,因此在宫颈高级别病变患者甚至宫颈癌患者中仍存在较高的阴性率[4]。本资料中,HPVDNA检测与HPV E6/E7 mRNA检测相比其漏检率较高。分析原因:(1)主观原因为临床医师在标本采集时采集的细胞量过少或遭受杂质影响;(2)本院HPV-DNA检测技术已涵盖高危型和低危型共27种HPV亚型,但仍有较多其他的HPV亚型也可引起高级别宫颈病变甚至子宫颈癌,比如HPV 90型。有研究表明[5],在宫颈细胞学检查异常的高危人群中,有3.9%的妇女检测出HPV 90型阳性。(3)部分特殊类型的宫颈癌患者的疾病发生与HPV病毒并无直接关系。如在透明细胞癌的HPV病毒阴性率为80.0%,在宫颈微偏腺癌的患者中HPV病毒阴性率达91.7%[6]。
以往,临床上常用宫颈刮片(巴氏涂片法)进行细胞学筛查,但由于其制片过程复杂粗略,漏检率高已被逐渐淘汰。TCT检查虽然优于传统的巴氏涂片法,但相比HPV病毒检测漏检率仍较高。究其原因可能与以下因素有关:(1)采集标本时由于宫颈病灶局限,取样刷未能刷到病灶处的异常细胞或标本采集的细胞量不足;(2)部分患者宫颈移行带未在采集范围内;(3)TCT检查结果与病理诊断医师的水平与经验密切相关,主观性较强,且目前国内尚缺乏统一的妇科病理诊断医师培训体系。TCT检查仅基于细胞学特征进行初步病理诊断,无法全面观察到整体细胞组织学结构。因此相比宫颈活检病理组织诊断方法,在取材、形态学观察时,易受主观因素影响,具有更高的误诊和漏诊率,局限性较大。
近年来研究发现,与HPV DNA检测相比,HPV E6/E7 mRNA检测方法在筛查高级别子宫颈病变和子宫颈癌中具有相似的敏感度和更高的特异度[7]。当患者受高危型HPV持续感染后,以整合形式存在于宿主细胞内的HPV会转录大量癌基因E6、E7 mRNA 并生成E6、E7癌蛋白,引起真正癌前病变和子宫颈癌[8]。其可以通过检测患者的 E6/E7 mRNA表达,推测癌基因表达活性,进一步评估细胞病变的趋势。美国FDA已批准将HPV E6/E7 mRNA检测作为>21岁细胞学诊断为ASCUS妇女的诊断分流,并推荐>30岁妇女行HPV E6/E7 mRNA检测联合细胞学检查进行宫颈病变筛查[9]。
本资料中,单独行HPV E6/E7 mRNA检测的漏检率低于TCT和HPV DNA检测,且差异有统计学意义。其优越性主要在于:(1)主要应用杂交捕获原理和PCR原理进行检测,比基于形态学的TCT 检查方法更加敏感;(2)大部分HPV病毒感染在女性中仅为一过性,HPV DNA病毒检测不能确定HPV感染的活动程度是否有进一步恶变可能。HPV E6/E7 mRNA更能准确反映HPV病毒在细胞内的复制转录活跃程度。一项Meta分析[10]纳入了8项宫颈癌筛查研究,分析显示这些研究人群中HPV E6/E7 mRNA检测检出CINⅡ+的灵敏度和HPV DNA检测相当,但特异度前者明显更高,分别为 0.82(95%CI 0.80~0.83)和0.65(95%CI 0.62~0.67),差异有统计学意义。本资料结果显示,随着细胞病理分级越高,HPV E6/E7 mRNA的检出率也越高。表明随着子宫颈病变严重程度的增加,其表达水平也相应增高,这与欧丽滢等[11-12]研究相符。
综上所述,HPV E6/E7 mRNA检测在宫颈高级别病变筛查中具有较高的特异度和灵敏度,其与TCT检查联合进行筛查,可大幅度提高精确率,减少漏检率。但对于评估HPV E6/E7 mRNA检测在普通人群筛查中的有效性及经济学效益,仍有待多中心、大样本量的研究进一步明确。
