利用剩余活性污泥制备洗涤用酶制剂的研究
2021-04-23陈梦涛王俊华张子明范晓敏李海航
陈梦涛, 王俊华, 张子明, 范晓敏, 倪 贺, 李海航*
(1. 华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室,广州 510631;2. 深圳盛世集团,深圳 518112; 3. 广州科藤生物医药科技有限公司,广州 510425)
随着城市和工业化的发展,我国剩余活性污泥产量以每年约10%速度增加,预计到2020年湿污泥年产量将达到6 000~8 000万t[1-3]. 现有的剩余活性污泥处理方法不仅成本高,而且浪费资源,因此有必要改善污泥处理方法. 剩余活性污泥中59%~88% 的成分为有机物,富含蛋白质、脂质、酶以及各种营养成分[4-7]. 对上述各种有机成分进行资源化利用不仅可以减少二次污染物的量和污泥处理费用,还能产生良好的经济效益[8-9].
KARN等[10]报道了从剩余活性污泥中提取到的蛋白酶可应用在皮革工业中对动物皮肤进行脱毛和软化处理. GARCA等[11]采用不同的方法增加剩余活性污泥中蛋白质的溶解效率,并将其回收作为动物饲料添加剂使用. 李恺等[12]将表面活性剂CTAC处理活性污泥,不仅提高了活性污泥的脱水性能,同时可以溶出胞内聚合物,有利于蛋白酶的提取.
本实验室的前期研究表明,剩余活性污泥可用于依次提取水解酶和聚羟基脂肪酸酯,剩余残渣制备保水缓释有机肥[8]. 本文系统地研究了简单高效地从剩余活性污泥中提取、分离和制备复合水解酶的方法和工艺,并将提取的酶研发成热稳定性高的洗涤用酶制剂.
目前,酶制剂的制备方法主要是微生物发酵提取,其中30%~40%的生产成本是培养基的制备,因此生产成本较高[13]. 本文首次将污泥中制备的复合水解酶作为洗涤用酶制剂使用,并将其研制成商品应用价值更高的颗粒酶制剂. 剩余活性污泥中丰富的酶资源可以跨越菌种培育和发酵生产酶的阶段,有效地缩短了工业生产时间,且生产成本大大降低,优势明显.
1 材料与方法
1.1 材料、试剂和仪器设备
供试剩余活性污泥采集于广州开发区水处理集团公司所属位于食品工业区的永和水质净化厂. Triton X-100、Tris、明胶、酪蛋白均为分析纯,购自广州鼎国有限公司;蛋白marker为分析纯,购自Takara公司;食用级乙醇,体积分数95%;茚三酮、Folin-酚试剂、对硝基苯酚棕榈酸酯、3,5-二硝基水杨酸以及其它实验常用的试剂均为分析纯,购自广州成硕化玻有限公司. 微滤膜(0.2、0.1 μm)、超滤膜(0.01 μm)、纳滤膜(0.001 μm)购自广东深圳市百德水净水器厂.
1.2 各种酶的分析
1.2.1 酶活性的测定 采用比色法测定各种水解酶的酶活[8,14]. 分别用0.2% 明胶溶液、1% 碱性酪蛋白溶液、对硝基苯酚棕榈酸酯、1% 可溶性淀粉和1% 羧甲基纤维素钠(CMC-Na)作为胶原蛋白酶、碱性蛋白酶、脂肪酶、β-淀粉酶和纤维素酶的酶促反应底物,测定各酶的活性. 酶活力单位定义为:在测定条件下,1mL酶液每分钟水解底物产生相当于1 μg 酶促反应产物的酶的活性为1个酶活力单位(U).
1.2.2 酶活性自显影分析 胶原蛋白酶、碱性蛋白酶、脂肪酶和淀粉酶的酶活性自显影分析采用NI等[8]报道的方法.
1.3 剩余活性污泥中复合水解酶的提取
以NI等[8]的提取方法为基础,分别对提取液中非离子表面活性剂Triton X-100的用量、提取固液比、提取时间和提取次数等提取条件进行了优化和分析. 取25 g离心脱水的剩余活性污泥,按一定固液比加入Triton X-100的水溶液,在冰浴上以 500 r/min搅拌浸提 1 h,4 ℃、5 000 r/min离心15 min,收集上清液为复合水解酶提取液. 以提取液中胶原蛋白酶的活性为指标,对各种提取条件进行优化.
1.4 复合水解酶提取液的膜过滤分离和浓缩
首先用酶活性自显影法对复合水解酶提取液中的各种酶的相对分子量大小及其活性条带分布范围进行测定和分析. 根据各种水解酶的相对分子量范围,选用各级膜孔径的大小. 以微滤和超滤膜分离除去无活性的大分子物质,再通过纳滤膜将膜过滤液浓缩. 分别检测各级膜过滤前后提取液中胶原蛋白酶的活性.
1.5 酶浓缩液中复合水解酶的沉淀与干燥
经膜分离和浓缩后的酶浓缩液用乙醇沉淀法沉淀其中的复合水解酶. 在酶浓缩液中分别加入4 ℃预冷的95%乙醇和NaCl(离子强度调节剂),调节溶液的pH值,混合均匀后于4 ℃下静置沉淀2 h或不同时间. 离心分离,沉淀用磷酸缓冲液(pH6.8)充分溶解,以沉淀后溶解出的胶原蛋白酶活性为指标,分别测定乙醇体积分数(40%~80%)、NaCl质量分数(0.1%~2.0%)、pH(3.0~7.0,各水解酶的等电点均小于7.0)和沉淀时间(0.5~24 h)对沉淀中可溶性酶活性的影响,筛选出乙醇沉淀的最佳条件. 酶沉淀物经真空冷冻干燥制成粉末酶制剂.
1.6 复合水解酶提取分离和制备的放大实验
将开发和优化后的复合水解酶提取分离和制备工艺逐级放大到每次提取5 kg活性污泥的小试水平到50 kg级的中试水平. 对所得复合酶粉中主要酶的种类及其酶活性进行分析.
1.7 复合水解酶的热稳定性测定和稳定剂筛选
以复合水解酶中脂肪酶在55 ℃水浴处理下酶活降低50% 所需时间作为复合水解酶热稳定性的指标(即t1/2)测定酶的热稳定性和筛选酶的稳定剂. 向酶溶液中分别加入不同浓度的无机盐类、糖类、醇类和氨基酸类物质,在55 ℃水浴中处理,前30 min内每隔5 min 取1 mL酶液,之后每隔10 min取1 mL酶液. 酶液取出后立即在冰水浴中冷却,测定脂肪酶的酶活. 首先筛选出4种类型化合物中的各自最佳的酶稳定剂,然后通过4个单因素水平L9(34)正交试验,筛选出最佳的复合稳定剂配方.
1.8 洗涤用酶颗粒制剂的制备及其在室温下储存稳定性的测定
按固体总量计10%硅藻土、10%可溶性淀粉、6%复合稳定剂、4%复合酶粉末和70%十水硫酸钠的配方将复合水解酶粉制作成洗涤用酶颗粒制剂[15]. 测定所得酶颗粒制剂中洗涤剂常用添加酶(碱性蛋白酶、脂肪酶、淀粉酶和纤维素酶)的酶活,将颗粒酶制剂于室温条件下储存一段时间后,定期测定其脂肪酶活性变化.
1.9 实验结果与统计分析
所有实验均重复3次,实验结果为3次重复的平均值,计算标准差.
2 结果与讨论
2.1 剩余活性污泥中复合水解酶的提取
以胶原蛋白酶活性为指标,研究了Triton X-100质量分数、提取固液比、提取时间和提取次数对复合水解酶提取效果的影响(图1). 随着Triton X-100质量分数的增加,提取液中胶原蛋白酶活性增加,当Triton X-100质量分数为1.0%时,胶原蛋白酶活性达到最高. Triton X-100质量分数高于1.0%时,酶活性不再增加(图1A).

图1 剩余活性污泥中复合水解酶提取条件的筛选
提取固液比在1∶1~1∶4内,随着固液比的提高,提取的酶活性增加. 当提取固液比为1∶4时,胶原蛋白酶酶活最高. 此后,继续提高固液比,提取的酶活性不再增加. 由于固液比越高,提取液的体积越大,后续处理的工作量和试剂用量也会成倍增加,当提取固液比为1∶2时,胶原蛋白酶酶活与1∶4时差异不太大,故选取1∶2为最佳提取固液比(图1B).
随着提取时间的延长,胶原蛋白酶活性呈上升趋势,当提取时间达到60 min后,胶原蛋白酶活性不再增加(图1C). 将同一污泥连续提取3次,以3次提取的胶原蛋白酶总活性为100%计算,发现第1次提取出了71.7%的胶原蛋白酶. 虽然多次提取能进一步提高蛋白酶的提取率,但相应的提取液体积也成倍增加,增加后续处理的成本. 第1次提取已经能将大部分的复合水解酶提取出来,所以选择提取1次(图1D). 综上所述,确定活性污泥中水解酶的提取条件为固液比1∶2,用含1%Triton X-100的水溶液搅拌提取60 min,提取1次.
该最佳提取条件与KARNET等[14]和NABARLATZ等[16]报道的研究结果相似.
2.2 复合水解酶的膜分离与浓缩
选用膜分离与浓缩复合水解酶提取液,浓缩的酶液用乙醇沉淀,用真空冷冻干燥酶制剂的工艺将提取的水解酶进行分离、纯化并制备成粉末酶制剂.
对复合水解酶提取液中的胶原蛋白酶、碱性蛋白酶、脂肪酶、淀粉酶进行了酶活性自显影分析. 脂肪酶的活性条带主要集中在66.2 kDa区域,介于50~70 kDa之间(图2);胶原蛋白酶的活性条带主要分布在25.0~66.2 kDa之间;淀粉酶的活性条带分布在35.0~45.0 kDa区域;碱性蛋白酶的活性条带主要分布在45.0~66.2 kDa区域.

图2 复合水解酶提取液中各酶的相对分子量分布
根据上述结果可知,本实验筛选了分离复合水解酶的各孔径的膜. 复合水解酶提取液经离心处理后依次按微滤膜1(0.2 μm,截留相对分子量300 kDa),微滤膜2(0.1 μm,截留相对分子量150 kDa),超滤膜3(0.01 μm,截留相对分子量100 kDa)分离和过滤,截留除去相对分子量大于100 kDa的杂质. 滤液再经纳滤膜4(0.001 μm,截留相对分子量200 Da)将提取液浓缩至原体积的1/5. 浓缩完后用少量的磷酸缓冲液(pH 6.8)将纳滤膜上的截留物质冲洗下来,将洗涤液并入浓缩液. 经测定,经膜过滤和浓缩处理后酶提取液中胶原蛋白酶酶活回收率为75.8%.
2.3 复合水解酶浓缩液的乙醇沉淀
NABARLATZ 等[16]分别使用无水乙醇和硫酸铵沉淀污泥提取液中的蛋白酶,结果表明乙醇的沉淀效果要优于硫酸铵. NI[8]比较了盐析法、等电点沉淀法和有机溶剂沉淀法(乙醇和丙酮)对污泥提取液中复合酶的沉淀效果,结果表明:有机溶剂沉淀法要优于其他2种方法,且丙酮的沉淀效果最佳. 但从工业生产的适用性考虑,本研究选用乙醇沉淀法沉淀复合水解酶.
乙醇沉淀不仅影响酶的沉淀效率和酶活回收率,也对沉淀制备的酶制剂的复溶性有很大影响. 以沉淀后可溶出的蛋白酶活性为指标,研究了乙醇体积分数、离子强度、pH和沉淀时间对乙醇沉淀酶浓缩液中复合水解酶的影响(图3).
乙醇体积分数从40%增加到70%时,沉淀中胶原蛋白酶的酶活增加. 此后,继续增加乙醇体积分数,胶原蛋白酶酶活不再提高. 因此,选取70%乙醇沉淀复合水解酶(图3A).
溶液中适量的离子强度能提高乙醇沉淀酶的效果和沉淀酶的可溶性[17],本研究选用NaCl来调节酶提取液中的离子强度. 随着NaCl质量分数的增加,沉淀中胶原蛋白酶酶活呈现先上升后下降的趋势(图3B),当NaCl质量分数达到0.3%时,沉淀出的胶原蛋白酶酶活最高.
随着溶液pH的增加,沉淀中胶原蛋白酶酶活也逐渐增加(图3C),当溶液pH为7.0时,沉淀出的胶原蛋白酶酶活最高. 此后随着溶液pH的增加,胶原蛋白酶酶活逐渐减小.
在0~12 h范围内,随着沉淀时间的延长,沉淀中胶原蛋白酶的酶活上升(图3D). 在12 h时,沉淀中胶原蛋白酶酶活达到最高.
结合上述结果,确定乙醇沉淀复合水解酶的最佳条件为:酶浓缩液加入NaCl至终质量分数为0.3%,溶液pH调至7.0,加乙醇至终体积分数70%,充分摇匀,4 ℃静置12 h沉淀酶蛋白,沉淀经冷冻干燥得洗涤用复合水解酶粉末.
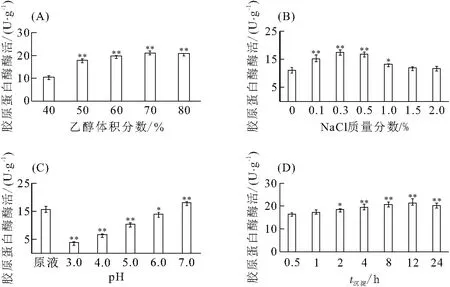
图3 乙醇沉淀酶浓缩液中复合水解酶的条件筛选
2.4 洗涤用复合水解酶提取分离和制备
用上述实验确定的最佳提取分离和制备工艺,先通过5 kg污泥的小试实验后放大到50 kg中试水平. 实验由小试放大至中试水平后,复合水解酶中胶原蛋白酶的酶活和酶活回收率与小试的差异不大. 结果表明(表1):制备工艺放大后,仍具有很好的重复性,可用于工业化生产. 中试实验所得酶粉中胶原蛋白酶、碱性蛋白酶、脂肪酶、淀粉酶和纤维素酶的酶活分别为4.216、3.714、11.915、3.060和1.291 U/mg.

表1 小试与中试实验制备的酶制剂中酶活性与回收率
2.5 复合水解酶稳定剂的筛选
冷冻干燥所得复合水解酶的热稳定性较差,在常温下存放酶易失活. 根据相关文献报道,某些盐类、糖类、醇类和氨基酸具有提高酶热稳定性的效果[18-26]. 本研究从这4类影响酶稳定性的小分子物质中各选择4种化合物,测定了它们对复合水解酶稳定性的影响. 在4种无机盐(NaCl、MgSO4、ZnSO4、NH4Cl)中,MgSO4和NaCl能显著提高复合水解酶的稳定性(图4). NH4Cl对酶的稳定性无显著影响,而ZnSO4则降低酶的稳定性. MgSO4和NaCl均在20 mmol/L时对复合水解酶的稳定效果最好,与对照组相比,酶的t1/2(55 ℃) 分别提高了2.6倍和2.9倍. MgSO4的效果稍优于NaCl. 因此,选取20 mmol/L的MgSO4作为最佳的无机盐类稳定剂(图4A). 4种糖类物质(蔗糖、麦芽糖、葡萄糖、可溶性淀粉)在所测定的各种质量分数时均能显著提高复合水解酶的稳定性,其中以蔗糖质量分数在3%时的效果最显著,与对照组相比酶的t1/2(55 ℃)提高了4.4倍,表明3%的蔗糖是糖类物质中最佳的酶稳定剂(图4B). 4种醇(甘露醇、甘油、丙三醇和正丁醇)均对复合水解酶的稳定性有不同程度的改善,其中甘露醇的效果最显著. 甘露醇质量分数为3%时,比对照组的t1/2(55 ℃) 提高了3.3倍(图4C). 4种氨基酸中,甘氨酸、甲硫氨酸和赖氨酸对复合水解酶稳定性均有显著的提高,其中30 mmol/L甘氨酸的效果最显著,比对照组的t1/2(55 ℃) 提高了3.6倍.而精氨酸对复合水解酶的稳定性无显著影响(图4D).

图4 复合水解酶热稳定剂的筛选
以上结果表明,在所测定的 4类小分子化合物中,盐类中的MgSO4(20 mmol/L)、糖类中的蔗糖(3%)、醇类中的甘露醇(3%)和氨基酸类的甘氨酸(30 mmol/L)在其同类化合物中对复合水解酶稳定性的效果最好. 为了获得最佳的复合稳定剂,采用L9(34)正交试验,对4种化合物组成的复合稳定剂的配方进行了优化. 正交实验的设计和结果见表2和表3. 正交实验的结果表明:在单因素水平上,4种化合物对复合水解酶稳定性影响由大到小依次为蔗糖、MgSO4、甘露醇、甘氨酸. 各种组合稳定剂中,9号复合稳定剂对酶的稳定效果最显著,其t1/2(55 ℃)达到314.9 min,比对照组的t1/2(55 ℃)(见图4)提高了10.3倍. 因此,以上筛选出的最佳复合稳定剂配方为4%蔗糖、4%甘露醇、30 mmol/L甘氨酸、10 mmol/L MgSO4.

表2 复合水解酶L9(34)正交实验表

表3 复合水解酶L9(34)正交实验设计及结果
2.6 洗涤用颗粒酶制剂的制备及在室温下的储存稳定性
按洗涤剂用酶的特点,研究和制备了洗涤用的颗粒酶制剂. 按固体总量计算,用4%复合酶粉末、10%硅藻土、10%可溶性淀粉、6%复合稳定剂和70%十水硫酸钠的配方组合,制作成洗涤剂用的复合水解酶的颗粒制剂[15]. 对该颗粒酶制剂中洗涤剂常用添加酶的酶活进行分析,其中碱性蛋白酶、脂肪酶、淀粉酶和纤维素酶的酶活分别为1.527、5.935、1.015和0.479U/mg(表4),表明该颗粒酶制剂的酶种类与酶活性与市售商品洗涤用酶制剂相近,可用作洗涤用酶添加剂.
对制备的颗粒型复合水解酶制剂在室温条件下的储存稳定性进行了研究,并与粉末酶制剂进行了比较. 随着储存时间的延长,颗粒酶制剂中脂肪酶酶活的损失速率明显慢于粉末酶制剂(图5). 储存60d后,粉末型酶制剂的酶活降至仅31.8%,而颗粒酶制剂仍保留76.4%的酶活. 表明将复合水解酶粉末制作成颗粒酶制剂能有效地降低其在室温下储存时酶活性的损失,提高其商品价值.
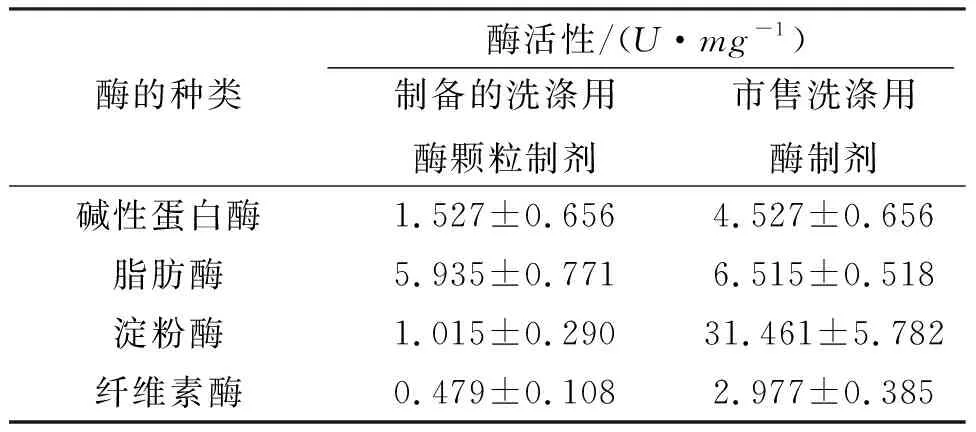
表4 市售和制备的洗涤剂用颗粒酶制剂比较

图5 室温下洗涤用颗粒酶制剂中脂肪酶的储存稳定性
3 结论
本研究开发了一种简单、高效的从剩余活性污泥中提取、分离和制备复合水解酶并将其制备成洗涤用酶制剂的方法和工艺. 将剩余活性污泥按固液比1∶2加入含1% Triton X-100的纯水搅拌提取60 min,离心收集上清液得到酶提取液. 酶提取液经膜过滤分离和浓缩后,调节酶浓缩液的pH至7.0,NaCl质量分数为0.3%,乙醇体积分数为70%,4 ℃下沉淀12 h后,4 ℃、5 000 r/min离心15 min收集酶沉淀. 酶沉淀用适量的磷酸缓冲液溶解,真空冷冻干燥得复合水解酶粉末. 粉末酶制剂按固体总量4%复合水解酶粉末、10%硅藻土、10%可溶性淀粉、6%复合稳定剂和70%十水硫酸钠的配方制作成洗涤剂用的颗粒酶制剂. 颗粒酶制剂中碱性蛋白酶、脂肪酶、淀粉酶和纤维素酶的酶活分别为1.527、5.935、1.015和0.479 U/mg,主要的酶种类与酶活性与市售商品洗涤剂用酶制剂相近. 该方法和工艺简单,设备和生产成本低,生产的酶制剂价值高,可用于从剩余活性污泥中提取制备洗涤剂用复合水解酶的规模化生产.
