纳米SnOx的水热合成及其储锂电化学性能
2021-04-23方小敏孙艳辉
赖 海, 林 颖, 陈 希, 方小敏, 孙艳辉
(华南师范大学化学学院, 广州 510006)
随着电子产品对能量密度的需求越来越高,以碳为负极材料的锂离子电池因其比容量较低已很难满足要求. 因此,研发高比能量、高循环稳定性的锂离子电池负极材料成为近几年的研究热点[1]. 锡基氧化物以其高的理论比容量、质量比能量和体积比能量,以及良好的安全性能和较低的嵌锂电位等优点,被认为是替代商业化的石墨类锂离子电池负极材料的理想选择,其研究受到人们的普遍重视[1-3].
氧化亚锡(II)(SnO)和氧化锡(IV)(SnO2)是2种重要的锡基氧化物[4-5],其理论比容量(SnO,1 270 mAh/g;SnO2,1 490 mAh/g)远高于石墨的理论比容量(372 mAh/g). 但锡基氧化物作为电极材料存在一些固有缺陷,如导电率低、充放电过程中体积变化巨大,导致其倍率稳定性差、首次循环库伦效率低(仅50%左右)、以及循环稳定性能差等缺点,这些都阻碍了其实际应用[6-7]. 锡基氧化物的实际电化学性能取决于其形貌、结构、晶粒尺寸、比表面积等物理性质[8]. 小尺寸或中空结构的纳米SnOx可以抑制嵌脱Li+过程中的巨大体积变化,改善其电化学性能[9-12]. 目前,纳米锡基氧化物的合成方法很多,如溶胶-凝胶法[13-14]、水热法[15-16]等. 在这些合成方法中,由于Sn2+和Sn4+在水中极易水解,发生如下反应:
SnCl2+H2O=Sn(OH)Cl(s)+HCl,
SnCl4+6H2O=H2[Sn(OH)6]+4HCl,
因此反应体系的酸碱性对SnOx的生成具有重要影响[16]. 基于此,本文采用水热法,以SnCl2·2H2O为锡源,分别控制NaOH的浓度(0、0.075、0.225、0.375、0.450、0.525 mol/L)调控反应体系的碱性,进而调控SnOx材料的形貌结构和尺寸,并对其作为锂离子电池负极材料的电化学性能进行研究,为寻找长寿命、高容量的负极材料提供理论依据和实验数据.
1 实验部分
1.1 试剂与仪器
主要试剂:氯化亚锡二水合物(Tin(II) chloride dihydrate,分析纯,Aladdin),氢氧化钠、乙二醇和无水乙醇(分析纯,天津大茂化学试剂厂).
主要仪器:X-射线粉末衍射仪(Ultima IV,日本理学)、场发射扫描电子显微镜(ZEISS Ultra 55,德国Carl Zeiss)、NEWARE电池测试系统(深圳新威尔电子)和CHI660E 电化学工作站(上海辰华).
1.2 材料的合成
首先将12 mmol SnCl2·2H2O 溶解在15 mL乙二醇和15 mL水的混合液中,在磁力搅拌下向上述溶液加入一定量的NaOH,继续搅拌0.5 h后转入内衬容积为100 mL的反应釜中,放入恒温箱中,在120 ℃反应12 h. 冷却至室温后,分别用去离子水和无水乙醇洗涤3次,洗至检测不到Cl-,然后在70 ℃下真空干燥16 h即可得到样品. 为表述方便,根据反应条件中NaOH浓度(0、0.075、0.225、0.375、0.450、0.525 mol/L)将最终制备的样品标记为0MNaOH-SnOx、0.075MNaOH-SnOx、0.225MNaOH-SnOx、0.375MNaOH-SnOx、0.450MNaOH-SnOx和0.525MNaOH-SnOx,其中x=1、2或1~2(此时x表示SnO与SnO2的混合物),因此,本文对上述材料用“SnOx”作为统称.
1.3 材料的表征
采用X射线衍射仪测定SnOx的晶体结构,X射线源为Cu靶Kα辐射(λ=0.154 nm),扫描范围为20°~80°. 使用场发射扫描电子显微镜表征SnOx的形貌.
1.4 材料的电化学性能测试
以溶剂为N-甲基吡咯烷酮(NMP),按SnOx、导电剂(乙炔黑)、粘结剂(PVDF)的质量比为60∶20∶20,调制成活性物质浆料. 将浆料涂覆于铜箔集流体上,放入真空干燥箱中在100 ℃下干燥 12 h,以此电极片为电池负极,金属锂片为对电极,Celgard 2400微孔聚丙烯膜为隔膜,以含1 mol/L LiPF6的DMC、DEC与EC混合溶液(体积比1∶1∶1)为电解液,在充有高纯氩气的手套箱中装配CR2032型电池.
采用NEWARE电池测试系统和CHI660E电化学工作站进行电化学性能测试. 循环寿命性能测试的电流密度为0.5 A/g,倍率性能测试的电流密度分别为0.2、0.4、0.8、1.0和2.0 A/g. 电池的电化学阻抗的扫描频率选择0.01 Hz.
2 结果与讨论
2.1 纳米SnOx的XRD分析
测试不同浓度的NaOH(0、0.075、0.225和0.525 mol/L)条件下合成样品的XRD图谱(图1),并与标准卡片对比发现:c(NaOH)=0、0.075、0.225 mol/L条件下制备的3个样品的XRD图谱均含SnO2(PDF#41-1445)的衍射峰,归属于(110)、(101)、(211)、(310)、(301)及(321)晶面,三者均为四方晶系金红石相结构的SnO2;而c(NaOH)=0.525 mol/L条件下制备样品的衍射峰对应于SnO(PDF#85-0423)的(101)、(110)、(002)、(200)、(112)、(211)、(202)、(220)及(301)晶面. 因此,在碱性足够强的条件下,SnCl2水解后再经水热法合成的样品为SnO.

图1 不同c(NaOH)制备SnOx样品的XRD图谱
当NaOH较少和较多时,分别发生如下反应[15]:
SnCl2(s)+H2O+1/2O2=SnO2(s)+2HCl,
SnCl2(s)+2NaOH=SnO(s)+2NaCl+H2O.
文献[15]的结果表明,当pH>13时即可生成SnO. 而本实验中,合成样品0.525MNaOH-SnO时,反应体系pH约为14. 为了进一步细化SnO2和SnO转化的pH条件,本文进一步制备NaOH浓度为0.375和0.450 mol/L的2个样品,即0.375MNaOH-SnOx(图1C)和0.450MNaOH-SnO(图1D). 结果表明:当c(NaOH) = 0.375 mol/L(pH 9) 时,样品已不再是纯SnO2,有SnO生成,即由SnO和SnO2混合物相组成;当c(NaOH)=0.450 mol/L(pH 13)时,样品为纯SnO,与0.525MNaOH-SnO的结果一致. 进一步表明,当pH>13时,SnCl2水解生成SnO,与文献[15]的结果相符.
2.2 纳米SnOx的SEM形貌分析
通过扫描电子显微镜观察0MNaOH-SnO2、0.075MNaOH-SnO2、0.225MNaOH-SnO2和0.525MNaOH-SnO的表面形貌(图2),发现这4个样品都呈现无规则块状堆积,样品0.075MNaOH-SnO2更接近片状结构,样品0.525MNaOH-SnO是由纳米棒(长度约为 100 nm)组装而成的花簇状SnO,且每个花簇尺寸(直径约400 nm)结构较均匀.
为了更清晰地了解每个样品的晶粒尺寸,采用谢乐公式计算:
(1)
其中,D为晶粒尺寸,K为谢乐常数(0.89),λ为入射光X-射线波长(Cu Kα射线),θ为衍射角.
利用Jade 6.0软件计算了样品的晶粒尺寸和应力:样品0MNaOH-SnO2(17.9 nm,2.414%)、样品0.075MNaOH-SnO2(13.5 nm,2.014%)、样品0.225MNaOH-SnO2(7.3 nm,1.420%)、样品0.525MNaOH-SnO(54 nm,0.150%). 文献表明:小尺寸纳米颗粒能够缩短Li+的扩散路径和缓冲充放电时的体积变化[17], 相互交叉的网状结构有利于缓冲充放电过程中材料体积的过度膨胀.
2.3 纳米SnOx的比表面积
分别选取样品0.225MNaOH-SnO2和0.525MNaOH-SnO为例测试其BET比表面积、孔容积和孔隙分布(图3). 样品0.225MNaOH-SnO2和0.525MNaOH-SnO的氮气吸脱附等温线均属于IV型吸附等温线[18],比表面积分别为68.64和34.98 m2/g. 从孔隙分布可看出,样品0.225MNaOH-SnO2的孔隙直径主要分布在3.62 nm,孔容积为0.043 cm3/g. 而样品0.525MNaOH-SnO出现了2个尺寸的孔隙直径(3.99和15.40 nm),其中较大的孔隙直径为片-片堆积形成的缝隙,孔容积为0.066 cm3/g. 样品0.225MNaOH-SnO2的比表面积大于0.525MNaOH-SnO,归因于0.225MNaOH-SnO2的小尺寸,而SnO样品较大的孔容积与其相互交叉的花簇状结构有关. 大的比表面积、大的孔容积以及交叉的网状结构均有利于Li+的脱嵌.

图3 不同SnOx样品的BET图
2.4 纳米SnOx的电化学性能
以0.225MNaOH-SnO2为SnO2负极材料,并与样品0.525MNaOH-SnO对比,研究纳米SnOx的电化学性能.
2.4.1 循环伏安特性 在SnO2的循环伏安曲线(图4A)中,首次循环曲线分别在E=1.74、1.11和0.12 V处出现3个还原峰,分别对应于由Sn4+还原为Sn2+、由Sn2+还原为Sn以及形成LixSn (x<4.4)合金的反应[18-19],其中E=1.11 V的还原峰在之后的循环中消失,说明该还原峰对应于不可逆反应(即SEI膜的生成). 而在首次循环曲线中,有3个氧化峰,分别对应LixSn脱合金过程生成单质Sn的反应(E=0.54 V)、Sn氧化为SnO (E=1.23 V)以及SnO氧化为SnO2(E=2.54 V)的反应. 第2、3次循环Sn2+还原为Sn的E左移至0.82 V,表明SEI膜的生成降低了其还原电势;在E=0.50和0.15 V的还原峰分别对应于LixSn的合金化过程. 第2、3次循环的氧化峰与第1次循环峰位和峰电流几乎重合,表明反应的可逆性良好[20]. 由图4B可见,SnO首次循环还原曲线上在E=0.82和0.13 V的2个峰分别对应于SnO还原为Sn以及生成LixSn合金的反应,其中E=0.82 V的峰位还包括生成SEI膜的反应. 在首次循环氧化过程中,在E=0.54~0.80 V范围出现4个氧化峰,分别对应地LixSn合金的分步脱锂反应;E=1.26 V的氧化峰对应Sn氧化为Sn2+的反应. 在第2、3次循环的还原峰电位向右移至0.98 V,接下来的LixSn合金化反应电位均有右移现象,表明其首次循环反应不可逆程度较大. 第2、3次循环的CV曲线重合性好,说明其后续充放电过程中材料能保持相对较稳定的结构.

图4 0.225MNaOH-SnO2和0.525MNaOH-SnO的循环伏安曲线
2.4.2 充放电和微分容量分析 图5A、B分别给出了SnO2和SnO在第1、2、5、10次循环的充放电曲线. 对于样品0.225MNaOH-SnO2和0.525MNaOH-SnO,其首次循环充电/放电容量分别为1 104/1 757和1 059/1 590 mAh/g,首次循环库伦效率分别为62.8%和66.6%,表明SnOx的首次循环充放电不可逆程度都很大. 在0.225MNaOH-SnO2的首次循环充放电曲线上,出现3个拐点:第一个拐点在E≈1.50 V处,表明开始发生Sn4+还原为Sn2+的反应;第二个拐点在E≈1.10 V处,对应Sn2+还原为Sn的反应;第3个拐点在E≈0.50 V处,开始发生LixSn合金反应,对应的放电容量分别约为300 (嵌入约2个Li+)、700 (嵌入2个Li+,伴随SEI膜的生成)和800 mAh/g(嵌入约4.4个Li+). 0.225MNaOH-SnO2的首次循环充电曲线分别在0.5、1.2、2.5 V出现3个拐点,分别对应LixSn脱合金生成Sn、Sn氧化为SnO及SnO氧化为SnO2的反应,对应的充电容量分别约为700、250和140 mAh/g. 结果表明:合金/脱合金过程的可逆性较好,而两步氧化/还原反应可逆性较差,这也是金属氧化物负极材料共有的缺点. 0.525MNaOH-SnO的首次循环充放电曲线(图5B)表现出类似现象,和CV曲线的充放电机理分析结果一致. 另外,图5A、B表明前10次循环SnO2的循环稳定性优于SnO.

图5 充放电曲线
图6A、B进一步给出0.225MNaOH-SnO2、0.525MNaOH-SnO样品在不同循环次数的微分容量曲线,其峰位与CV曲线基本一致,进一步证实SnOx作为锂离子电池负极材料的脱嵌机理.

图6 微分容量曲线
2.4.3 循环稳定性与倍率性能 图7给出了4个样品在0.5 A/g电流密度下的充放电循环寿命,样品0MNaOH-SnO2、0.075MNaOH-SnO2、0.225MNaOH-SnO2的循环容量和稳定性相近,其中0.225MNaOH-SnO2的容量最高、稳定性最好. 3个SnO2样品在前50次循环均表现出明显的容量衰减,之后保持稳定. 循环500次后,0.225MNaOH-SnO2的充电/放电容量保持在286/291 mAh/g,高于样品0MNaOH-SnO2(87/88 mAh/g)和0.075MNaOH-SnO2(140/142 mAh/g). 在相同电流密度下,样品0.525MNaOH-SnO直到第100次循环其容量才趋于稳定,200次循环之后容量反而升高,到第500次的充电/放电容量保持在315/321 mAh/g.
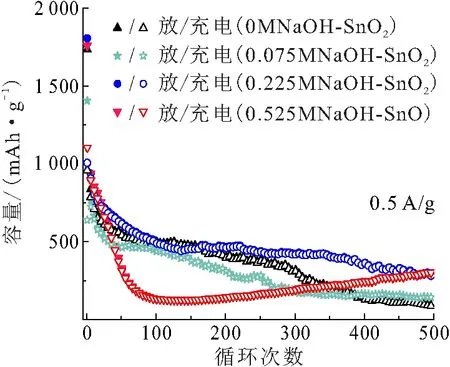
图7 不同SnOx样品的循环性能
图8为0.225MNaOH-SnO2和0.525MNaOH-SnO的倍率性能,电流密度从0.1 A/g依次提高到2.0 A/g,SnO表现出优于SnO2的倍率性能,尤其在高电流密度1.0和2.0 A/g下各循环10次后,SnO的充电/放电容量分别为601/603和548/560 mAh/g,远高于SnO2样品的381/402和348/352 mAh/g. 但是当电流密度回调到较低的0.2 A/g时,样品0.525MNaOH-SnO并没有表现出较高的充电/放电容量,反而低于0.225MNaOH-SnO2(681/700 mAh/g). 另外,0.525MNaOH-SnO在第100次循环时放电容量仅为135 mAh/g,之后才显著升高,而倍率测试显示其在120次循环后放电容量仍保留464 mAh/g. 分析原因:由于该材料的活化以及稳定的SEI膜的形成需要较长的循环周期,而在倍率稳定性测试中,在经过大电流的多次充放电之后,样品0.525MNaOH-SnO的SEI膜提前完成活化.

图8 不同SnOx样品的倍率性能
SnOx样品的循环容量和稳定性的差异与其颗粒尺寸密切相关,0.225MNaOH-SnO2的颗粒尺寸最小,小颗粒缩短了Li+的传输距离,提高了其导电性. 而0.525MNaOH-SnO无论是循环寿命还是倍率性能,都表现出较稳定的结果. 由图7可知,虽然SnO的理论容量低于SnO2,但500次循环后,其容量反而超过了SnO2,这归因于SnO花簇状结构可以缓冲材料在脱嵌Li+过程中体积的过度膨胀,有利于维持材料的结构稳定性,因此表现出最高的循环容量和优异的大倍率充放电稳定性能.
本文SnO2和SnO的循环容量和倍率稳定性都远远优于目前报道的大部分纯SnOx的结果. CHEN等[12]采用水热法合成纯SnO2纳米球,在80 mA/g电流密度下充放电仅50次时,容量降至150 mAh/g. 在倍率性能测试中,240 mA/g电流密度下的容量仅218 mAh/g,当电流密度提高到400 mA/g,容量几乎为0. SUN等[21]报道了3种不同形貌的SnO2锂离子电池负极材料,在0.1 A/g电流密度下循环,网状SnO2容量最高,第60次循环时容量保持在855 mAh/g,高于SnO2纳米颗粒(350 mAh/g)和纳米粉末(251 mAh/g). 在倍率性能测试中,网状SnO2在 1.0、2.0、5.0 A/g电流密度下,放电容量分别为736、636、506 mAh/g,高于SnO2纳米颗粒(427、258、134 mAh/g)以及粉末状SnO2(173、74、36 mAh/g). 表明网状材料具有较优异的储锂电化学性能. JIANG等[22]报道了块状SnO和二维2D-SnO纳米片,并对比了其作为锂离子电池负极材料的性能. 即使在低电流密度(0.05 A/g)下充放电,100次循环后两者的容量都衰减严重(仅为322.9和157.7 mAh/g). 倍率性能表明,在0.5和1.0 A/g电流密度下充放电,SnO纳米片容量分别为545.3和473.6 mAh/g,块状SnO仅为165.4和104.7 mAh/g,远低于本文结果. 因此,调控SnOx的形貌和尺寸是提高其电化学性能的关键因素.
2.4.4 电化学交流阻抗分析 图9A、B给出了0.225MNaOH-SnO2和0.525MNaOH-SnO电池循环前后的阻抗谱. 阻抗谱由位于中高频区的半圆和低频区的直线组成,对应的阻抗模拟等效电路如图9C所示. 半圆直径表示电极材料的SEI膜阻抗(RSEI)和内部电荷转移电阻(Rct),直线的斜率表示电极材料内部Li+的扩散速率,通常斜率越大,扩散速率越高[23]. 由模拟数据可知:循环前,样品0.525MNaOH-SnO的电阻(Rct=137.31 Ω、RSEI=288.42 Ω)和0.225MNaOH-SnO2的电阻(Rct=986.96 Ω、RSEI=175 kΩ)都很大,可能与其电池未完全活化有关. 循环后,0.225MNaOH-SnO2(Rct=24.02 Ω、RSEI=45.68 Ω)和0.525MNaOH-SnO (Rct=14.4 Ω、RSEI=39.39 Ω)都表现出较小的阻抗,说明经过充放电循环,电极材料表面形成结构完善的SEI膜,有利于Li+的传输. 样品0.525MNaOH-SnO的电阻无论循环前后都小于0.225MNaOH-SnO2的电阻,该结果表明:锡基氧化物材料内部及表面形貌(小颗粒和交叉网状结构)的调控有利于提高材料的导电性.

图9 0.225MNaOH-SnO2和0.525MNaOH-SnO电池循环前后的交流阻抗图
3 结论
采用简单的SnCl2水解水热法,利用NaOH调控碱性强弱制备了不同形貌结构的锡基氧化物SnO2和SnO,并探究其储锂性能. 结果表明:当控制体系pH<13时,生成SnO2; 当pH>13时,生成花簇状SnO. 随着pH的增加,生成的SnO2颗粒越小,材料作为锂离子电池负极时的循环性能和倍率性能越稳定. 花簇状的SnO因其网状结构可以缓冲充放电过程中材料的过度收缩与膨胀,因此具有优异的循环稳定性、高的比容量和倍率稳定性.
