基于高通量测序技术分析广味香肠中细菌群落结构和演替规律
2021-04-22王新惠张雅琳孙劲松
王新惠,张雅琳,2,孙劲松,潘 攀,刘 洋,田 甜
(1 成都大学肉类加工四川省重点实验室 成都610106 2 宜宾学院固态发酵资源利用四川省重点实验室 四川宜宾644000 3 成都农业科技职业学院 成都611130)
广味香肠是我国传统的发酵食品,是一种由绞碎的猪肉,再根据原辅料配比加入盐、糖等辅料,搅拌均匀后灌入天然肠衣中,经由自然环境中的菌群发酵制成。广味香肠因具有独特的滋味以及制作工艺简单等特点,而深受消费者的喜爱。
传统的广味香肠发酵和成熟过程是在开放的自然环境中,采用传统工艺制作的香肠往往含有组胺、亚硝酸盐等有害物质,组胺是由能产生氨基酸脱羧酶的微生物作用于游离的组氨基酸而形成的[1]。研究者发现组胺主要是由革兰氏阴性腐败菌产生的[2],主要是肠杆菌科[3];发酵环境中的杂菌也会将硝酸盐还原成亚硝酸盐,而亚硝酸盐能和胺类物质生成亚硝胺,从而诱发癌症[4]。乳酸杆菌可以通过降低环境的pH 值和产生细菌素来提高香肠的微生物安全性[5]。发酵环境中的菌群是引起香肠理化指标和安全性指标变化的主因,并且香肠的质量与风味取决于发酵环境中菌群的结构和变化。吴丽红[6]通过纯培养方式,秦丹[7]通过RAPDPCR 技术,郭明亮[8]通过PCR-DGGE 技术等对香肠内菌群的结构和变化进行分析。PCR 技术是基于微生物纯培养基础上,人们无法摸索香肠内所有微生物生长条件,并且大部分的微生物是无法培养的。纯培养方式能培养的微生物很少,这种分析技术会对香肠内菌群的分析不全面。近几年,高通量测序技术的诞生并广泛应用,弥补了PCR 技术的缺点,其具有处理量大、速度快、准确性高等特点,可对食品菌群多样性及变化规律进行有效分析[9-10]。
目前,对广味香肠发酵过程中细菌群落结构和演变规律的研究较少。通过高通量测序技术对香肠内细菌菌群的丰度和多样性进行测量,能全面了解香肠发酵过程中细菌菌群群落的演变规律。本试验通过高通量测序技术分析广味香肠发酵过程中的细菌结构和演变规律,确定广味香肠发酵过程中的优势菌群,旨在为提高广味香肠风味,控制香肠内有害微生物的生长,减少有害物质生成提供理论依据。
1 材料与方法
1.1 原材料
广味香肠:卫生检疫合格的猪肉、天然肠衣、食用级盐、味精和糖等辅料购于成都市龙泉驿区成都大学十陵鑫大百货超市。
1.2 试剂与仪器
脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)、溶菌酶、RNase A、蛋白酶K,均购于生工生物工程(上海)股份有限公司;溴化十六烷基三甲胺(CTAB)、琼脂糖,美国Sigma 公司;AxyPrep DNA 凝胶回收试剂盒,上海百塞生物技术有限公司;E.Z.N.ATMMag-Bind Soil DNA Kit 提取试剂盒,美国OMEGA;乙二胺四乙酸(EDTA)、盐酸、磷酸三钠、氯化钠、氯仿、异戊醇、无水乙醇等,均购于成都市科隆化学品有限公司。
ND-2000C 微量紫外分光光度计,美国Nano Drop 公司;5810R 台式高速冷冻离心机,德国Eppendorf 公司;琼脂糖凝胶电泳仪,美国Bio-Rad;DYCZ-21 型电泳槽,北京市六一仪器厂。
1.3 试验方法
1.3.1 广味香肠的制作和样品的采集 广味香肠制作工艺流程:原料肉→修整→腌制→绞碎→拌料→灌肠→发酵(22~25 ℃,相对湿度90%~95%)→成熟(15~18 ℃,相对湿度70%~80%)。
样品的采集:在发酵的第0,10,20 和30 天采样。
1.3.2 DNA 的提取 取一段广味香肠,参照E.Z.N.ATMMag-Bind Soil DNA Kit 提取试剂盒中的方法提取广味香肠样品宏基因组DNA,然后使用乙醇将DNA 进行沉淀,最后采用微量紫外分光光度计对提取的DNA 纯度和浓度进行测定,在260 nm 和280 nm 的波长下测定DNA 的吸光度。
1.3.3 PCR 扩增和测序 采用引物515F 5’-GT GCCAGCMGCCGCGGTAA-3’ 和805R 5’-GACTG GAGTTCCTTGGCACCCGAGAATTCCAGGACTACH VGGGTATCTAATCC-3’ 对细菌16S rRNA 的V4区域进行扩增,PCR 反应用15 μL 高保真酶(Phusion Flash High-Fidelity PCR Master Mix),0.2 μmol/L 引物和大约10 ng 模板DNA 进行。为了减少与引物延伸相关的可能偏差,进行两步分析PCR 技术,其中第1 个PCR 步骤使用未标记的引物进行25 个循环;第2 个PCR 步骤用标记的引物进行5 个循环,第一步的产物用作模板。第1个PCR 步骤:在94 ℃下预变性3 min,在94 ℃下变性30 min,在45 ℃下退火20 min,在65 ℃下延伸30 min,重复进行25 个循环,在72 ℃下保持5 min。第2 个PCR 步骤:在95 ℃下预变性3 min,在94 ℃变性20 s,在55 ℃退火20 s,在72 ℃下伸长30 s,最后在72 ℃下拉伸5 min,重复进行5 个循环。
1.3.4 数据分析 通过匹配特定的条形码将高通量测序数据分类到不同的样品中。然后,使用FASTX-Toolkits 的收集命令行工具(http://hannonlab.cshl.edu/fastx_toolkit/)修剪引物,条形码和适配器[11-13],对序列数据进行过滤,多路复用并准备用于统计分析。剩下的序列称为有效序列。为有效序列分析进行了操作分类单元(OTU)和基于分类法的方法。通过使用Mothur v1.30.0[14]将有效序列聚集到截止水平为3%的OTU 中,而分类法矩阵则以固定的置信度获得使用Rv 3.0.0[1]与Vegan package[15]的阈值为80%。用QIIME 评估α 多样性以代表单个样品中的细菌生物多样性。计算稀释曲线,Shannon 多样性指数,Chao 1 丰富度和Good’s 覆盖度以评估α 多样性[16]。
2 结果与分析
2.1 广味香肠中细菌群落α-多样性分析
广味香肠发酵过程中细菌菌群的多样性如表1所示,可以看出,广味香肠内细菌群落的丰度和多样性都是随着时间先升高后降低,最后再升高的一个过程。在第20 天时,细菌群落的多样性最低,而在第0 天时,细菌的丰度最低,在第30 天时,细菌群落的丰度和多样性最高。在发酵的第0天时,细菌菌群多样性较高,菌群主要来源于猪肉、天然肠衣以及辅料等。在发酵的前10 天,细菌菌群丰度和多样性呈上升趋势,首先是原材料中菌群增长,其次是自然环境中的微生物进入香肠内开始增长。在第20 天时,细菌菌群丰度和多样性降低,可能是大部分的细菌无法适应低pH 的环境,导致生长受到抑制[17],或者是因为一些细菌能产生细菌素等抑制了腐败致病菌的生长。在第30 天时,细菌菌群的丰度和多样性有所增加,可能的原因是:第一,因为发酵环境的pH 值过低,不仅会影响发酵环境中杂菌等的生长,也会影响乳酸菌自身的增长和代谢,所以乳酸菌的代谢被抑制,杂菌开始生长;第二,蛋白质、糖类等大分子物质被分解后产生的小分子物质刺激了某些只能代谢氨基酸、葡萄糖等的菌群的生长;第三,由于发酵环境中乳酸菌被抑制,因此外界环境中的其它菌群进入香肠内增长。广味香肠发酵过程中发酵环境中的菌群处于动态变化,发酵环境和自然环境中的微生物也可以动态交替,这是广味香肠独特风味的来源,但也会造成自然环境中的致病腐败菌进入发酵环境中,在香肠内产生有害物质。
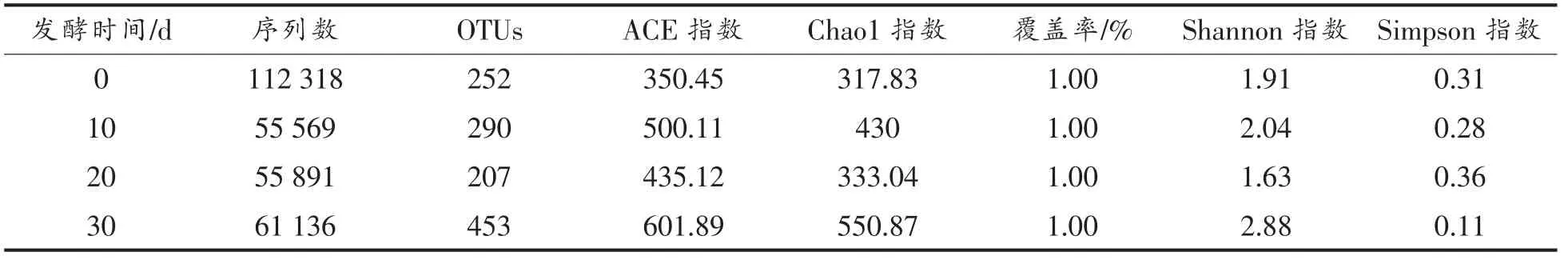
表1 广味香肠发酵过程中细菌群落丰度和多样性Table 1 Bacterial community abundance and diversity during fermentation of cantonese sausage
2.2 广味香肠中细菌群落多样性曲线和韦恩图(Venn)分析
Shannon-Wiener 曲线可以比较广味香肠内因为测序数据量不同时菌群的多样性和丰度,也可以对样品的测序量是否合理作出判断[9]。从图1a中看出,每个时期的Shannon-Wiener 曲线最终都趋于平衡,这说明测序的合理性,再继续添加测序量,也不会产生较多的OTU。
广味香肠每个发酵阶段的OTU 数目如表1所示,可以从图1b 中看出,在发酵刚开始时有252 个OTUs,在发酵第10 天时,有290 个OTUs,在发酵第20 天时,有207 个OTUs,在发酵第30天时,有453 个OTUs。但是仅有42 个OTUs 存在于广味香肠发酵的整个过程中,这表明在广味香肠发酵过程中,香肠内的细菌菌群结构变化很大。
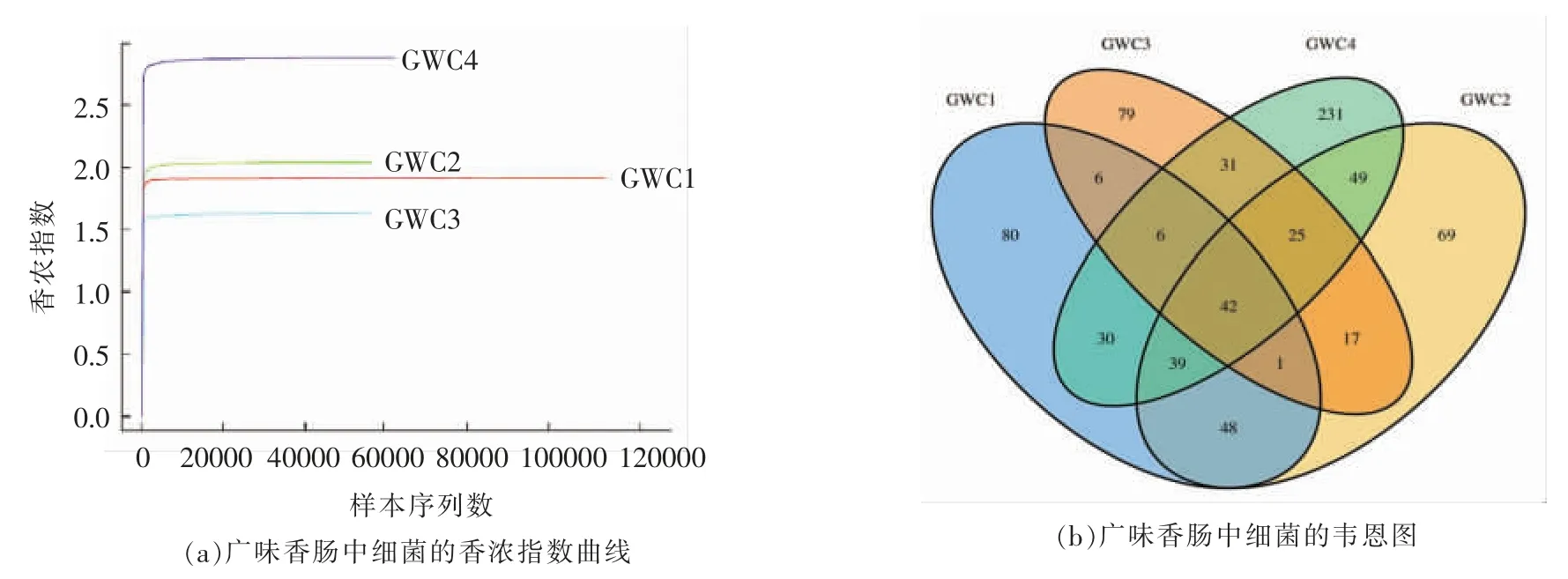
图1 广味香肠细菌多样性曲线和韦恩图Fig.1 Bacterial Shannon-Wiener curve of flora and Venn diagram of cantonese sausage
2.3 广味香肠发酵过程中细菌群落在门水平的结构分布以及动态变化
广味香肠在不同的发酵时间细菌菌落在门水平上的结构分布如图2所示,在广味香肠中检测出17 个门,其中最主要的门是厚壁菌门(Firmicutes)、变形杆菌门 (Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)。其中,厚壁菌门和变形菌门在整个发酵过程中占优势地位。厚壁菌门从最初发酵时的19.44%,随着发酵时间先增加,在第20 天时,厚壁菌门占比95.4%,随后在发酵结束时减小到87.46%,而变形菌门则随着时间从最初的77.66%,到第20 天时,减少到0.09%,但是在发酵结束时,增加到11%,拟杆菌门在最初发酵时和发酵最后阶段时占比变化不大,分别为2.89%和1.44%。而放线菌门在整个发酵过程中的占比一直处于较低的状况,在发酵结束时,放线菌门达到最大的占比是0.08%。
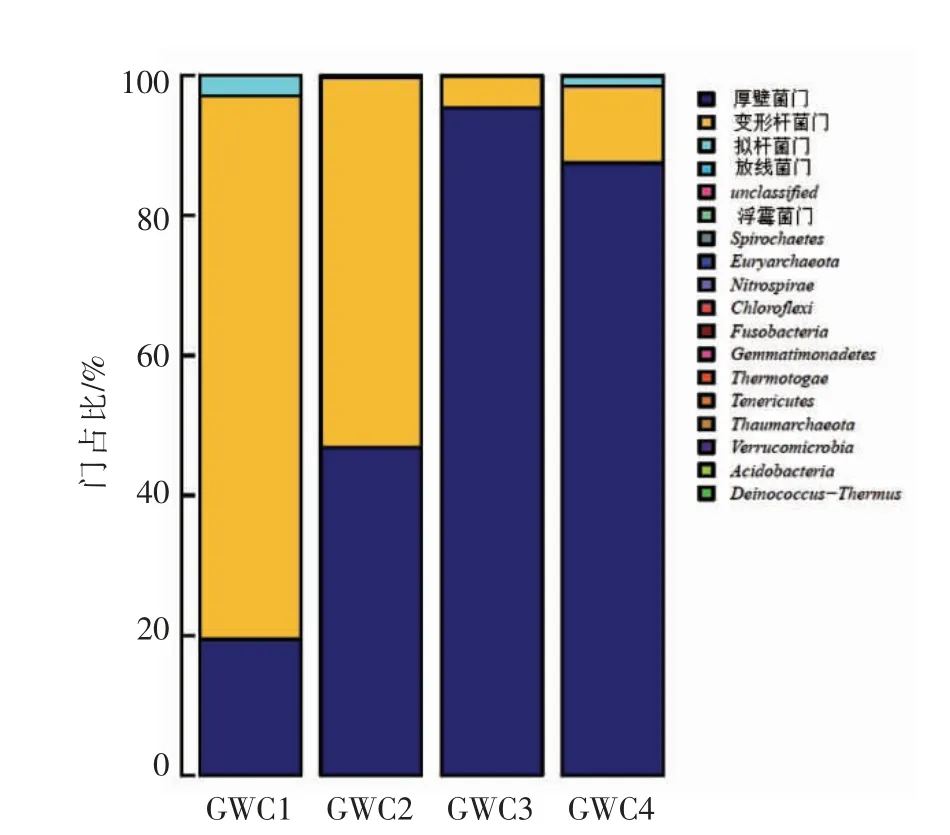
图2 广味香肠发酵过程中细菌群落在门水平的分布Fig.2 Relative abundance of bacteria community proportions at phylum in cantonese sausage
2.4 广味香肠发酵过程中细菌群落在属水平的结构分布及动态变化
广味香肠发酵过程中细菌群落在属水平的结构如图3所示,在属水平上,广味香肠中较多的是弧菌属 (Vibrio spp.)、乳酸杆菌属(Lactobacillus spp.)、魏斯氏菌属(Weissella spp.)、不动杆菌属(Acinetobacter spp.)、环丝菌属(Brochothrix spp.)、肠杆菌属(Enterobacter spp.)、耶尔森氏菌属(Yersinia spp.)。其中弧菌属、不动杆菌属、环丝菌属、肠杆菌属和耶尔森氏菌属是腐败致病菌,可以看出在第0 天时,弧菌属占比54.13%,不动杆菌属占比10.01%,肠杆菌属占比6.94%,耶尔森氏菌属占比5.35%,环丝菌属占比3.09%,而在第20天时,这些菌群的占比降低到最低值,弧菌属占比1.25%,不动杆菌属占比0.19%、肠杆菌属占比1.07%、耶尔森氏菌属占比1.74%、环丝菌属占比0.17%。从表1和图3共同得出,在第20 天时,香肠内的细菌群落的多样性最低,是因为乳酸杆菌属成为优势菌属,抑制了发酵环境中的腐败致病菌。
弧菌是食品中的致病菌,弧菌严重威胁消费者的健康,会引发急性胃肠炎、腹泻、头痛、呕吐等[18]。在第10 天时,弧菌属是优势菌属,占比50.23%,在发酵结束时,弧菌属占比降到了1.66%,弧菌属的生长受到了抑制。弧菌属能代谢葡萄糖[19],在发酵前期,乳酸杆菌属增长较慢,发酵环境中的pH变化不大,所以没有很大程度的抑制弧菌属的增长,但在第20 天时,环境的pH 下降,乳酸杆菌属成为优势菌属,抑制了弧菌属的增长[19]。不动杆菌属是肉制品中常见的腐败菌之一,不耐酸,是非葡萄糖发酵菌属[20],所以不动杆菌属一直被抑制。魏斯氏菌属有利于香肠的风味和安全。在发酵的前10 天,随着发酵时间在增长,但在第20 天时,魏斯氏菌属在发酵环境中占比降到了8.2%。在第30天时,魏斯氏菌属成为优势菌属,占比是37.96%。因为魏斯氏菌属可以代谢碳水化合物,所以在前期呈增长趋势,此外魏斯氏菌属和乳酸杆菌属是竞争关系。但是魏斯氏菌属可以合成葡萄聚糖、异麦芽低聚糖等低聚糖来促进乳酸杆菌属中益生菌的增长[21],导致乳酸杆菌属的增长速度远高于魏斯氏菌属,所以在第20 天时,魏斯氏菌属的占比降低;但在第30 天时,乳酸杆菌属减少,魏斯菌属增加。片球菌属(Pediococcus spp.)和葡萄球菌属(Staphyococcus spp.)可以提升香肠的风味和降低发酵环境中组胺的含量[22],在发酵初期,两个菌属的总占比低于0.26%,在第10 天时,片球菌属和葡萄球菌属占比达到最高,分别是3.19%和0.28%,在第20 天降低也有可能是因为乳酸杆菌属的增加而导致。乳酸杆菌属可以发酵糖类产生乳酸,降低发酵环境的pH,抑制有害菌群和酶的活性,也可以产生细菌素来抑制致病腐败菌。乳酸杆菌属随着时间先增加后降低,在第20 天时,乳酸杆菌属成为优势菌属,占比达84.61%,但是在发酵结束时,乳酸杆菌属的占比降到29.88%,可能是因为乳酸杆菌属处于低pH 的发酵环境,增长会受到抑制,亦或是因为乳酸杆菌属的菌群开始进入衰亡期,增长速度和代谢速度减慢,导致其它竞争菌群增加,所以在第30 天时,广味香肠内的乳酸杆菌属的占比降低。
从图3中可以在属的水平上分析广味香肠内细菌群落结构的动态变化,乳酸杆菌属是香肠发酵过程中的优势菌属,在发酵第20 天时,占比是84.61%,发酵环境中细菌的多样性和丰富最低,抑制了广味香肠中的致病腐败菌。广味香肠发酵过程中细菌菌群结构变化大,是因为乳酸杆菌属的动态变化和发酵环境的开放性。
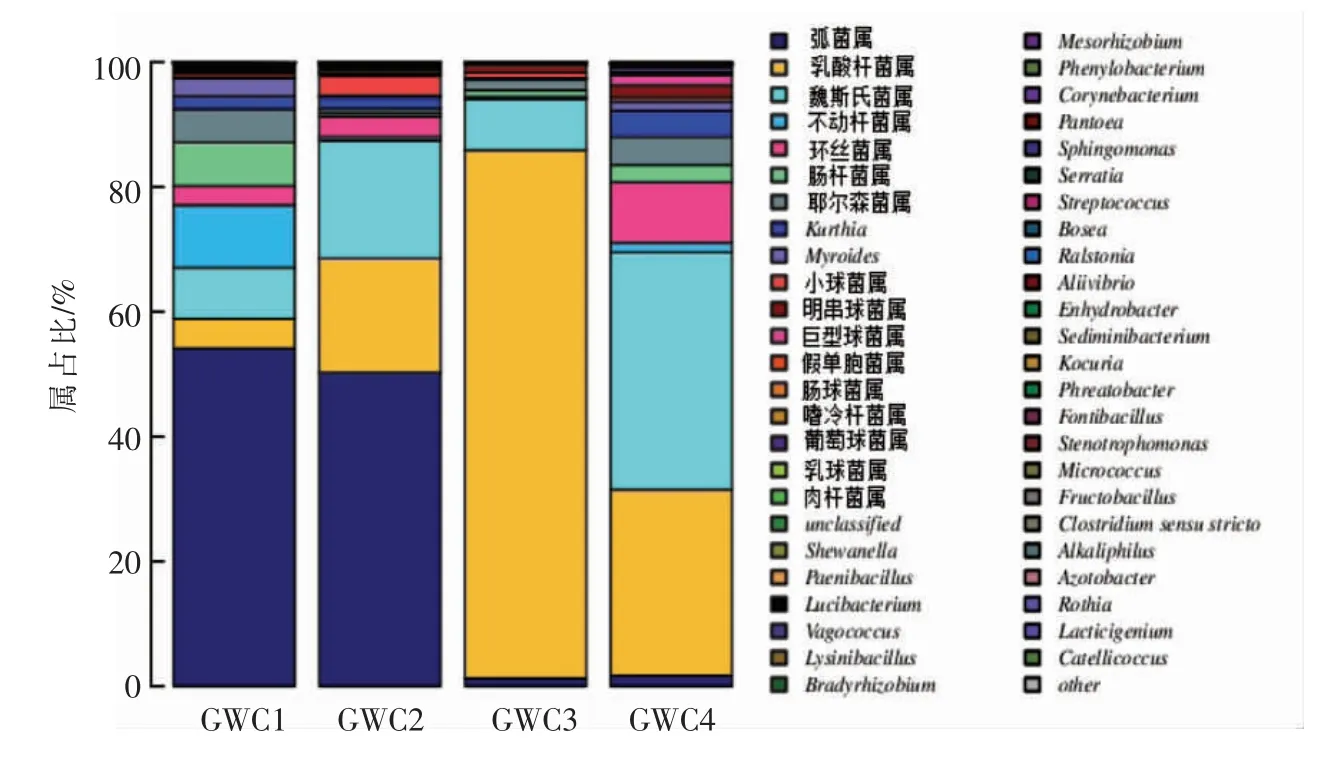
图3 广味香肠发酵过程中细菌群落在属水平的分布Fig.3 Relative abundance of bacteria community proportions at genus in cantonese sausage
2.5 广味香肠中细菌功能丰度热图
广味香肠中细菌功能丰度热图如图4所示,颜色块代表功能的丰度值,颜色越红代表丰度越高,相反则表示丰度越低。从图4中看出,主要有膜运输(Membrane Transport)、糖代谢(Carbohydrate Metabolism)和氨基酸代谢 (Amino Acid Metabolism)这3 个功能。膜运输功能丰度最大,菌群的增长需要营养物质,只有营养物质进入细胞内被利用才能保证菌群的正常生长和繁殖;而糖代谢和氨基酸代谢都是香肠风味形成的主要反应[22]。在第20 天时,膜运输、糖代谢和氨基酸代谢功能较其它时间段稍低,说明这些功能在第20天时被抑制,原因可能是发酵环境的pH 值降低,导致菌群自身的代谢减慢,pH 也会影响某些代谢物质跨膜的能力。广味香肠内的细菌菌群的动态变化,不仅会影响发酵产品的安全性,也会影响产品风味物质等的生成。
3 结论
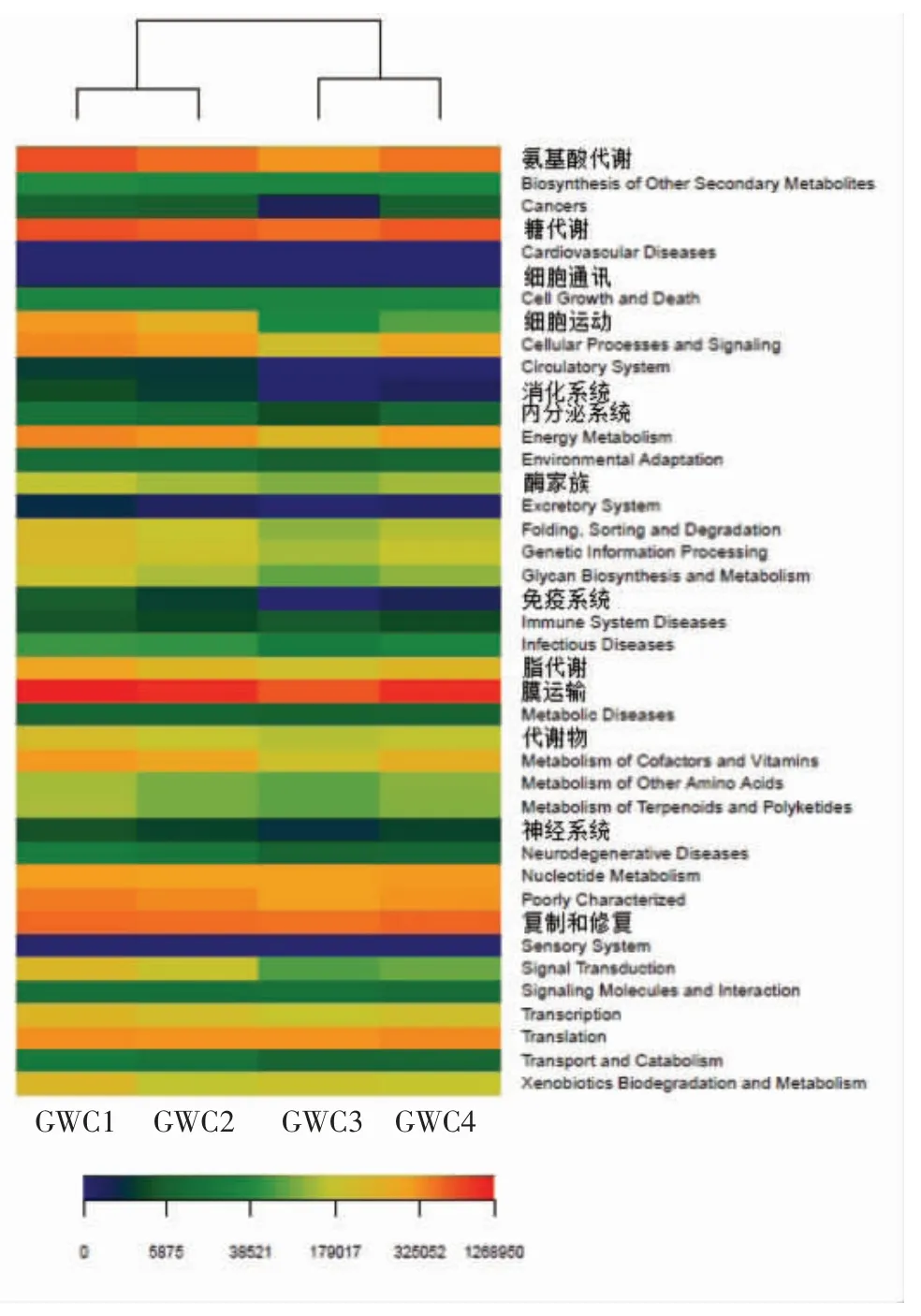
图4 广味香肠中细菌的功能丰度热图Fig.4 Bacterial function abundance heatmap of cantonese sausage
对广味香肠自然发酵过程中细菌群落的结构和演变进行了研究,发现广味香肠内细菌的多样性和丰度随着发酵时间先增加后降低,最后再增加的过程,在门的水平上对广味香肠中细菌群落进行分析,发现主要有厚壁菌门(Firmicutes)、变形杆菌门 (Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)这4 个门,并且厚壁菌门是优势菌门;在属的水平上对广味香肠中细菌群落进行分析,发现主要有弧菌属(Vibrio spp.)、乳酸杆菌属(Lactobacillus spp.)、魏斯氏菌属(Weissella spp.)、不动杆菌属(Acinetobacter spp.)、环丝菌属(Brochothrix spp.)、肠杆菌属(Enterobacter spp.)、耶尔森氏菌属(Yersinia spp.),乳酸菌属是优势菌属,在第20 天时,发酵环境中占比是84.61%。
结果表明,通过高通量测序对广味香肠自然发酵过程中细菌群落结构和演变进行研究,发酵环境中的菌群结构和多样性变化较大,发酵环境中的优势菌属乳酸杆菌属不仅会影响细菌菌群结构的变化,并且会影响香肠风味物质等的生成。
