2种乳酸杆菌肠道黏膜免疫调节作用的比较
2014-03-26郝凤奇李景梅李成玉杨桂连
郝凤奇,李景梅,李成玉,杨桂连
(1 长春理工大学 生命科学技术学院,吉林 长春 130022;2 吉林农业大学 动物科学技术学院,吉林 长春 130118)
乳酸菌是一类能利用可发酵性糖产生大量乳酸细菌的总称,目前在自然界已发现的这类细菌,在分类学上至少有23个属[1],其中乳酸杆菌属在食品、医药等领域应用较多[2]。人类肠道和发酵乳制品中分离的乳酸杆菌被公认为是“安全级”(Generally regarded as safe,GRAS)的微生物,具有益生特性,乳酸杆菌属的某些菌株在肠道黏膜免疫调节中发挥着重要作用[3]。然而该菌属种类繁多,对肠道细胞因子分泌、T细胞增殖、sIgA水平的影响也存在菌种间差异。因此,明确不同种类乳酸杆菌对肠道黏膜免疫的调节作用,特别是对辅助性T细胞(Th细胞)极化状态的影响具有重要意义。
本试验采用嗜酸乳酸杆菌(Lactobacillusacidophilus)和植物乳酸杆菌(Lactobacillusplantarum)灌胃C57BL/6小鼠,通过检测脾脏和肠系膜淋巴结中T细胞亚群、结肠PP结中Toll样受体2阳性(TLR2+)和Toll样受体4阳性(TLR4+)细胞比例、结肠组织干扰素γ(IFN-γ)和白介素4(IL-4)水平、小肠sIgA水平等指标,在细胞和分子水平上对2种乳酸杆菌的肠道黏膜免疫调节作用进行了比较研究,以期为深入研究乳酸杆菌的免疫调节作用机制和信号传导途径提供有价值的参考,对乳酸杆菌应用于功能性食品、保健品或新型动物肠道微生态制剂具有一定的指导意义。
1 材料与方法
1.1 材 料
1.1.1 菌 株 本试验所用嗜酸乳酸杆菌、植物乳酸杆菌由吉林农业大学动物微生态学实验室保存。
1.1.2 培养基和主要试剂 乳酸杆菌MRS培养基;蛋白酶抑制剂混合物,购自罗氏公司;小鼠IFN-γ、IL-4、sIgA ELISA试剂盒,购自R&D公司;Anti-mCD3-FITC、Anti-mCD4-APC、Anti-mCD8-PE、Anti-mTLR2-FITC、Anti-mTLR4-PE单克隆抗体、FACS buffer,购自BD公司;RPMI1640培养基,购自Gibco公司。
1.1.3 Green-berger Lysis Buffer的配制 150 mmol/L NaCl,15 mmol/L Tris,1 mmol/L MgCl·6H2O,1 mmol/L CaCl2,1% Triton,使用时按1∶100(体积比)加入蛋白酶抑制剂混合物。
1.1.4 试验动物 C57BL/6雌性小鼠,30只,体质量18~22 g/只,购自北京维通利华实验动物技术有限公司。
1.2 方 法
1.2.1 乳酸杆菌悬液的制备 采用MRS培养基,常规微生物培养方法分别培养嗜酸乳酸杆菌、植物乳酸杆菌菌种,待菌液OD600值为0.6~0.8时,4 ℃、6 000 r/min离心2 min,菌体沉淀用1×PBS(pH 7.4)清洗3次后,制成108CFU/mL菌体悬液。
1.2.2 试验动物分组及处理 试验小鼠平均分成3组(嗜酸乳酸杆菌组、植物乳酸杆菌组和对照组),SPF条件下饲养,自由饮水和采食,12 h光照,12 h黑暗,小鼠适应性饲养15 d后进行正式试验,正式试验期7 d 。正式试验期内,嗜酸乳酸杆菌组、植物乳酸杆菌组小鼠分别灌胃嗜酸乳酸杆菌或植物乳酸杆菌菌体悬液1 mL/(只·d)、对照组小鼠灌胃等体积PBS液。各组小鼠每天清晨饲喂前称体质量。第8天,颈椎脱臼法处死小鼠,打开腹腔,无菌条件下取脾脏、肠系膜淋巴结、小肠、结肠PP结、结肠等组织用于指标检测。
1.2.3 脾脏、肠系膜淋巴结、结肠PP结细胞悬液的制备 将脾脏、肠系膜淋巴结、结肠PP结分别置于盛放有RPMI1640培养基的平皿中,注射器末端研磨后,过无菌筛网制成细胞悬液,4 ℃下2 000 r/min 离心5 min,弃上清,细胞沉淀用PBS洗涤2次,加入适量RPMI1640培养基计数。
1.2.4 流式细胞仪检测 分别取1.2.3制备的各组织细胞悬液200 μL,加入2.0 mL FACS Buffer,1 500 r/min离心5 min,弃上清,细胞沉淀用PBS洗涤2次。细胞用FACS Buffer混匀,加入到Tube管中,调整细胞数量为106/管,每管加入10 μL荧光标记抗体(CD3+CD4+和CD3+CD8+T细胞测定采用Anti-mCD3-FITC、Anti-mCD4-APC、Anti-mCD8-PE单克隆抗体;TLR2+和TLR4+细胞测定采用Anti-mTLR2-FITC、Anti-mTLR4-PE单克隆抗体),4 ℃避光作用30 min,FACS Buffer洗涤2次,最后溶于100 μL FACS Buffer 中,加入10 μL多聚甲醛固定,进行BD流式细胞仪(Canto)检测。
1.2.5 结肠组织IFN-γ和IL-4的测定 将摘除PP结的结肠组织在冰预冷的Green-berger Lysis Buffer中制成组织匀浆,采用ELISA试剂盒,按照说明书操作检测IFN-γ和IL-4的含量。
1.2.6 肠道黏膜总sIgA水平的测定 取幽门下至回盲结合部约15 cm小肠肠段,纵行剪开,用无菌1×PBS(pH 7.4)缓慢冲洗肠腔后,刮取肠黏膜表面黏液层,收集于1.5 mL 无菌离心管中,加入0.5 mL无菌1×PBS(pH 7.4,含蛋白酶抑制剂混合物)混匀后,于4 ℃下12 000 r/min离心10 min,取上清,按照ELISA试剂盒说明书操作,测定肠道黏膜总sIgA水平。
1.3 数据统计与分析
采用Graphpad Prism 6.0对数据进行统计分析并绘图,结果用“平均数±标准差”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 各组小鼠体质量变化
正式试验结束时,对照组、嗜酸乳酸杆菌组和植物乳酸杆菌组小鼠体质量分别为(20.19±0.48)、(20.55±0.45)、(19.77±0.31) g/只,各组小鼠体质量无显著差异(P>0.05)。
2.2 2种乳酸杆菌对小鼠脾脏和淋巴结中CD4+、CD8+T细胞比例的影响
由图1可知,嗜酸乳酸杆菌组小鼠肠系膜淋巴结中CD3+CD4+、CD3+CD8+T细胞比例分别为(41.0±1.2)%和(25.3±1.0)%,植物乳酸杆菌组分别为(42.0±1.0)%和(30.5±0.9)%,均显著高于对照组(P<0.05);嗜酸乳酸杆菌组与植物乳酸杆菌组相比,肠系膜淋巴结中CD3+CD4+T细胞比例无显著差异(P>0.05),而CD3+CD8+T细胞比例植物乳酸杆菌组显著高于嗜酸乳酸杆菌组(P<0.05)。结果表明,嗜酸乳酸杆菌和植物乳酸杆菌均可显著提高小鼠肠系膜淋巴结中CD3+CD4+、CD3+CD8+T细胞比例,且与嗜酸乳酸杆菌相比,植物乳酸杆菌更倾向于提高CD3+CD8+T细胞亚群的比例。而2种乳酸杆菌对脾脏中CD3+CD4+、CD3+CD8+T细胞比例均无显著影响(P>0.05)。
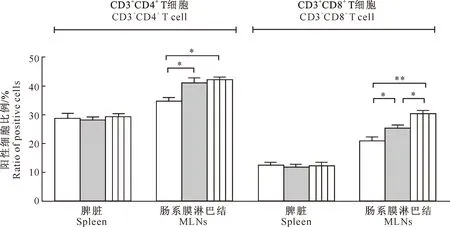
图1 嗜酸乳酸杆菌和植物乳酸杆菌对小鼠脾脏与肠系膜淋巴结中CD3+CD4+、CD3+CD8+T细胞比例的影响
2.3 2种乳酸杆菌对小鼠结肠PP结中TLR2+和TLR4+细胞比例的影响
由图2可知,嗜酸乳酸杆菌组小鼠结肠PP结中TLR2+和TLR4+细胞比例分别为(44.7±4.2)%和(26.9±2.4)%,植物乳酸杆菌组分别为(47.0±5.1)%和(25.8±2.3)%。与对照组相比,嗜酸乳酸杆菌和植物乳酸杆菌均极显著提高了TLR2+细胞比例(P<0.01),而对TLR4+细胞比例无显著影响(P>0.05)。
2.4 2种乳酸杆菌对小鼠结肠中IFN-γ和IL-4水平的影响
由图3可以看出,嗜酸乳酸杆菌组小鼠结肠组织中IFN-γ和IL-4含量分别为(257.23±5.34)和(278.98±4.57) pg/mL,植物乳酸杆菌组分别为(264.16±6.24)和(191.55±6.70) pg/mL;与对照组相比,嗜酸乳酸杆菌和植物乳酸杆菌均可极显著提高IFN-γ水平(P<0.01);嗜酸乳酸杆菌可极显著提高IL-4水平(P<0.01),植物乳酸杆菌对IL-4无显著影响(P>0.05)。
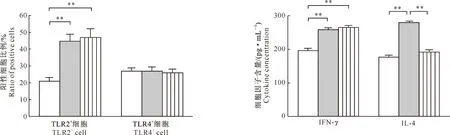
图2 嗜酸乳酸杆菌和植物乳酸杆菌对小鼠结肠PP结中TLR2+及TLR4+细胞比例的影响
2.5 2种乳酸杆菌对肠道sIgA水平的影响
由图4可知,嗜酸乳酸杆菌组、植物乳酸杆菌组小鼠肠道sIgA水平分别为(1.31±0.05)和(1.28±0.03) μg/mL;与对照组相比,2种乳酸杆菌均可显著提高肠道黏膜sIgA的水平(P<0.05)。
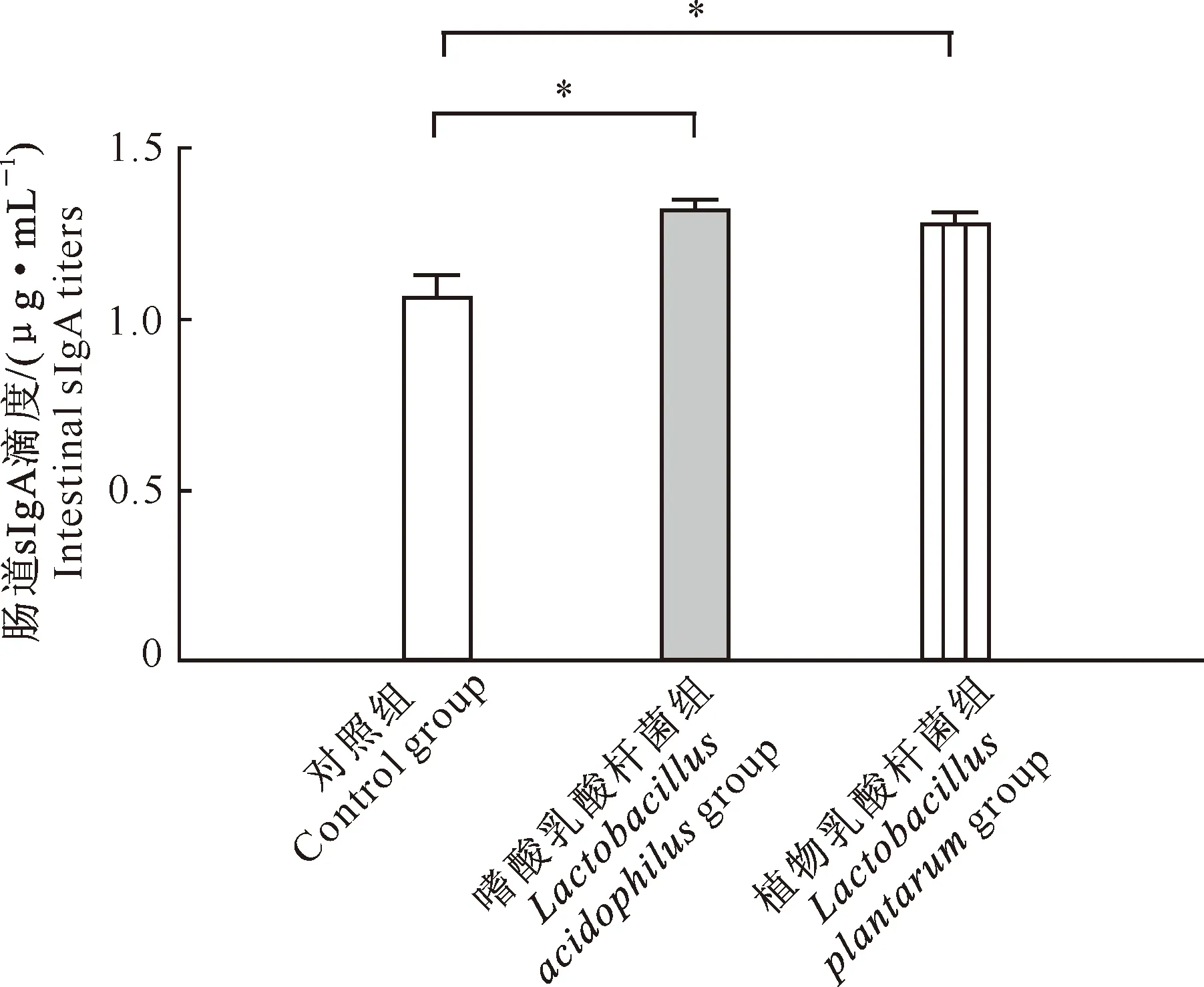
图4 嗜酸乳酸杆菌和植物乳酸杆菌对小鼠肠道sIgA水平的影响
3 讨 论
乳酸杆菌能够调节机体的固有免疫和适应性免疫,包括调节细胞因子的产生、诱导免疫效应细胞表面受体分子成熟、促进淋巴细胞增殖、提高抗体水平等[3-6]。Th1/Th2型免疫应答是机体针对内外环境不良因素产生的基本应答类型,二者间的平衡对于维持机体免疫稳态至关重要[7]。根据参与Th1/Th2型免疫应答,可将细胞因子分为Th1和Th2型细胞因子,2种类型的细胞因子通过重叠或拮抗作用,以网络的方式调控Th1/Th2免疫应答间的平衡[8]。IFN-γ和IL-4分别是Th1型、Th2型细胞因子的典型代表[8],本试验中,嗜酸乳酸杆菌能够同时上调结肠组织中IFN-γ和IL-4水平,而植物乳酸杆菌仅能上调IFN-γ水平,说明嗜酸乳酸杆菌能够同时提高Th1和Th2型免疫应答水平,植物乳酸杆菌只能提高Th1型免疫应答水平。
Th0细胞在Th1或Th2型细胞因子的作用下可分化为Th1和Th2型细胞亚群。Th1型细胞亚群表面表达CD3+CD8+,Th2型细胞亚群表达CD3+CD4+,T细胞亚群的比例对于评价机体的免疫水平具有重要意义[9]。脾脏是淋巴细胞的定居地,作为最大的外周免疫器官,负责对血源抗原产生免疫应答,Tsai等[10]研究表明,BALB/c小鼠口服含有109CFU/mL 副干酪乳酸杆菌副干酪亚种NTU 101(L.paracaseisubsp.paracaseiNTU 101)的MRS肉汤后,第3、6、9周脾脏中CD3+CD4+和CD3+CD8+T细胞亚群比例均显著高于对照组。本研究中,嗜酸乳酸杆菌和植物乳酸杆菌对脾脏中CD3+CD4+和CD3+CD8+T细胞比例的影响均无显著差异。推测可能有以下2方面原因:①嗜酸乳酸杆菌和植物乳酸杆菌灌胃时间短,不足以刺激脾脏中T细胞亚群的分化;②Tsai等[10]所用的含有乳酸杆菌的MRS菌液,菌液成分复杂,含有氨基酸、小分子碳水化合物等次级代谢产物,因此CD3+CD4+和CD3+CD8+T细胞亚群比例的增加是否与次级代谢产物、或菌株间的协同作用有关尚不可知。肠系膜淋巴结是肠道的引流淋巴结,也是免疫应答的主要场所,肠系膜淋巴结内T细胞亚群的变化对宿主的黏膜免疫应答发挥着重要作用。本研究中嗜酸乳酸杆菌和植物乳酸杆菌均能显著提高小鼠肠系膜淋巴结中CD3+T细胞比例,且植物乳酸杆菌更倾向于提高CD3+CD8+T细胞亚群比例,进一步说明该菌具有促进Th0细胞向Th1型方向极化的潜能。
细胞因子作为免疫调控网络中的重要效应性分子,其上游信号来自于邻近淋巴组织中免疫细胞表面的模式识别受体对相应配体的识别[11]。结肠PP结是分布在结肠组织中的次级淋巴器官,富含树突细胞(DCs)、巨噬细胞(Mφ)及T、B细胞,是结肠组织发挥局部黏膜免疫应答的主要场所[12]。DCs是机体重要的抗原递呈细胞(APCs),其表面分布多种模式识别受体,如Toll样受体(TLR)、C型凝集素受体(CLR)和NOD样受体(NLR)[13]。目前,在哺乳动物和人体中已发现了13种TLR,其通过识别不同的配体信息激活转录核因子NF-κB,进而分泌不同种类的细胞因子,调控机体的免疫状态[11]。已经证实,TLR2和TLR4的配体分别是细菌细胞壁成分的肽聚糖和脂多糖[14],乳酸杆菌是G+菌,菌体表面肽聚糖成分较多。本试验中嗜酸乳酸杆菌和植物乳酸杆菌均显著提高了结肠PP结中TLR2+细胞数量,对TLR4+细胞数量无显著影响,说明TLR2在介导嗜酸乳酸杆菌和植物乳酸杆菌的免疫调节作用中发挥着主要作用,进而引发细胞因子的产生。
sIgA是参与黏膜局部体液免疫应答的主要抗体。乳酸杆菌能够通过活化APCs,或通过调节肠道菌群平衡的方式,直接或间接促进肠道sIgA产生[15-16]。本研究中嗜酸乳酸杆菌和植物乳酸杆菌均能显著提高小肠sIgA水平,表明2种乳酸杆菌均能够提高肠道黏膜局部的体液免疫功能,但具体的作用机制有待于进一步探讨。
本试验结果表明,2株乳酸杆菌均可提高结肠PP结中TLR2+细胞比例,而对TLR4+细胞比例无显著影响,嗜酸乳酸杆菌上调Th1和Th2型免疫反应,植物乳酸杆菌上调Th1型免疫反应,2株乳酸杆菌在肠道黏膜免疫调节作用方面存在差异。然而,2种乳酸杆菌同时灌胃小鼠是否存在免疫调节的协同作用及其机制值得深入研究。
[参考文献]
[1] 凌代文,东秀珠.乳酸细菌分类鉴定及实验方法 [M].北京:中国轻工业出版社,1999:1-3.
Ling D W,Dong X Z.Identification and experiment methods of lactic acid bacteria [M].Beijing:China Light Industry Press,1999:1-3.(in Chinese)
[2] 艾连中.干酪乳杆菌LC2W胞外多糖制备、功能及结构的研究 [D].江苏无锡:江南大学,2007.
Ai L Z.Study on preparation,function and structure of exopolysaccharides fromLactobacilluscaseiLC2W [D].Wuxi,Jiangsu:Jiangnan University,2007.(in Chinese)
[3] Charalambos K,Andreas K,Evanthia L T,et al.Evaluation of adhesion capacity,cell surface traits and immunomodulatory activity of presumptive probioticLactobacillusstrains [J].International Journal of Food Microbiology,2010,140:154-163.
[4] Dogi C,Maldonado-Galdeano C,Perdigón G A,et al.Gut immune stimulation by non pathogenic Gram (+) and Gram (-) bacteria.Comparison with a probiotic strain [J].Cytokine,2008,41:223-231.
[5] Saleta S,Federico L V,Lluis S,et al.Intestinal and immunological effects of daily oral administration ofLactobacillussalivariusCECT5713 to healthy adults [J].Anaerobe,2010,16:195-200.
[6] Antonietta R,Antonio L,Caterina R C,et al.Lactobacilluspla-ntarumreducesStreptococcuspyogenesvirulence by modulating the IL-17,IL-23 and Toll-like receptor 2/4 expressions in human epithelial cells [J].International Immunopharmacology,2013,17:453-461.
[7] Heiko H,Jörg K.Complement and Toll-like receptors:Key re-gulators of adaptive immune responses [J].Molecular Immunology,2006,43:13-21.
[8] 何 维.医学免疫学 [M].北京:人民卫生出版社,2006:103-113.
He W.Medical immunology [M].Beijing:People’s Medical Publishing House,2006:103-113.(in Chinese)
[9] Filippo B,Maria F.Cytokines as a link between innate and adaptive antitumor immunity [J].Trends in Immunology,2002,23(4):201-208.
[10] Tsai Y T,Cheng P C,Liao J W,et al.Effect of the administration ofLactobacillusparacaseisubsp.paracaseiNTU 101 on Peyer’s patch-mediated mucosal immunity [J].International Immunopharmacology,2010,10:791-798.
[11] Taro K,Shizuo A.Toll-like receptors and their crosstalk with other innate receptors in infection and immunity [J].Cell,2011,34:637-650.
[12] Murphy,Kenneth.Immunobiology [M].7th ed.America:Ga-rland Science,Taylor & Francis Group,2008:462-464.
[13] Sandra J V,Jeroen D,Sonja I G,et al.Innate signaling and regulation of Dendritic cell immunity [J].Current Opinion in Immunology,2007,19:435-440.
[14] Santhakumar M,Bali P.Modulation of adaptive immunity wi-th Toll-like receptors [J].Seminars in Immunology,2009,21:185-193.
[15] Tobias A O.Mechanisms of probioticactions:A review [J].International Journal of Medical Microbiology,2010,300:57-62.
[16] Jean-Nicolas T,Mansour M.Key roles of dendritic cells in lu-ng infection and improving anthrax vaccines [J].Cell,2010,16(7):303-312.
