高吸附铅乳酸菌的微胶囊化及特性
2021-04-22贺佳鑫贺银凤
董 阳,贺佳鑫,顾 悦,贺银凤
(内蒙古农业大学食品科学与工程学院 呼和浩特 010018)
重金属污染对环境和人体健康会产生严重危害,其中铅作为工业生产的重要原料和废弃物,所造成的污染和危害更是长时间以来被广泛关注[1-7]。铅在体内主要与含巯基(-SH)的蛋白质结合,抑制含巯基酶的活性,进而引起贫血等疾病[4]。同时,铅还可对神经系统发挥毒性作用,造成大脑不可逆的损伤[5-6],也会引起氧化应激对人体产生危害[7]。
生物修复是安全、高效解决重金属损害的新兴方法,是目前研究的热点。Tian 等[8]用筛选出的具有高吸附铅能力的植物乳杆菌CCFM8661 饲喂小鼠,发现该菌不仅通过对铅的吸附作用减轻摄入体内的铅产生的危害,还缓解铅暴露导致的氧化应激。Fatemeh[9]从伊朗东北部农田土壤中分离到的原生细菌FM01 对镍和铅有很好的吸附效果。Ma 等[10]改造出具有合成生物源细胞内碳酸钙矿物支架的酿酒酵母,对铅的吸附量可达116.69 mg/g。而乳酸菌也可通过离子交换、表面络合、无机微沉淀等方式吸附重金属。乳酸菌虽可高效去除重金属铅,但在贮藏、发酵过程中易受到各种环境因素的影响,导致活菌数量下降,最终摄入肠道内的活菌数过低,无法发挥其益生作用,而且吸附重金属铅的能力也无法保证。微胶囊化的乳酸菌能够提高菌株的耐酸、耐高温和耐贮藏性能等[11-12]。通过微胶囊技术,减少贮藏和胃肠道环境对具有重金属吸附能力的乳酸菌产生的不良影响,提高乳酸菌在不良环境中的存活率,有效提高乳酸菌的活菌数[11-14]。
影响乳酸菌微胶囊化的因素较多,如制备方法、壁材等。常用的微胶囊化方法有:挤压法、乳化法及喷雾干燥法,不同方法所得微胶囊的包埋率有差异。阳晖[15]比较了内源乳化法和外源乳化法对嗜酸乳杆菌的包埋效果,内源乳化法的包埋率比外源乳化法高出11.2%,而且微胶囊的形态更好,粒径分布范围更窄。王伟洁等[16]采用内源乳化法,以海藻酸钠和果胶为复合壁材包埋保加利亚乳杆菌,通过响应面优化包埋工艺条件,使微胶囊的包埋率达到91.8%。常用的包埋壁材有胶质壁材、蛋白壁材和油脂壁材[17]。罗红霞等[18]以乳清蛋白和明胶为壁材,利用喷雾干燥法制成植物乳杆菌微胶囊,通过对壁材配比、壁材添加量、进风温度、进料量4 个因素进行优化,微胶囊的包埋率达到62.15%。Wang 等[19]用植酸钠和壳聚糖逐层包埋戊糖乳杆菌,两种微胶囊经模拟胃肠液消化120 min 和4%胆盐消化3 h 后,双层包埋的戊糖乳杆菌活菌数比仅用植酸钠包埋的提高3.76 lg(CFU/mL),而且耐受热处理的能力也更好。邹强[20]分别以大豆蛋白、乳清蛋白、酪蛋白和明胶为壁材,包埋两歧双歧杆菌(B.Bifidum)F-35,并分别在不含胃蛋白酶以及含胃蛋白酶的模拟胃液中处理120 min,结果发现4 种壁材都能在不含胃蛋白酶的模拟胃液中显著提高被包埋菌的存活率,然而,胃蛋白酶的水解作用会大大削减蛋白质壁材的保护作用。探究不同包埋条件,对于提高菌株的包埋率具有重要的意义。
本试验中以前期从包钢矿区的羊粪中分离筛选的1 株具有高耐受和吸附重金属铅能力的戊糖片球菌10-a-1 为对象,采用内源乳化法,以海藻酸钠和壳聚糖为壁材,制得戊糖片球菌10-a-1 微胶囊,并通过单因素和正交试验确定最优生产工艺条件。通过微胶囊在连续模拟胃肠液中的存活试验,微胶囊在体外吸附铅试验和微胶囊的贮藏稳定性试验,探究微胶囊化对戊糖片球菌10-a-1的保护效果以及微胶囊技术对经模拟胃肠液处理的戊糖片球菌10-a-1 吸附铅的影响,旨在为提高具有生物活性菌株的环境耐受能力奠定基础。
1 材料与方法
1.1 材料与试剂
菌株:戊糖片球菌 (Pediococcus pentosaceus)10-a-1 分离筛选自包钢矿区羊粪,由内蒙古农业大学食品生物技术团队提供。
试剂:海藻酸钠、壳聚糖、胃蛋白酶,Solarbio公司;胰蛋白酶,Sigma 公司;牛胆盐,广东环凯微生物有限公司;冰醋酸、碳酸钙,国药集团化学试剂有限公司;琼脂、氯化钠、MRS 培养基、PBS 缓冲液。试验用试剂均为分析纯级。
主要溶液的配制:
1)模拟胃液(Simulated gastric juice,SGJ)[21]:NaCl 0.2 g,胃蛋白酶3 g,蒸馏水100 mL,用盐酸调节pH 值至2.0,用0.22 μm 水系滤菌器过滤除菌。
2)模拟肠液(Simulated intestinal juice,SIJ)[22]:NaH2PO41.2 g,胰蛋白酶0.1 g,胆盐0.45 g,用氢氧化钠调节pH 值至7.4,0.22 μm 水系滤菌器过滤除菌。
3)壳聚糖溶液(0.4%):将4.00 g 壳聚糖溶解于950 mL 0.1 mol/L 醋酸溶液中,用氢氧化钠调节pH 值至6.0,中速滤纸过滤后定容1 L。
1.2 仪器与设备
磁力搅拌器,上海禾颖仪器有限公司;显微图像分析设备,德国LEICA 公司;火焰原子吸收光谱仪,北京普析通用仪器有限公司;酶标仪,上海赛默飞世尔仪器有限公司;深孔板高速振摇培养箱,日本TAITEC 公司;真空冷冻干燥机,美国Laconco 公司;高速冷冻离心机,安徽中科中佳科学仪器有限公司。
1.3 试验方法
1.3.1 菌悬液制备 将活化至3 代的菌液于4 000 r/min,-4 ℃条件下离心10 min,得到的菌泥用无菌生理盐水洗涤3 次,重悬于无菌生理盐水中。调整菌悬液浓度,将菌悬液中活菌数控制在109CFU/mL(OD595nm值约1.5)。
1.3.2 内源乳化法制备海藻酸钠乳酸菌10-a-1微胶囊 参照Poncelet 等[23]的方法,初始制备条件为:海藻酸钠在菌胶混合物中含量为3.0%,碳酸钙和海藻酸钠质量比1.5∶9,冰醋酸和碳酸钙物质的量之比6∶1,水相(菌胶混合物)与油相体积比30∶70。
1.3.3 乳酸菌微胶囊包埋率的计算 取1.0 g 微胶囊,于9 mL 不加胆盐的人工肠液中,37 ℃,100 r/min 条件下温育2 h,取出,测活菌数。

1.3.4 单层海藻酸钠微胶囊包埋工艺的优化
1.3.4.1 单因素试验
1)按照1.3.2 节方法,控制其它因素不变的条件下,调整海藻酸钠质量分数分别为1.5%,2.0%,2.5%,3.0%和3.5%,制备微胶囊,考察不同海藻酸钠质量分数对微胶囊包埋率和粒径的影响。
2)按照1.3.2 节方法,控制其它因素不变的条件下,调整冰醋酸和碳酸钙物质的量之比分别为2∶1,3∶1,4∶1,5∶1,6∶1,制备微胶囊,考察不同酸钙比对微胶囊包埋率和粒径的影响。
3)按照1.3.2 节方法,控制其它因素不变的条件下,调整乳化过程中搅拌速度分别为150,300,450,600,750 r/min,制备微胶囊,考察不同转速对微胶囊包埋率和粒径的影响。
4)按照1.3.2 节方法,控制其它因素不变的条件下,调整水相和油相体积之比分别为30∶45,30∶70,30∶95,30∶120,30∶145,制备微胶囊,考察不同水油比对微胶囊包埋率和粒径的影响。
5)按照1.3.2 节方法,控制其它因素不变的条件下,调整碳酸钙和海藻酸钠质量之比分别为1∶9,1.5∶9,2∶9,2.5∶9,3∶9,制备微胶囊,考察不同钙胶比对微胶囊包埋率和粒径的影响。
1.3.4.2 正交试验 在单因素试验基础上,选择酸钙比、转速、水油比和钙胶比进行四因素三水平正交试验,以包埋率为主要指标,确定海藻酸钠乳酸菌微胶囊最佳工艺条件。
1.3.5 海藻酸钠-壳聚糖双层微胶囊的制备 参照Nualkaekul 等[24]的方法,按照每100 mL 0.4%壳聚糖溶液中加15 g 微胶囊的比例,将湿微胶囊加入壳聚糖溶液中,100 r/min 搅拌40 min,离心收集微胶囊,洗涤2 次。
1.3.6 海藻酸钠微胶囊及海藻酸钠-壳聚糖双层微胶囊的特性比较
1.3.6.1 乳酸菌微胶囊形态观察和粒径测定 在载玻片上滴1 滴亚甲基蓝溶液,将微胶囊分散于染液中,盖上盖玻片,用Leica-DM4000B 显微照相设备观察微胶囊形态并拍照。随机选取50 个微胶囊测量粒径。
1.3.6.2 微胶囊化乳酸菌10-a-1 在连续模拟胃肠液中的存活试验 参照Annan 等[21]的方法,称取两种微胶囊各1.0 g 或未微胶囊化菌悬液1 mL,加入9 mL 人工胃液中,37,100 r/min 条件下温育2 h,分别取0,1 h 和2 h 的样液,用不加胆盐的人工肠液稀释并裂解90 min,测活菌数,计算存活率。取人工胃液中温育2 h 后的样液,振荡混匀,吸取1 mL 加入9 mL 人工肠液中,相同条件下温育4 h,取0,2 h 和4 h 样液,用不加胆盐的人工肠液稀释并裂解,测活菌数,计算存活率。
1.3.6.3 微胶囊化乳酸菌10-a-1 在模拟肠液中的释放 参照Mi 等[25]的方法,考察乳酸菌10-a-1海藻酸钠微胶囊和海藻酸钠-壳聚糖微胶囊在模拟肠液中的释放情况。称取1.00 g 微胶囊,加入9 mL 人工肠液中,37 ℃、100 r/min 条件下振荡培养,分别取0,30,60,90 min 和120 min 的样液测活菌数。
1.3.6.4 微胶囊化乳酸菌10-a-1 在模拟肠道环境作用下对铅的吸附 参考李畅[26]的方法,将海藻酸钠微胶囊和海藻酸钠-壳聚糖微胶囊分别按照1 g∶9 mL 的比例加入人工胃液中,37 ℃、100 r/min 条件下温育2 h。在12 000 r/min、4 ℃条件下离心20 min,弃上清后称重,按照1 g∶9 mL 的比例加入人工肠液,在37 ℃、100 r/min 条件下温育4 h,12 000 r/min、4 ℃条件下离心20 min,收集菌体。收集的菌泥用超纯水洗涤3 次、称重,加入超纯水重悬,制成菌质量浓度为50 g/L 的浓缩菌悬液。取48 孔方形深孔板,每孔加入1.4 mL 50 mg/L铅溶液(pH 6.0),加入浓缩菌悬液,使菌体质量浓度达到5 g/L。将深孔板放入深孔摇床培养器中,37 ℃、800 r/min 振荡培养2 h 取出,14 000 r/min离心10 min,取上清液,用火焰原子吸收分光光度计测铅含量,计算吸附率和单位菌体铅吸附量。同时以未微胶囊化的乳酸菌10-a-1 作对照。吸附率和吸附量计算公式如下:
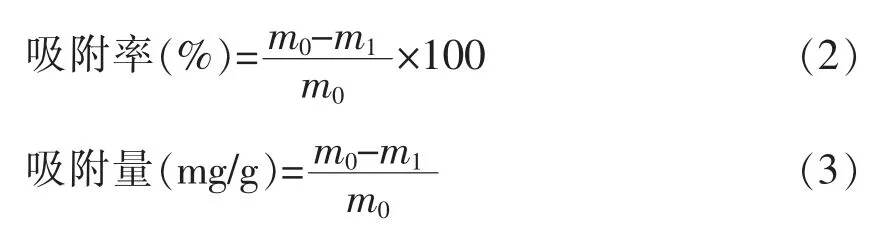
式中:m0——吸附前铅溶液中铅离子含量,mg;m1——吸附后溶液中铅离子含量,mg;m——菌体含量,g。
1.3.6.5 乳酸菌10-a-1 微胶囊的贮藏稳定性 将两种微胶囊和未微胶囊化菌悬液分别贮藏于4 ℃和20 ℃条件下,分别于7,14,21 d 和28 d 取出,在不加胆盐的人工肠液中裂解后测活菌数。
1.4 数据分析
试验结果采用SPSS 17.0 软件,做平均数、标准差、One-way ANOVA 显著性分析(P<0.05)和正交试验结果分析,采用Origin 8.0 作图。
2 结果与分析
2.1 微胶囊包埋工艺条件的优化
2.1.1 单因素试验结果 包埋率和粒径分布是评价乳酸菌微胶囊包埋效果的重要参数。不同工艺条件对海藻酸钠微胶囊包埋率和粒径的影响见图1。
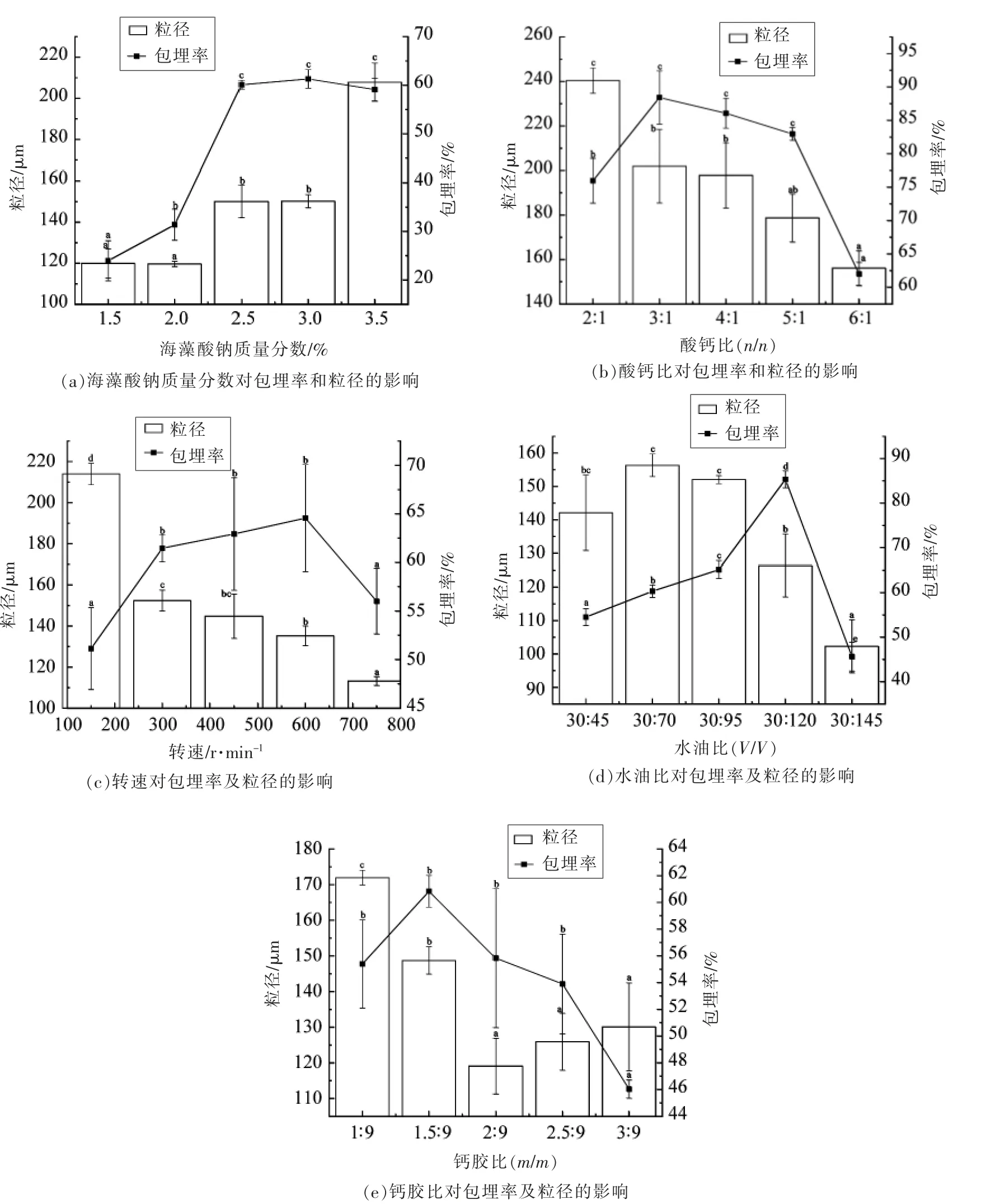
图1 不同工艺条件对海藻酸钠微胶囊包埋率和粒径的影响Fig.1 Effect of different technological conditions on the embedding rate and particle size of sodium alginate microcapsules
由图1a 可知,海藻酸钠质量分数小于2.5%时,微胶囊包埋率随海藻酸钠质量分数的增加而增加;海藻酸钠质量分数为2.5%,3.0%和3.5%时,微胶囊的包埋率显著高于1.5%和2.0%时的。当海藻酸钠质量分数在一个比较低的范围时,海藻酸钠质量分数越高,交联形成的凝胶网络结构越紧密,因而能够将更多的乳酸菌包裹在微胶囊中。然而,当海藻酸钠质量分数达2.5%后,继续增加海藻酸钠质量分数,微胶囊的包埋率并没有明显变化,反而给包埋的操作造成困难。当海藻酸钠质量分数达3.5%时,菌胶混合物的黏稠度非常高,磁力搅拌器转子难以将菌胶混合物均匀分散开,导致乳化过程非常困难,微胶囊包埋率有所降低。当海藻酸钠质量分数达3.5%时,微胶囊粒径显著增加,平均达(207.84±9.33)μm,同时粒径分布更加不均匀。当海藻酸钠质量分数为3.0%时,包埋的效果最好,此时微胶囊的包埋率为(61.30±1.92)%,平均粒径为(150.16±3.18)μm。
由图1b 可知,随着酸钙比的增加,微胶囊的包埋率先增大后减小,酸钙比在3∶1,4∶1 和5∶1时的包埋率显著高于酸钙比2∶1 和6∶1 的。微胶囊的粒径逐渐减小。由CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑反应可知,每2 mol 冰醋酸,理论上可与1 mol 碳酸钙反应。而在实际的内源乳化法操作中,冰醋酸在从油相扩散,进入微胶囊的过程中会有部分损失,因此实际上合适的酸钙比应大于2∶1。酸钙比过小时,碳酸钙不能被充分解离,形成的胶体网络结构薄弱,包埋数量减少,微胶囊质地不均匀,粒径偏大。酸钙比过高时,酸也会对乳酸菌造成胁迫,降低包埋率。当酸钙比为3∶1 时包埋效果最好,包埋率达到(88.43±3.99)%,平均粒径为(201.92±16.53)μm。屈方宁[27]通过内源乳化法制备海藻酸钠植物乳杆菌微胶囊,研究了酸钙比和酸化时间两个因素对微胶囊的保护效果和质构特性的影响,发现酸化环节对微胶囊的包埋率、粒径大小和物理特性有显著影响,并且酸钙比的增加和酸化时间的延长都可使微胶囊机械强度增加,粒径减小,在模拟胃液和胆盐中的收缩比、溶胀比减小。
由图1c 可知,随着转速增加,微胶囊的包埋率先增大后减小,转速300,450,600 r/min 时的包埋率显著高于150 r/min 和750 r/min 时的。粒径在逐渐减小。乳化过程中的搅拌速度影响菌胶混合物小液滴的形成。如果速度过小,导致乳化不充分,形成的微胶囊形状不均匀,而且粒径大、包埋率低。随着转速增大,微胶囊的粒径减小,外观质地越来越紧密。然而,过大的转速产生的剪切力也会造成菌体死亡,降低包埋率。当转速为600 r/min时包埋效果最好,包埋率为(64.57±5.51)%,此时平均粒径为(135.21±4.76)μm。
由图1d 可知,随着水油比的减小,微胶囊的包埋率先上升后下降,粒径在水油比达30∶95 后明显减小。水油比较大时,单位体积油相中需乳化的菌胶混合物多,不利于充分乳化,形成的微胶囊粒径偏大,包埋率较低。水油比减小后,菌胶混合物在油相中有更大的空间进行乳化,形成更小的液滴,液滴固化后形成的微胶囊粒径也小。水油比30∶120 时的包埋率(85.33±1.92)%显著高于其它比例的,且粒径分布比较均一。
由图1e 可知,随着钙胶比增加,微胶囊的包埋率先增后减,在钙胶比3∶9 时显著下降,粒径先减小后上升。碳酸钙和海藻酸钠的比例对海藻酸钙的交联产生很大影响,进而影响微胶囊的性质。在一定范围增加碳酸钙的用量可使海藻酸钠和钙离子得到充分的交联,从而形成结构和质地更加紧密的微胶囊,且微胶囊的包埋率更大、粒径更小。如继续增加碳酸钙的用量,则过量的碳酸钙不能被解离和交联而滞留在微胶囊内部,导致微胶囊粒径增加,分布不均匀。钙胶比1.5∶9 时,微胶囊包埋率达到最大值(60.83±3.30)%,同时粒径分布较均一。
2.1.2 正交试验结果 根据单因素试验的结果,将海藻酸钠质量分数确定为3.0%,选择水油比(V/V)、酸钙比(n/n)、转速(r/min)和钙胶比(m/m)4 个因素,每个因素选择3 个合适的水平,以微胶囊包埋率为指标,做四因素三水平的正交试验,并从中选出最佳工艺条件。正交试验因素水平和结果见表1和表2。
由表2可知,根据极差R 的大小,各因素对试验结果的影响排序为:水油比(A)>酸钙比(B)>转速(C)>钙胶比(D),4 个因素中对包埋率影响最大的是水油比,其次分别是酸钙比、转速,影响最小的是钙胶比。在9 组试验中包埋率最高的是第2组A2B1C2D2,具体条件是水油比30∶120、酸钙比2∶1、转速600 r/min、钙胶比1.5∶9,此时包埋率为82.10%。
上述结果还需要验证。选取条件水油比30∶120、酸钙比3∶1、搅拌速度600 r/min、钙胶比1.5∶9,即A2B2C2D2组合进行验证。在A2B2C2D2组合条件下,包埋率为 (87.20±1.60)%,高于组合A2B1C2D2。最终最优工艺条件中酸钙比选择3∶1,然后采用最优工艺条件制备微胶囊。
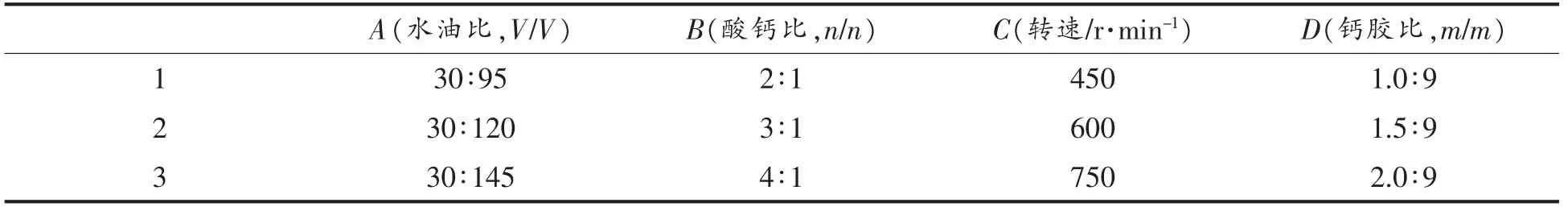
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experiment
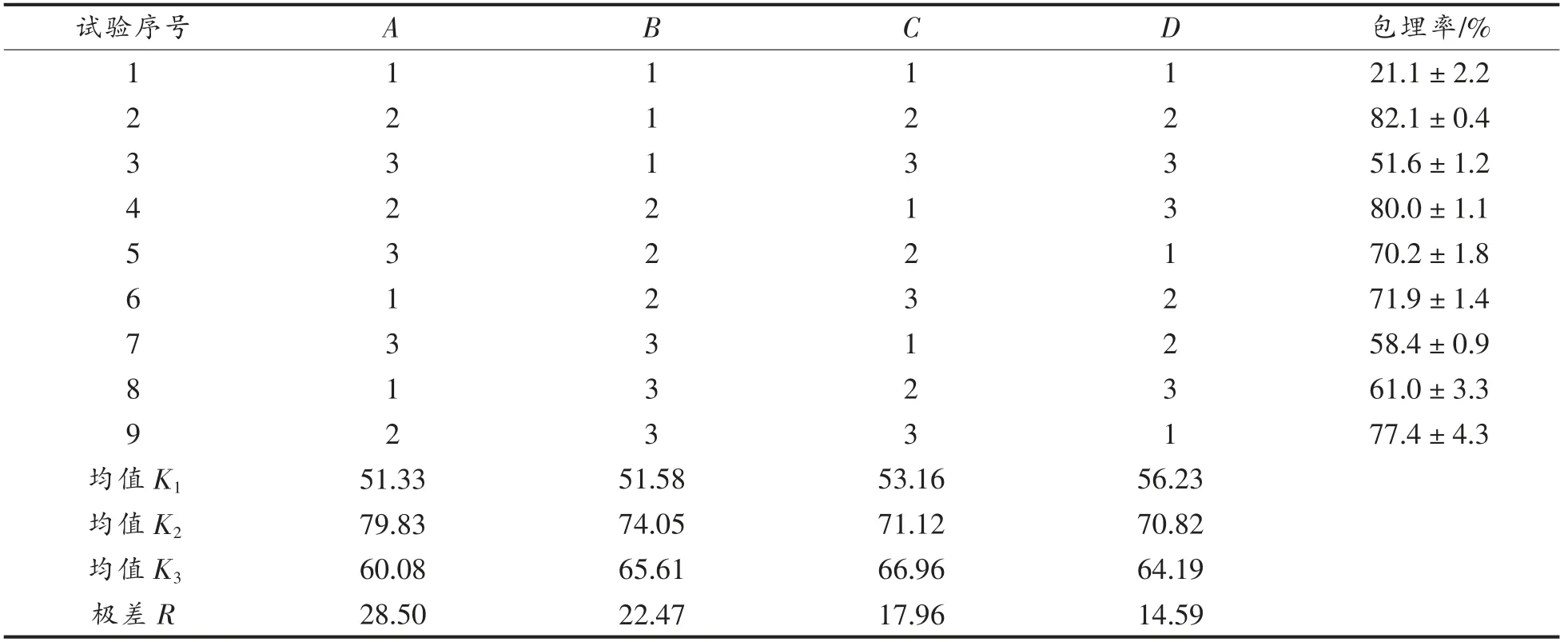
表2 正交试验结果Table 2 The results of orthogonal test
2.2 海藻酸钠微胶囊及海藻酸钠-壳聚糖双层微胶囊的特性比较
2.2.1 乳酸菌微胶囊形态观察 从图2a 可看出,在光学显微镜下,海藻酸钠微胶囊形态均匀、边界清晰,没有相互黏结的现象,经亚甲蓝染色后呈现蓝紫色。仅用海藻酸钠作壁材的微胶囊存在孔径大、耐酸性不好的缺点。采用壳聚糖给海藻酸钠微胶囊进行二次包埋,利用壳聚糖的耐酸性提高微胶囊在胃肠液中对被包埋菌的保护能力。海藻酸钠-壳聚糖微胶囊在光学显微镜下的形态如图2b 所示。双层微胶囊形态比较规则,边界清晰、互不粘连,而粒径分布比单层微胶囊更宽。
2.2.2 乳酸菌微胶囊的粒径分布及包埋率 按最优工艺条件制备的海藻酸钠微胶囊与海藻酸钠-壳聚糖微胶囊的包埋率和粒径如表3所示。
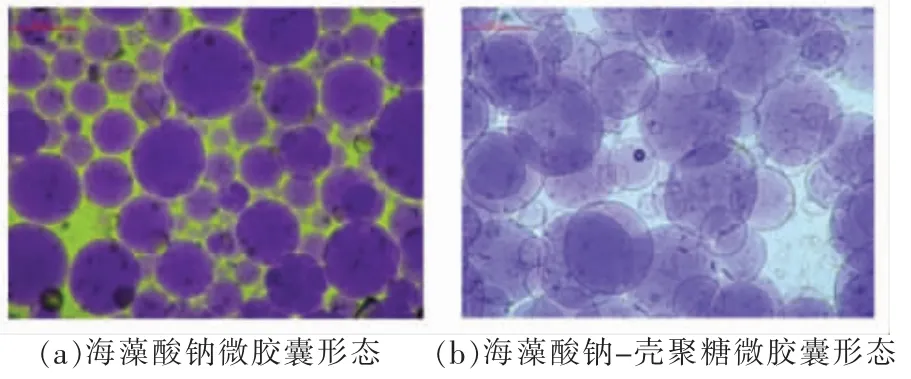
图2 乳酸菌微胶囊形态Fig.2 Morphology of lactic acid bacteria microcapsules
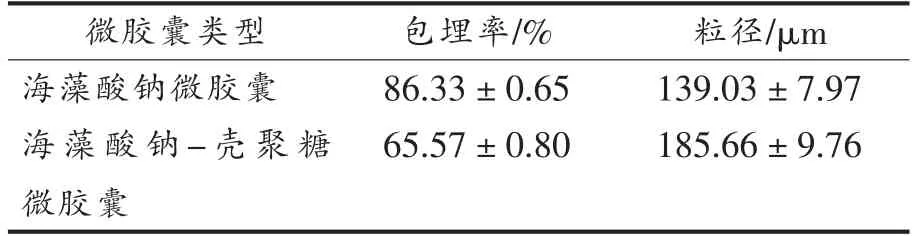
表3 海藻酸钠微胶囊和海藻酸钠-壳聚糖微胶囊的包埋率和粒径Table 3 Microencapsulation rate and particle size of sodium alginate microcapsules and sodium alginatechitosan microcapsules
与海藻酸钠微胶囊相比,海藻酸钠-壳聚糖微胶囊的包埋率有所下降,可能是因为二次包埋过程中损失部分的微胶囊,造成菌体的泄露。同时,双层包埋使微胶囊的平均粒径增加了46.63 μm。王庆卫[12]在采用内源乳化法包埋的海藻酸钠两歧双歧杆菌微胶囊的基础上,分别用壳聚糖、乳清蛋白和海藻酸钠3 种材料进行2 次包埋。得到3 种双层微胶囊,包埋率均从单层时的90%左右降至50%左右,粒径也增加了10~56 μm,其中海藻酸钠-壳聚糖微胶囊的粒径从平均116.0 μm 增到155.5 μm。
2.2.3 微胶囊化乳酸菌10-a-1 在连续模拟胃肠液中的存活试验 两种微胶囊化和未微胶囊化的戊糖片球菌10-a-1 在连续模拟胃肠液中随时间变化的存活率如图3所示。
由图3可知,两种微胶囊和菌悬液在模拟胃液中处理60 min 时,存活率下降最快,而在模拟肠液中存活率的下降相对缓慢。海藻酸钠-壳聚糖微胶囊在模拟胃液和模拟肠液中存活率的下降都是三者中最平缓的,最终存活率达(76.91±1.94)%。未微胶囊化的菌悬液下降得最快,最终存活率仅(10.83±0.99)%。说明两种微胶囊均能有效降低被包埋菌受胃肠道极端环境的影响,其中,海藻酸钠-壳聚糖的保护效果比单层的海藻酸钠微胶囊更显著。常柳依等[28]在海藻酸钠微胶囊的基础上用壳聚糖进行二次包埋,双层包埋的微胶囊在模拟胃液中处理120 min 后,被包埋的长双歧杆菌减少量比单层微胶囊低1 个数量级,说明海藻酸钠虽然能帮助戊糖片球菌10-a-1 抵抗胃肠道中低pH 值和含有胆盐的不良环境,但是海藻酸钠微胶囊的耐酸性还不够理想。通过壳聚糖的二次包埋,双层微胶囊的耐酸性有了明显提高,胃液处理120 min 后,双层微胶囊存活率是(83.40±1.38)%,而海藻酸钠微胶囊的存活率是(59.13±1.89)%,说明壳聚糖双层微胶囊对耐酸性的提高有显著效果。
2.2.4 乳酸菌微胶囊在模拟肠液中的释放 微胶囊在模拟肠液中的释放性是评估微胶囊能否在肠道内定点释放的指标。海藻酸钠微胶囊和海藻酸钠-壳聚糖微胶囊在模拟肠液中的释放情况如图4所示。
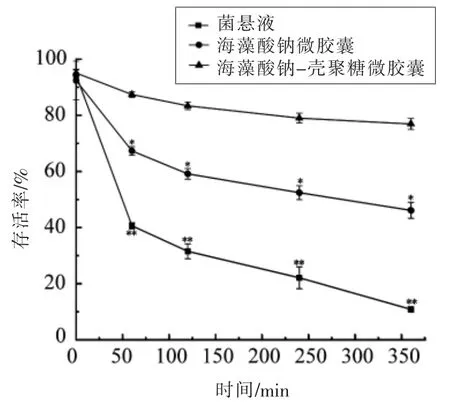
图3 微胶囊化和未微胶囊化的戊糖片球菌10-a-1在连续模拟胃肠液中的存活率Fig.3 Livability of free and microencapsulated Pediococcus pentosaceus 10-a-1 during sequential exposure to simulated gastric juice (SGJ)and simulated intestinal juice (SIJ)
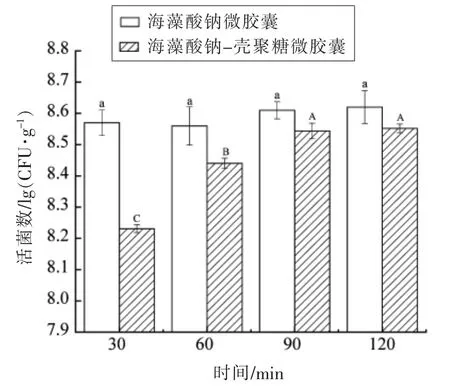
图4 海藻酸钠微胶囊和海藻酸钠-壳聚糖微胶囊在模拟肠液中的释放情况Fig.4 Release of sodium alginate microcapsules and sodium alginate-chitosan microcapsules in simulated intestinal juice (SIJ)
海藻酸钠微胶囊在模拟肠液中释放快,30 min 就释放了(90.05±8.88)%,活菌数达到(8.57±0.04)lg(CFU/g);而海藻酸钠-壳聚糖微胶囊在30 min 时释放了(47.79±1.97)%,活菌数达到(8.23±0.01)lg(CFU/g)。两种微胶囊在90 min 时活菌数都达到稳定,基本释放完全。海藻酸钠微胶囊释放率达到(98.86±6.00)%,海藻酸钠-壳聚糖微胶囊释放率达(98.10±3.30)%。海藻酸钠微胶囊最终释放的活菌数是(8.62±0.05)lg(CFU/g),海藻酸钠-壳聚糖微胶囊最终释放的活菌数是(8.55±0.01)lg(CFU/g)。
海藻酸钙凝胶是可逆的。当环境中存在磷酸根时,海藻酸钙中的钙离子会被磷酸根剥夺,造成海藻酸钙网状结构裂解。壳聚糖和海藻酸钙间通过静电作用相互结合,因此双层微胶囊的结构更加紧密,导致裂解时间延长也可以更有效地保护被包埋的乳酸菌。
2.2.5 经模拟胃肠液处理的戊糖片球菌10-a-1微胶囊体外吸附铅的能力 乳酸菌的菌体活性和菌体的预处理会影响其吸附重金属的能力。连续模拟胃肠液处理对戊糖片球菌10-a-1 及其微胶囊吸附铅能力的影响如表5所示。
连续模拟胃肠液处理对戊糖片球菌10-a-1及其微胶囊的铅吸附效果有极显著的影响。经处理的戊糖片球菌10-a-1 在50 mg/L 铅离子溶液中对铅的吸附率和单位质量湿菌泥的铅吸附量明显下降,说明模拟胃肠液对戊糖片球菌10-a-1 的损伤会降低其吸附铅的效果。这可能是因为低pH值和含有胆盐的模拟胃肠液对菌体表面的吸附位点和细胞壁肽聚糖层结构产生影响所致。经胃肠液处理后,两种微胶囊化的戊糖片球菌10-a-1 吸附能力虽然低于未经模拟胃肠液处理的菌体,但是极显著地高于未微胶囊化的菌体。这说明通过微胶囊的保护,尤其是海藻酸钠-壳聚糖微胶囊在模拟胃液中更好的保护,可显著降低戊糖片球菌10-a-1 吸附铅能力的下降。
2.2.6 乳酸菌微胶囊贮藏稳定性 两种微胶囊化和未微胶囊化的戊糖片球菌10-a-1,在4 ℃和20℃下贮藏28 d,其存活率的变化情况如图5所示。
随着贮藏时间的延长,菌悬液和微胶囊中的活菌数都显著下降。由于包埋壁材对菌体有一定的保护作用,因此两种微胶囊的活菌数降幅低于菌悬液。第28 天时,海藻酸钠-壳聚糖微胶囊的活菌数分别为4 ℃下的(7.88±0.88)lg(CFU/g)和20℃下的(7.59±0.05)lg(CFU/g)。明显超过海藻酸钠微胶囊在4 ℃下的(7.88±0.88)lg (CFU/g)和20 ℃下的(7.59±0.05)lg(CFU/g)。此时未微胶囊化的戊糖片球菌10-a-1 的活菌数在4 ℃下是(6.20±0.03)lg (CFU/g)、20 ℃下是(5.56±0.03)lg(CFU/g)。说明双层微胶囊在贮藏过程中对乳酸菌10-a-1 的保护效果要好于单层海藻酸钠微胶囊。两种微胶囊在经过28 d 贮藏后,活菌数均保持在107CFU/g,只下降1 个数量级,而未微胶囊化的菌悬液下降3~4 个数量级。温度在微胶囊保藏过程中对活菌数的影响也非常显著,4 ℃下贮藏的两种微胶囊28 d 时的存活率都显著高于20 ℃下贮藏的微胶囊。

表4 微胶囊化戊糖片球菌10-a-1在模拟肠道环境作用下对铅的吸附Table 4 The adsorption capacity of microencapsulated Pediococcus pentosaceus 10-a-1 to lead in simulated intestinal environment
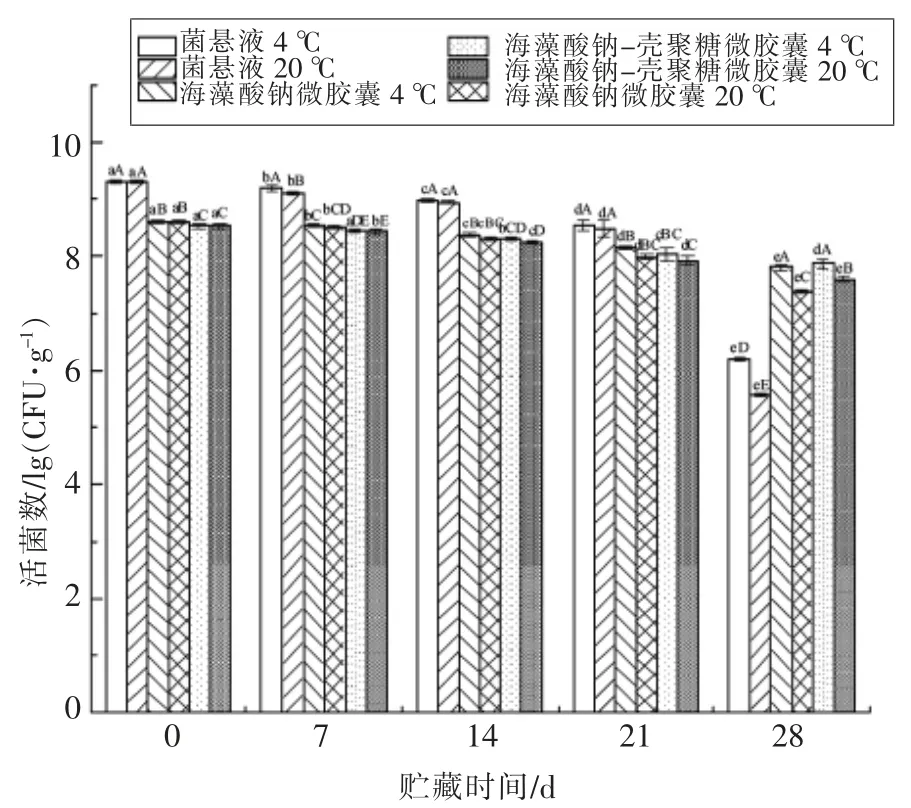
图5 戊糖片球菌10-a-1 微胶囊贮藏期间存活率变化Fig.5 Survival rate of Pediococcus pentosaceus 10-a-1 microcapsules during storage
3 结论
在海藻酸钠质量分数3%、水油比30∶120、酸钙比3∶1、转速600 r/min、钙胶比1.5∶9 条件下制备海藻酸钠微胶囊,包埋率达86.33%,平均粒径139.03 μm。在此基础上,用壳聚糖进行二次包埋,得到的海藻酸钠-壳聚糖双层微胶囊包埋率为65.65%,粒径185.66 μm。内源乳化法制备的海藻酸钠微胶囊和海藻酸钠-壳聚糖微胶囊,能有效提高戊糖片球菌10-a-1 抵御不良环境条件的影响,其中海藻酸钠-壳聚糖微胶囊对戊糖片球菌10-a-1 的保护效果更好。
