牛初乳中抗高血压因子对成年大鼠心肌细胞电压依懒性钙通道的影响
2021-04-22任皓威赵添玉商佳琦
滕 刚,任皓威,赵添玉,商佳琦,刘 宁
(东北农业大学食品学院 乳品科学教育部重点实验室 哈尔滨150030)
牛初乳是从正常分娩后3 d 的奶牛体内分泌出来的乳汁。牛初乳中富含多种营养成分,各种免疫刺激及生长因子,其在动物以及人类健康管理中的作用受到社会各界的广泛关注[1-2]。
有研究发现,牛初乳的营养成分和免疫组成与常规牛乳大不相同。在乳汁生成和哺乳期之前,成纤维细胞就进行初乳分泌[3-5]。牛乳和初乳被认为是重要的天然生物活性成分的来源。牛乳获得的多肽具有多种生物学功能,其主要功能之一就是抗高血压[6]。高血压是困扰全球各国的严重问题,它是引起心脑血管疾病以及肾脏发病机率和死亡率的重要原因之一。研究人员对于牛乳及牛初乳的抗高血压作用机制及效果开展了广泛研究,例如干酪来源的肽可以使自发性高血压大鼠收缩压降低7.1~29.3 mmHg,脱脂发酵乳使志愿者的收缩压降低4.6~14.1 mmHg,不同食物来源的血管紧张素转换酶(ACE)抑制肽也具有降低血压的作用[7-13]。
牛初乳中含有一些低分子质量肽类的降血压活性物质,研究表明,可运用超滤、离子交换层析及凝胶过滤层析等技术对牛初乳中抗高血压因子(antihypertensive factor in bovine colostrums,AFBC)进行分离纯化,结果显示,AFBC 能够降低原发性高血压大鼠的血压,且对正常血压的Wistar 大鼠没有影响[13]。为了进一步探究AFBC 的降血压机理,本试验采用Fura-2/AM 钙荧光指示剂对急性分离成年大鼠的心肌细胞染色,应用荧光分光光度计测定AFBC 与钙离子通道阻断剂--维拉帕米(Ver)对成年大鼠心肌细胞钙浓度的作用机制。
目前,国内外对乳源降血压肽的作用机理研究主要集中于动物体内降血压作用以及对血管紧张素转换酶抑制作用,尚无文献报道阻断钙离子通道,抑制心肌细胞钙内流的机理研究,本研究也为乳源降血压肽的作用机理研究提供了新思路。
1 试验材料
1.1 试验药物
按照文献[13-14]方法分离纯化牛初乳中抗高血压因子(AFBC),试验之前用生理盐水配制成所需浓度;用维拉帕米(Ver)进行注射,试验所用的Ver 购于上海禾丰制药有限公司。
1.2 实验动物
选取体重在200~250 g 之间的Wistar 大鼠,雌雄随机。大鼠购于哈尔滨医科大学肿瘤研究所。
1.3 试剂及仪器
2-[6-双乙酸基-5-(2-双乙酸氨基)-5-甲苯氧乙氧基]-2-苯骈呋喃基-5-恶唑羧酸五钾盐/乙酰羟甲基酯 (Fura-2/AM),Anaspec of America公司;Triton X-100,Sigma 公司;DMEM (高糖),Gibco 产品;胰蛋白酶;EGTA 和二甲基亚砜(DMSO),Solarbio 公司;牛血清白蛋白(BSA),Sigma 公司;荧光分光光度计(F-4500 型),日立公司;倒置显微镜,Leica 公司;超净工作台,北京东联哈尔仪器;恒温摇床培养箱,香港力康公司;低速离心机,上海离心机械研究所。
2 试验方法
2.1 成年大鼠心肌细胞分离[15]
运用改进Langendorff 灌流的方法进行试验操作。对大鼠进行解剖后,迅速取出大鼠心脏,放入 冰D-Hank’s 液 (NaCl 8.00 g、KCl 0.40 g、Na2HPO4·H2O 0.06 g、KH2PO40.06 g 和NaHCO30.35 g,用少许双蒸水溶解NaHCO3,并将pH 值调整至7.4 后,加入双蒸水直至1 000 mL)中,将主动脉挂到实验室自制Langendorff 装置后,灌入37 ℃D-Hank’s 液,将心脏内的淤血排出[16]。5 min 后,换37 ℃的0.1%胰蛋白酶液对心脏进行灌流直至心脏发白,即停止消化。加入37 ℃的D-Hank’s 液灌流,将残留于心脏中的酶洗净。剪下心室,将其放入含10%牛血清的D-Hank’s 液,剪刀剪碎,用滴管吹打,取上清,继续用D-Hank’s 液吹打,直至上清液不浑浊,停止吹打。将吹打后的上清合并,实验室采用200 目尼龙网过滤后,再将滤液离心,离心条件为1 000 r/min,5 min,保留一半上清,同时加入Hank’s 液(NaCl 8.00 g、KCl 0.40 g、Ca-Cl20.14 g、MgSO4·7 H2O 0.20 g、Na2HPO4·H2O 0.06 g、KH2PO40.06 g、NaHCO30.35 g 和葡萄糖1.00 g,溶解于较少双蒸水,并调整溶液pH 为7.4,加入双蒸水的量为1 L)冲洗2 次,用DMEM 培养液(含10%牛血清)调整细胞数为109/L。
2.2 Fura-2/AM 负载
将Fura-2/AM 溶解在DMSO 中,将制备的细胞悬浮液加入到体系中,并将溶液的最终浓度调节至5 μmol/L,将混合物在37 ℃下恒温振荡45 min,并将上清液离心。用含有0.2%BSA 的Hanks溶液冲洗2 次。取1 滴悬液进行观察,直至对台盼蓝拒染。将其余悬液调细胞数为109/L 用于荧光测定[17],并在细胞悬液中加入相应浓度药物。
2.3 荧光测定和心肌[Ca2+]i 的计算[17]
测量Fura-2 的荧光强度,实验室使用Hitachi F-4500 荧光双波长分光光度计。在5 nm 激发光栅和10 nm 发射光栅且温度为 (37±1)℃的条件下,将固定量(n≥106)的Fura-2/AM 细胞悬浮液加入荧光杯中。波长设定:激发光波长300~450 nm,发射波长500 nm,设定后扫描,当荧光峰值达到最高时检查Fura-2 的激发波长,并根据上述试验步骤确定细胞负荷即可。载荷条件最佳时对应的激发波长峰值约为340 nm。
将测定方式转换为细胞内阳离子浓度扫描(波长变换间隔2 s),双波长测定继续按照上述参数设置。在测定过程中,根据实际需求向仪器进样小孔加入KCl、TritonX-100 和EGTA。细胞内游离Ca2+浓度([Ca2+]i)按照Grynkiewicz 等[18]提出的方法进行计算。
Fura-2/AM 检测[Ca2+]i的计算公式如下:
[Ca2+]i= Kd[(R-Rmin)/(Rmax-R)](Fmin/Fmax)
其中,Kd表示Fura-2 和Ca2+反应的解离常数,数值为224 nmol/L;R 代表各检测点的荧光强度,比率为F340/F380。通过试验获得Rmax和Rmin,以表示荧光比(F340/F380)。Fmax和Fmin表示测量的最大和最小荧光比,代表分别加入0.1% Tritonx-100和5 mmol/L EGTA(即在Ca2+饱和和零条件下)后获得的细胞悬浮液,在380 nm 激发光下测得的Fura-2 荧光强度 (F380)。实际计算由Hitachi F-4500 钙测量系统的钙定量软件自动确定。
3 试验结果
3.1 成年大鼠心肌细胞形态学观察
典型的急性分离的成年大鼠心肌细胞是杆状的,长∶宽约3∶1~6∶1,体积越大,横纹越明显[15]。图4显示在40×显微镜下急性分离成年大鼠心肌细胞。
3.2 Fura-2/AM 负载情况
Fura-2/AM 不具有与Ca2+结合的能力,但是固定发射波长达510 nm,并且Fura-2/AM 的荧光峰值达到其最大值的时候,激发波长约为380 nm;如果其激发波长不在380 nm 而在340 nm,则意味着Fura-2/AM 进入胞内后,可被完全胞浆酶水解形成Fura-2 并与Ca2+相结合,结果见图1和图2。
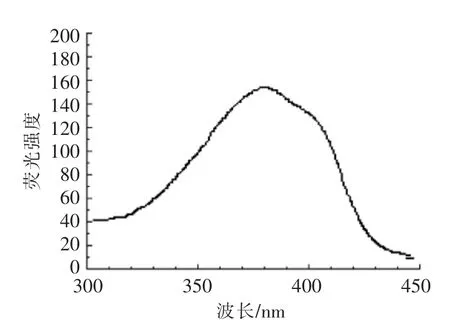
图1 Ca2+结合之前激发波长扫描图谱Fig.1 Excitation wavelength scan of Ca2+-free
3.3 AFBC 对静息状态下心肌[Ca2+]i 的影响
用本法测得静息状态下心肌[Ca2+]i为(153.6±12.9)nmol/L,分别加入AFBC 0.5 mg/mL 和Ver 0.5 μmol/L 5 min 后,测得静息状态下的心肌[Ca2+]i分别为(139.8±13.7)nmol/L 和(151.8±16.2)nmol/L。喂药前后进行对比,结果无显著性差异(P>0.05,n=6)。
3.4 AFBC 对KCl 引起心肌[Ca2+]i 变化的影响
对负载细胞以Hank’s 液悬浮(细胞外钙浓度为1.3 mmol/L)时,50 mmol/L KCl 可使大鼠心肌[Ca2+]i达到(441.2±78.5)nmol/L(见图3,与静息组相比,P<0.001);用无钙D-Hank’s 液来悬浮负载细胞,加入50 mmol/L KCl 时心肌[Ca2+]i为(159.8±10.3)nmol/L(与静息状态相比,P>0.05)。同一动物心肌细胞先加入AFBC 0.5 mg/mL 和Ver 0.5 μmol/L 5 min 后,再加入同一浓度的KCl,心肌[Ca2+]i分别为(317.6±51.3)nmol/L 和(279.4±48.7)nmol/L (与单用KCl 组相比,AFBC 组P<0.05,Ver组P<0.001,n=6)。
4 讨论
心肌收缩力的中心调节剂是细胞内Ca2+。心室肌细胞Ca2+调节变化的重要性日益增加,因其可能对心脏的机械功能产生障碍和导致与充血有关的心律失常,进而引起有关心脏病的发生。高血压心肌持续的机械应力与多种因素相关,其中主要包括心肌细胞的Ca2+敏感性和信号级联放大反应。
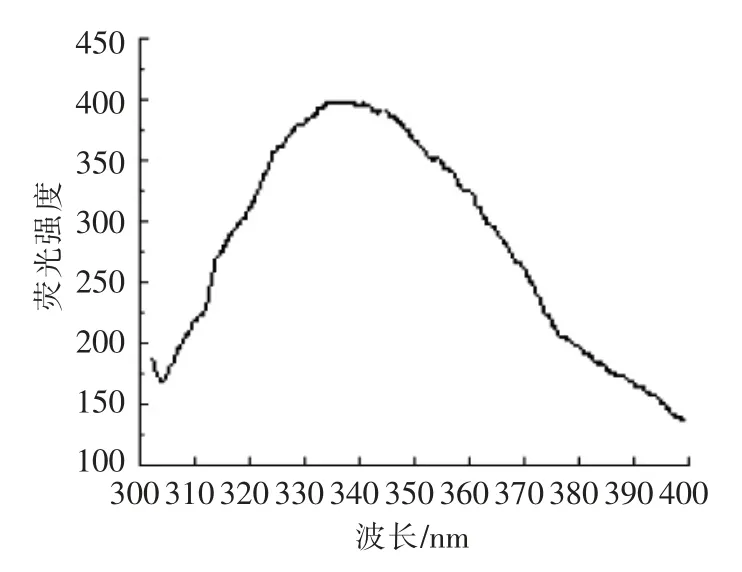
图2 Ca2+结合之后激发波长扫描图谱Fig.2 Excitation wavelength scan of Ca2+-bound
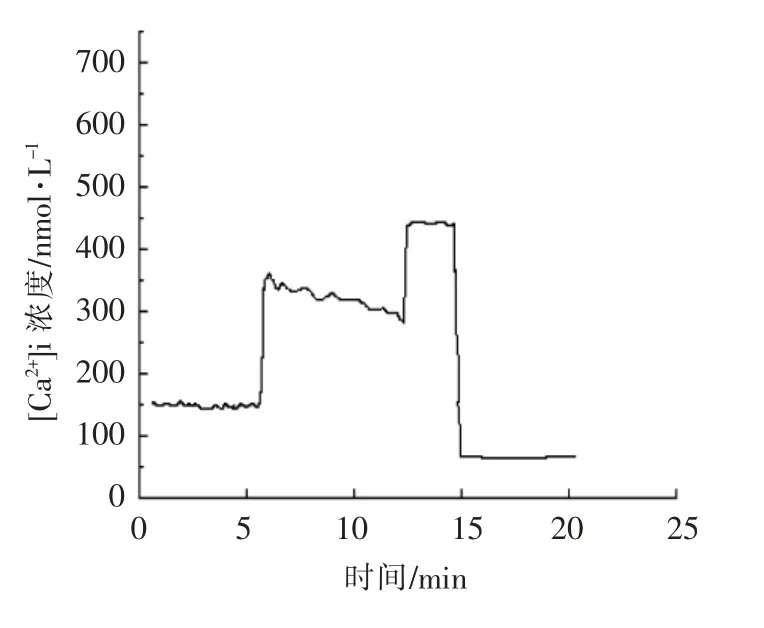
图3 静息组[Ca2+]i 随时间变化的曲线Fig.3 Curve of time-concentration of contrast group’s [Ca2+]i
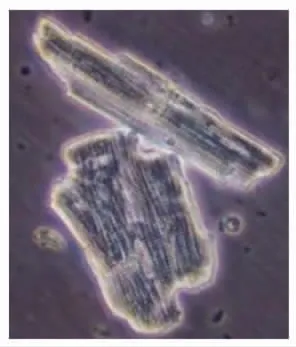
图4 成年大鼠心室肌细胞(×400)Fig.4 Adult rat ventricular myocytes (×400)
本试验测得成年大鼠心肌[Ca2+]i为 (153.6±12.9)nmol/L,与文献[17]Ver 0.5 μmol/L 对静息状态下的心肌[Ca2+]i并无影响,其结果与文献表述相同。AFBC 0.5 mg/mL 对静息状态下心肌[Ca2+]i也无明显影响,但是使心肌[Ca2+]i有下降的趋势,应进一步研究其作用机制。当钾浓度高时,细胞膜上的电压依赖性钙通道(VDC)打开并发生钙流入。从试验结果来看,当钾浓度高时,大鼠心肌细胞[Ca2+]i明显增加。[Ca2+]i不会随着钾含量的增加而提高,该试验结果也说明,由于钾含量增加引起的心肌细胞钙离子浓度升高这一现象是由于细胞外钙离子内流所引起的。试验过程中AFBC 0.5 mg/mL 与Ver 可显著抑制高钾所致的[Ca2+]i升高,从而证明AFBC 对VDC 具有抑制作用,可抑制因VDC 开放而导致的钙内流现象,减少心肌[Ca2+]i。AFBC 抗高血压的机理是通过抑制心肌细胞内钙离子浓度升高,从而使心肌收缩的现象得到抑制。然而导致上述结果出现的详细原因仍不清楚,还有待进一步研究。
值得注意的是,由于高血压药物在治疗过程中仍然存在诸多不足之处,因而要禁止滥用抗高血压药物。AFBC 是一种抗高血压因子,来源于初乳,是机体在免疫应答过程中产生的一种细胞因子,目前的研究并不知道AFBC 具有毒副作用,因此它可以作为人类抗高血压干预的有效物质。
本试验测定[Ca2+]i结果可能受以下因素的影响:
1)房室化 当部分Fura-2/AM 侵入亚细胞器(如胞浆网,细胞核等部位)的时候,Fura-2/AM在这些细胞器中不会被完全水解成Fura-2',虽然其与Fura-2 的荧光相类似,但是并没有与Ca2+结合的能力,因而会影响最终测定结果[19]。这种情况的发生与细胞的种类和测定[Ca2+]i条件有关,尤其是处于培养条件下的细胞。因此本试验采用的是急性分离大鼠心肌细胞测定。
2)Fura-2 外漏 细胞内存在的Fura-2 可通过某些途径漏到胞外,例如以膜上亲水性离子通道的途径漏到细胞外部,从而使胞内的荧光强度降低,同时漏到胞外的Fura-2 也会造成一定的测量误差。0.2%牛血清白蛋白可减少Fura-2 外漏。一般认为,控制孵育时间小于1 h 也是减少Fura-2 外漏的有效措施[20]。
3)细胞悬液测量整个照射范围内所有细胞的荧光平均值,但这些细胞的功能活性不同步。因此,该测定结果不如单个细胞好,并且在每个细胞中显示Ca2+,特别是在添加刺激剂或药物后,其对结果具有更大的影响。
目前,虽然世界上研究通过评估食物来源的蛋白多肽的抗高血压作用机制方法仍然很少,但是这些研究指出了NO 和前列腺素通路中的不同分子靶点。此外,还有研究揭示了抗高血压LF 的作用复杂性,开辟了更好的途径了解其降血压效果。毫无疑问,这些技术应用于不同的体外和体内研究模型,将大大增强目前关于抗高血压肽的作用机制的研究[21-22]。
