米氏凯伦藻抑藻菌的分离鉴定及抑制效应*
2021-04-22杜文俊冯燕楼褚夫敏段晓洋
杜文俊, 冯燕楼, 安 莹, 褚夫敏, 段晓洋, 丁 宁
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
1 材料与方法
1.1 实验藻种与细菌培养基
米氏凯伦藻(Karenia mikimotoi)藻种由中国海洋大学藻种培养实验室提供. 培养液为改良f/2营养液,成分参照Guillard的方法[9]. 米氏凯伦藻在光照强度为3000 μmol·m-2·s-1,光暗比为12 h∶12 h,温度为(25±1) ℃的光照培养箱中培养至对数生长期. 细菌2216E培养基:蛋白胨5 g,酵母膏1 g,磷酸高铁0.1 g,陈海水1000 mL,正向琼脂粉1.5 g(固体培养基).
1.2 实验方法
1.2.1 细菌分离筛选
于无菌操作台中取对数生长期的米氏凯伦藻藻液稀释成不同的浓度梯度,各移取0.1 mL至2216E固体培养基上,用涂布棒均匀涂布,于25 ℃恒温培养箱中倒置培养,待其长出单菌菌落后按照形态、颜色不同采用划线法进行单菌的分离纯化,挑取单菌接种于经高温灭活的2216E液体培养基中,于25 ℃、150 r·min-1恒温培养箱中培养3天,用于单菌DNA提取,剩余的用15% (V/V)甘油于80 ℃超低温冰箱中储存备用.
1.2.2 细菌DNA制备及序列分析
待测菌株经培养3天后经高速离心收集得到菌体,用AXYGEN AxyPrep基因组提取试剂盒提取细菌DNA. 以正向27F和反向1492R为引物扩增细菌16S rRNA基因序列;取3 μL PCR产物跑电泳,用凝胶图像处理系统观察并选取条带明亮且单一的扩增子送北京奥科鼎盛生物科技有限公司测序;将测序所得的序列在GenBank上与数据库已有的细菌16S rRNA序列进行blast比对,通过Clustal X建立aln文件,用软件MEGA4.1对菌株系统发育树进行构建.
PCR(LC480II型)扩增体系和反应程序为:25 μL 2×EasyTaqPCR SuperMix (+dye)、上下游引物各0.5 μL、DNA模板1 μL、ddH2O 23 μL;95 ℃预变性6 min,94 ℃变性50 s,60 ℃退火50 s,75 ℃延伸80 s,35个循环后,75 ℃延伸10 min.
1.2.3 抑藻试验
取经过分离纯化培养后的单菌菌液按5%体积比接种于米氏凯伦藻培养液中,以添加无菌2216E液体培养基为对照组,测定其抑藻活性,实验共进行7天. 观察米氏凯伦藻形态变化,藻细胞计数于光学显微镜下采用血球计数法进行,从第0天开始,每24 h计数一次,选取抑藻细菌,抑藻率(Inhibition rate,IR)计算参考以下公式:IR=(对照组生长量-实验组生长量)/对照组生长量×100%. 设置3组平行,并绘制微藻细胞的生长曲线.
1.2.4 抑藻菌的作用方式
取培养3天的细菌发酵液分别通过离心机高速离心(8500 r·min-1,15 min)和0.22 μm超微孔滤膜过滤,得到除菌后的过滤液;将沉淀用等体积的f/2营养液反复洗涤3次,得到纯菌体. 将原菌液、除菌滤液和纯菌体的重悬液按照3%体积比分别加入至生长良好的米氏凯伦藻藻液中进行共培养,抑藻实验设3组平行进行48 h. 抑藻率计算方法参照1.2.3.
1.2.5 不同作用浓度菌液的抑藻实验
将抑藻菌接种至2216E液体培养基中活化,于25 ℃、150 r·min-1恒温培养箱中培养3天. 分别取1%和3%体积比的抑藻菌菌液加入至生长良好的米氏凯伦藻培养液中进行共培养,对照组和抑藻率计算方法同1.2.3.
1.2.6 数据统计分析
数据处理与统计分析使用软件SPSS 20.0和Microsoft Excel 2010完成. 检验处理组与对照组之间的差异显著性通过单因素方差分析检验(One-way ANOVA),P<0.05表示具有显著性差异.
2 实验结果与讨论
2.1 米氏凯伦藻抑藻菌的分离鉴定
从米氏凯伦藻培养液中共分离纯化得到14株单菌,其中一株细菌D-2对米氏凯伦藻的生长具有显著抑制效应. 将测序所得的米氏凯伦藻抑藻菌D-2的16S rRNA基因序列在GenBank数据库中比对,根据序列比对结果,抑藻菌D-2隶属于 Marinobacter属. 对所测定的这株米氏凯伦藻抑藻细菌以及 GenBank数据库中与它们同源性最大的细菌16S rRNA序列构建系统进化树,如图1,可确定D-2为海杆菌属(Marinobacter sp.).


图1 基于16S rRNA的米氏凯伦藻抑藻细菌系统发育树
2.2 抑藻菌对米氏凯伦藻的抑制效应
如图2,经过抑藻试验测得1株细菌Marinobacter. sp可以显著抑制米氏凯伦藻的生长. 对照组中,米氏凯伦藻的生长分别呈现延滞期、平稳增长期和对数生长期,藻细胞密度第0天为7.6×104cells·mL-1,在培养过程中逐渐增加至第7天的1.29×105cells·mL-1,抑藻菌D-2实验组藻细胞密度均明显减少(P<0.05);在前3天时米氏凯伦藻细胞密度随处理时间延长而逐渐降低,在第3天时,藻细胞数即降至最低的0.3×104cells·mL-1,抑制率达到94.9%(P<0.05). Oh等(2011)从微藻Cochlodinium polykrikoides培养液中分离得到一株Sagittulaju属菌株,对有害甲藻类微藻呈现出显著的裂解效果[12].实验结果表明,本文分离得到的一株海杆菌,对米氏凯伦藻赤潮的防治具有潜在应用价值.

图2 抑藻菌对米氏凯伦藻细胞生长的影响
2.3 抑藻菌的作用方式
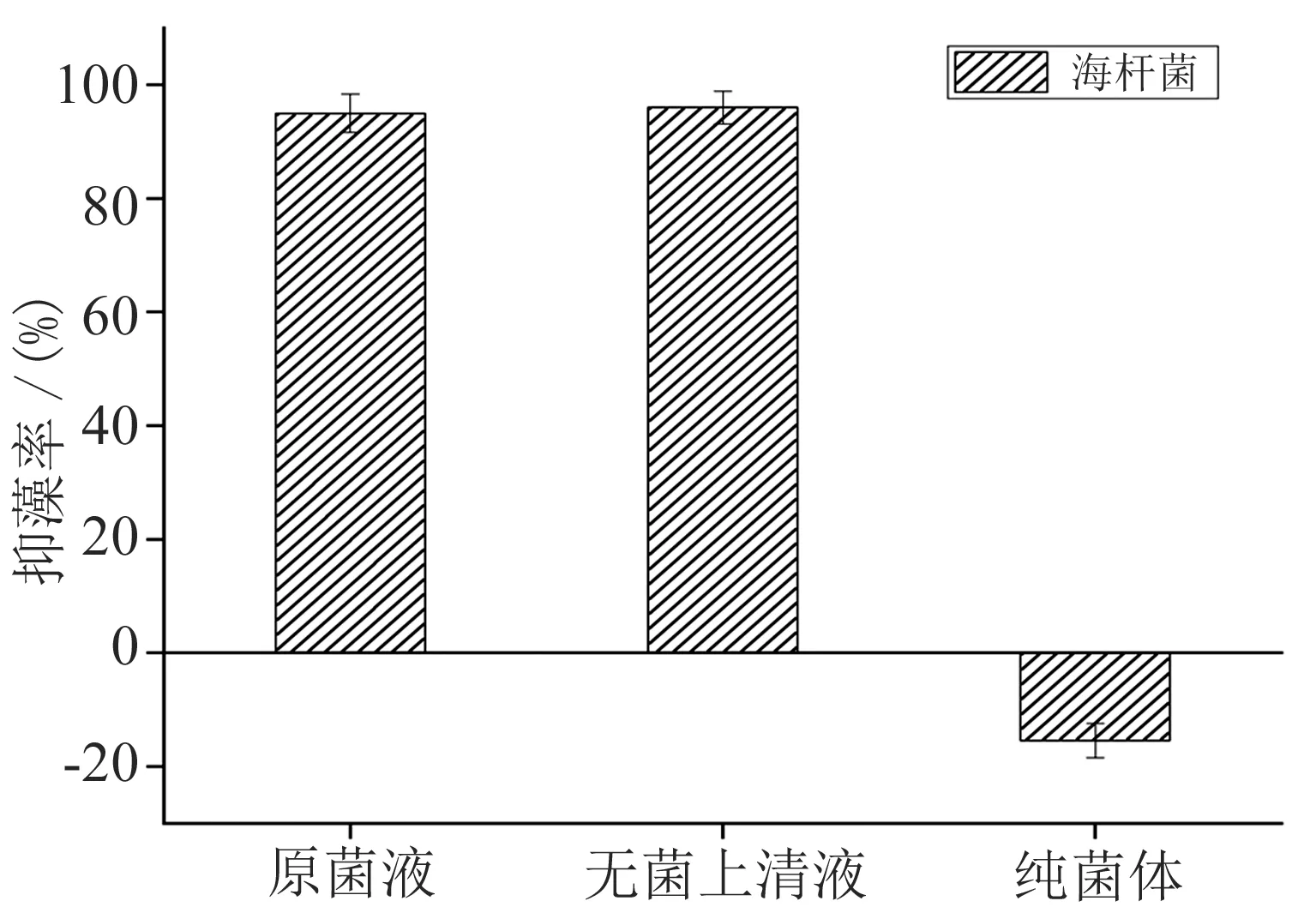
图3 海杆菌抑制米氏凯伦藻的作用方式
海杆菌抑制米氏凯伦藻的作用方式见图3,由图可知3%海杆菌原菌液抑藻效果明显(P<0.05),经离心过滤处理后的海杆菌的无菌上清液也呈现出显著的抑藻效果(P<0.05),在48 h时抑藻率即达到92.9%. 经过离心沉淀得到的海杆菌的纯菌体对米氏凯伦藻生长的抑制效果并不明显(P>0.05),且轻微促进了微藻细胞的生长. 实验结果表明,海杆菌不是通过和米氏凯伦藻细胞直接接触抑藻,可以推断是通过菌体产生的胞外活性物质对藻细胞产生抑制作用的间接抑藻方式. 从赤潮暴发海域分离的一株Halomonas属菌株,其分泌的代谢产物能加速东海原甲藻(Prorocentrum donghaiense)光合色素的分解,使胞内总糖含量降低[13].Zheng等(2018)筛选得到一株Pseudoalteromonas sp.,也通过分泌胞外活性物质对赤潮藻米氏凯伦藻细胞具有明显的裂解作用[14].
2.4 菌液以不同作用浓度投加的抑藻效果
图4为不同作用浓度海杆菌菌液对米氏凯伦藻72 h处理后其生长量的影响效果. 结果表明,对照组中米氏凯伦藻细胞持续生长,随着抑藻菌菌液处理浓度的升高,米氏凯伦藻的生长量呈现显著降低的趋势. 在1%菌液作用浓度下,随着作用时间延长藻细胞密度总体呈现下降趋势,在第3天时表现出对米氏凯伦藻生长的最大抑制作用(P<0.05),在第0.5天时相比对照组抑藻菌对其生长表现为促进作用(负抑制)(P>0.05). 这一现象普遍被认为是低浓度的毒物对微藻产生了刺激效应[15].当菌液浓度为3%时,相比对照组1天以后抑藻菌对藻细胞的生长均表现出显著的抑制效果(P<0.05),抑藻率维持在95%以上,实验结果表明本课题组分离得到的海杆菌株对有害赤潮藻米氏凯伦藻的生长具有短期有效的灭杀效果,且作用浓度在3%以上时抑制效果显著.

图4 不同作用浓度菌液的抑藻效果
3 结 论
利用平板涂布划线方法从生长良好的赤潮藻米氏凯伦藻培养液中分离纯化得到一株抑藻细菌D-2. 采用分子生物学方法,对抑藻菌D-2进行分子鉴定,经16S rRNA 序列分析,菌株D-2隶属于海杆菌属(Marinobacter sp.). 经过藻—菌共培养试验,结果表明海杆菌D-2对米氏凯伦藻细胞的生长具有显著的抑制作用,在共培养第3天时抑藻率即达到95%. 通过离心和过滤方式得到抑藻菌D-2的过滤液和纯菌体并分别进行抑藻实验,实验结果表明其抑藻效应在D-2的除菌上清液中显现,验证了D-2抑藻方式为通过释放抑藻物质的间接裂解方式. 测定不同作用浓度海杆菌D-2菌液在不同作用时间下的抑藻效果,结果表明抑藻菌D-2具有作用浓度和时间依赖性,在3%作用浓度下抑藻效果更佳. 以上结果表明,本课题组分离得到的一株细菌D-2对有害赤潮藻米氏凯伦藻具有短期高效的抑藻作用,为藻—菌关系的互作过程和机理的解读,以及以米氏凯伦藻为优势藻种的赤潮的发生和防控方法提供参考和借鉴.
