米氏凯伦藻胞内多聚磷酸盐对环境磷变化的响应研究*
2022-03-25金文育姚炜民欧林坚郑立极
金文育 姚炜民 欧林坚 郑立极
米氏凯伦藻胞内多聚磷酸盐对环境磷变化的响应研究*
金文育1姚炜民1①欧林坚2郑立极3
(1. 国家海洋局温州海洋环境监测中心站 浙江温州 325035; 2. 暨南大学赤潮与海洋生物学研究中心 广东广州 510632; 3. 浙江浙能温州发电有限公司 浙江乐清 325602)
米氏凯伦藻()赤潮常发生在磷限制海域, 且能长时间维持, 可能具有独特的胞内磷储库利用能力和机制, 但相关认识很少。因此, 论文通过研究不同磷浓度对米氏凯伦藻的生长和生理特征的影响, 重点分析了胞内多聚磷酸盐(polyP)对环境不同磷含量的响应变化, 初步阐明胞内磷储库对米氏凯伦藻生长和维持的作用。结果表明, 当环境磷匮乏时, 米氏凯伦藻以0.15 d–1的比生长速率维持生长, 光合活性和生长能力与磷饱和时无显著差异, 表明其可适应低磷环境。米氏凯伦藻胞内磷库可支持细胞分裂近2次。磷胁迫下, 米氏凯伦藻胞内polyP被保留, 直到磷限制时才被利用, 表明polyP不是其优先利用且唯一的磷储库。研究结果从营养生理学角度为磷储库在米氏凯伦藻赤潮发生中的作用提供一定的科学解释。
米氏凯伦藻; 磷限制; 颗粒磷; 多聚磷酸盐
米氏凯伦藻()是世界广布种, 能够产生毒素, 无需大量细胞就可以严重危害当地生态环境。近年来在我国珠江口、闽江口和长江口频发赤潮, 给养殖业造成了巨大损失, 受到广泛关注(郜钧璋等, 2017; 李晓东, 2018; 吕颂辉等, 2019)。通常认为赤潮的暴发与富营养化有关, 但是米氏凯伦藻赤潮常发生在潜在的磷限制海区(Xu, 2008; Liu, 2009), 可见其对于低磷环境可能有着特殊的适应机制。
目前学者认为浮游植物的低磷适应策略, 主要有三个方面: 提高对外界磷源的吸收水解利用能力(Ou, 2015)、利用胞内磷储库(Martin, 2014)和减少细胞磷需求(Martin, 2011)。已有对米氏凯伦藻耐低磷机制的研究多集中在对胞外磷源利用方面, 如米氏凯伦藻通过5′-核苷酸酶水解ATP, 吸收利用水解产物磷酸盐基团(Luo, 2017); 直接吸收利用葡萄糖-6-磷酸(Zhang, 2017); 吞噬细菌和微藻获得颗粒态的磷源(Zhang, 2011)。目前, 有关米氏凯伦藻对胞内磷储库利用机制的研究很少, 无法揭示其对胞内磷储库的利用能力和机制。
多聚磷酸盐(polyphosphate, polyP)作为胞内磷储库的重要组成部分, 由几个到上百个磷酸基团经高能磷酸酐键连接形成的链状无机化合物, 是细胞内重要的磷酸盐储库, 也是细胞内能量储库及ATP来源(Achbergerová, 2011)。在环境中无机磷酸盐基团(inorganic phosphate, Pi)充足时, 大多数浮游植物具有过量吸收Pi的能力, 在满足细胞代谢和生长的同时, 将多余的Pi以polyP的形式储存起来。这部分磷将保证细胞在低磷时继续维持短时间的高生长速率(Rao, 2009)。然而浮游植物调控polyP的机制并不完全清楚。近年来, 对于polyP的研究大多是大尺度的环境调查(Martin, 2014, 2018; Diaz, 2016)。有必要开展更精细的室内研究, 在复杂的磷变化下, 研究polyP的动态响应。本研究通过分析外界环境磷浓度变化下米氏凯伦藻的生理生长状态, 分析细胞polyP含量变化, 阐明米氏凯伦藻对polyP储存和利用策略, 以期从磷营养盐动力学角度为米氏凯伦藻赤潮的发生提供科学解释。
1 材料与方法
1.1 藻种来源与培养条件
米氏凯伦藻(No. HK-5)由暨南大学赤潮与海洋生物学研究中心藻种室提供, 采用人工海水L1培养基进行培养, 温度(20±1) °C, 光照条件为100 μmol/(m2·s),光暗周期为12 h : 12 h。培养期间添加抗生素合剂(氨苄青霉素200 μg/mL、链霉素100 μg/mL和卡那霉素100 μg/mL)抑制细菌的生长。正式实验前, 培养藻液经5 µg/mL DAPI (Sigma)染色过滤到黑膜上(Millipore), 置于荧光显微镜(Olympus, BX61)下用100×镜观察计数, 检测藻液是否受到细菌污染。
1.2 不同磷浓度及磷恢复下对米氏凯伦藻的影响实验设计
米氏凯伦藻的起始细胞密度为5.0×103cells/mL, 设置2个实验组别: 高磷组(NaH2PO4终浓度为40 μmol/L)和低磷组(NaH2PO4终浓度为5 μmol/L), 每组3个平行样。每天检测细胞密度、溶解态无机磷(dissolved inorganic phosphorus, DIP)含量。选择在第0、3、4、7和10 d检测颗粒磷(particulate phosphorus, PP)和polyP含量。待低磷组DIP浓度低于检出限(0.10 μmol/L) 7 d后, 进行磷恢复实验。两组处理组同时添加NaH2PO4恢复DIP含量至~32 μmol/L, 在添加后的0、24和48 h, 检测细胞密度、叶绿素(chl)含量、最大光化学量子效率(vm)、碱性磷酸酶活性(alkaline phosphatase activity, APA)、polyP和PP含量。
1.3 磷酸盐及生理参数检测方法
浮游植物细胞样品经酸性Lugol’s试剂固定后, 采用100 μL浮游计数框在光学显微镜(Olympus CX23, Janpan)下计数。微藻培养液经离心(2 400, 5 min)收集, 用于polyP测定; 微藻培养液经GF/F滤膜(450 °C煅烧2 h)过滤, 滤液和滤膜分别用于DIP和PP测定。采用磷钼蓝法(Murphy, 1962)检测DIP、Solórzano等(1980)方法测定PP、Ou等(2015)方法测定APA、丙酮萃取法测定chl含量(Jespersen, 1987), 以及Phyto-PAM法测定光化学效率vm。PolyP样品通过离心(2 400, 5 min)方法收集。测定方法参照Martin等(2013) DAPI荧光定量法: 收集的藻细胞超声破碎细胞后, 添加DNA酶、RNA酶和蛋白酶K, 重复萃取3~4次; 取500 μL萃取液加入60 μL 100μmol/L DAPI溶液, 黑暗染色7 min, 摇匀定容至1.5 mL, 采用荧光分光光度计(HITACHI, F-4600)在Ex: 415 nm和Em: 550 nm条件下检测。
1.4 polyP净产生速率计算及数据分析
参考Anderson等(1990)毒素净产生速率的计算公式计算polyP净产生速率, 如下:
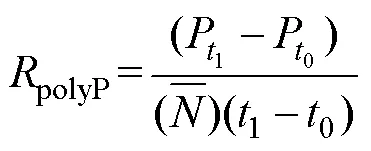
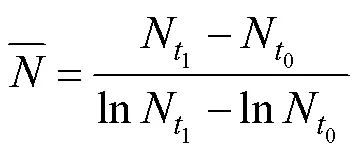
实验数据采用Sigmaplot 14作图, 采用One-way ANOVA(Turkey test)分析显著性水平(<0.05)。
2 结果
2.1 米氏凯伦藻的生长和生理活性
高磷组和低磷组DIP浓度均随时间逐渐下降, 从第4 d起低磷组DIP浓度低于检出限, 而高磷组至第10 d DIP浓度为(8.02±0.64) μmol/L; 在第11 d重新添加NaH2PO4, 恢复DIP含量至~32 μmol/L, 添加后低磷组DIP被快速消耗, 至第13 d DIP浓度再次低于检出限(图1a)。低磷组细胞生长与高磷组无显著差异(>0.05), 均以0.15 d–1生长速率生长, 细胞密度从(5.17±0.26)×103cells/mL增至(2.22±0.14)×104cells/mL, 约增长4.29倍(图1b); 在磷恢复阶段, 低磷组米氏凯伦藻以0.12 d–1生长速率持续生长, 在实验结束时达到最大细胞密度(4.64±0.26)×104cells/mL, 而高磷组在第12 d进入稳定期, 最大细胞密度到达(3.68±0.12)×104cells/mL, 高、低磷组最大细胞密度无显著差异(>0.05)。
在长时间的磷饥饿后, 低磷组第11 d检测到APA为(208.58±27.56) fmol/(cell·h), 约为高磷组的25倍(<0.05, 图2a); 加磷恢复后, 低磷组APA迅速降至(73.04±10.67) fmol/(cell·h), 但仍显著高于高磷组(<0.05)。磷恢复当天和之后两天, 两组间的单位细胞chl含量及vm无显著性差异(>0.05, 图2b, 2c)。
2.2 米氏凯伦藻细胞PP和polyP含量
第1 d, 高磷组细胞PP含量显著上升至(2.13±0.13) pmol/cell, 维持在1.84~1.97 pmol/cell至第11 d (图3); 加磷恢复后, 小幅下降至1.41~ 1.64 pmol/cell。第1 d, 低磷组细胞PP含量达到最大(1.63±0.06) pmol/cell, 之后持续下降至(0.42±0.08) pmol/cell; 这个过程中低磷组细胞PP显著低于高磷组(<0.05), 最大差别可达3.88倍。添加NaH2PO4后24 h即第12 d, 低磷组单位细胞PP含量恢复至高磷组水平(<0.05), 第13 d又开始下降, 与高磷组有显著差异(<0.05)。
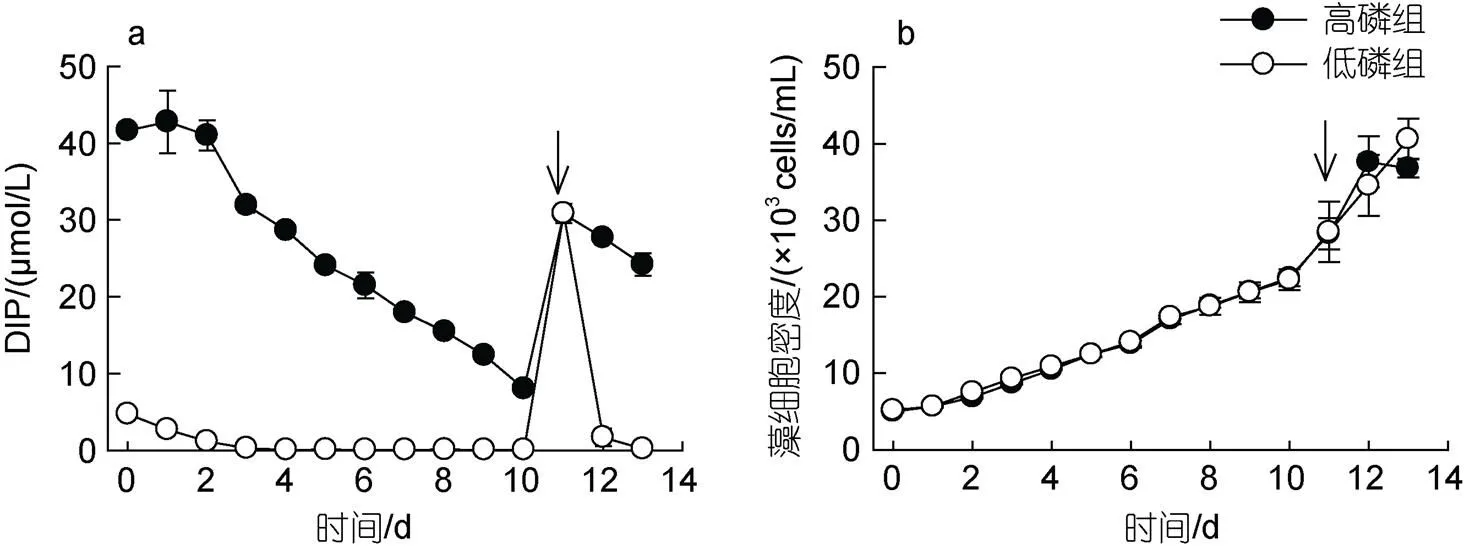
图1 培养基中溶解态无机磷酸盐浓度(DIP, a)和米氏凯伦藻细胞密度(b)变化
注: 箭头表示加磷恢复
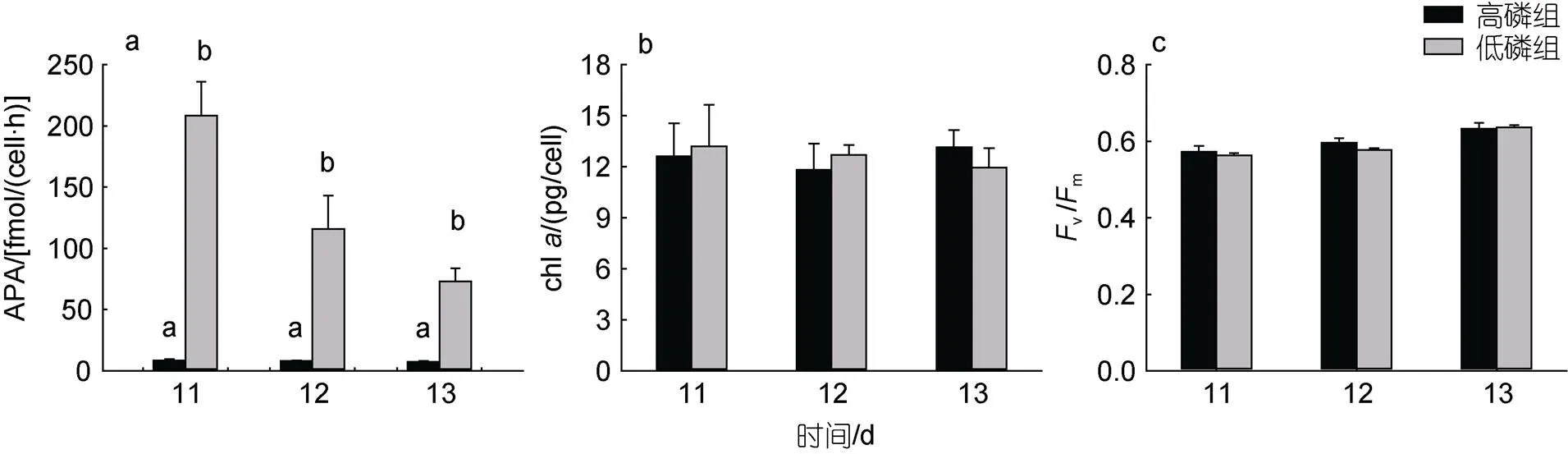
图2 米氏凯伦藻碱性磷酸酶活性(a)、叶绿素a含量(b)、光化学效率Fv/Fm(c)的变化
注: a, b表示同一时间组别间存在显著差异,<0.05
整个实验过程中, 高磷组和低磷组的米氏凯伦藻单位细胞polyP含量均呈现下降、上升再下降的变化趋势, 两组之间没有显著差异(>0.05, 图4a)。但低磷组polyP : PP比值在DIP耗尽时(第4 d)开始高于高磷组, 约为高磷组的2.9~3.3倍(<0.05)至第11 d磷恢复前。加磷恢复后, 低磷组polyP : PP比值因PP上升而回落, 与高磷组无差异(>0.05, 图4b)。对比不同磷浓度下polyP净产生率, 发现环境磷酸盐富余时米氏凯伦藻合成polyP。第3 d高磷组polyP净产生率到达(8.57±1.14)×10–7neq/(cell·d), 随后迅速下降达到稳态; 而低磷组在第3和4 d维持较高净产生率, 最大值为(3.85±2.93)×10–7neq/(cell·d), 第7 d达到稳态, 第11 d时再次发生下降(图4c)。
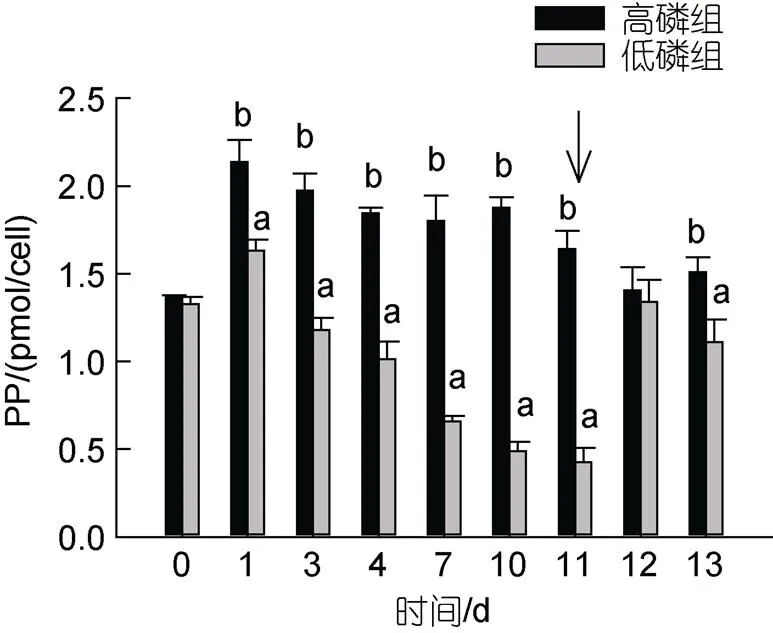
图3 米氏凯伦藻单位细胞颗粒磷含量变化
注: 箭头表示加磷恢复时间, a, b表示组别间存在显著差异,<0.05
3 讨论
本研究发现米氏凯伦藻有较强的耐磷特性。在环境中DIP耗尽(<0.12 μmol/L)后的7 d内, 仍以0.15 d–1生长速率维持生长, 细胞密度增长4.29倍, 其生物量及v/m与同时期高磷组无显著差异, 同时, 缺磷条件下, 米氏凯伦藻单位细胞PP含量逐渐下降, 不断接近最低阈值, 为米氏凯伦藻细胞最低磷需求, 高低磷组间PP含量最大差别可达3.88倍, 表明米氏凯伦藻在DIP不足时能够立刻转向利用胞内磷储库来维持生长, 满足细胞分裂将近2次, 同时光合速率不受影响。该结果与冯青靓(2021)研究一致。而在磷补充后, 经过一段时间磷胁迫下的米氏凯伦藻从环境中快速获取DIP, 单位细胞PP含量迅速恢复至磷饱和水平, 这表明在外界波动的磷环境条件下, 米氏凯伦藻的胞内磷储库有具有重要的调节作用。
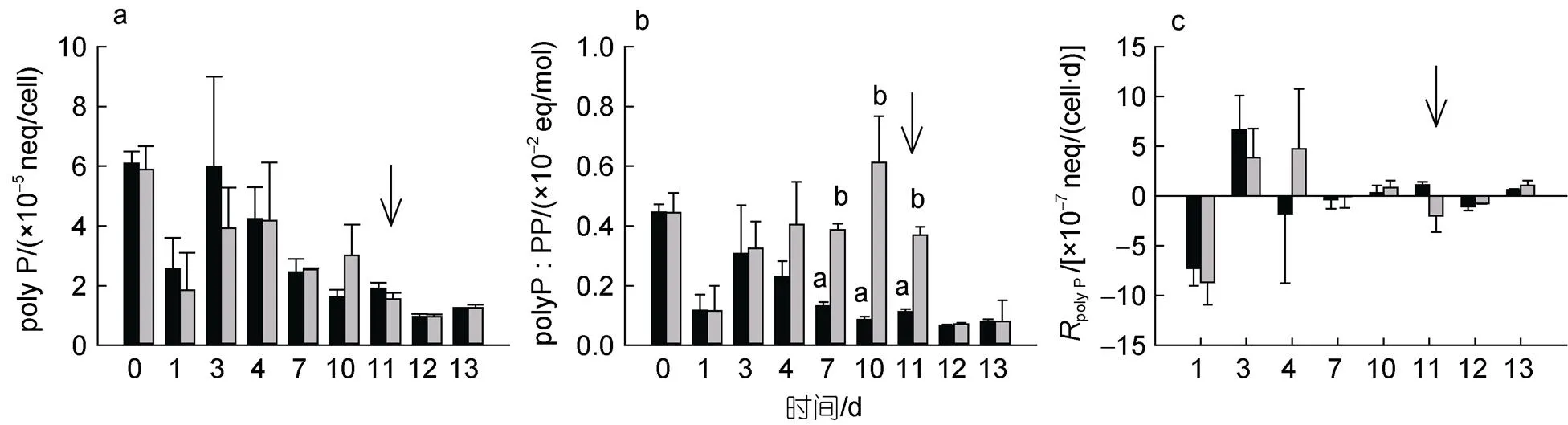
图4 米氏凯伦藻胞内多聚磷酸盐(polyP)含量(a)、多聚磷酸盐与颗粒磷比例(polyP : PP)(b)及多磷酸盐净产生率(RpolyP)(c)变化
PP作为浮游植物总磷储库概念, 包括细胞内绝大部分磷组分, 能够在磷匮乏时提供磷源(Karl, 2014)。本研究中, PP能够支持米氏凯伦藻至少7 d的生长, 该结果与黄银爽(2018)和冯青靓(2021)研究相近, 两者结果均显示PP能够满足米氏凯伦藻5 d生长。若将胞内磷储库细分, 一般认为浮游植物中有4种重要的磷储库: polyP、磷脂、核酸和胞内DIP (Karl, 2014)。其中, polyP作为重要的胞内磷储库, 广泛存在于原核和真核细胞中(Kulaev, 2004)。在外界环境营养充足的情况下, 浮游植物会过量摄取Pi, 满足自身生长分裂需求后, 将多余的磷以polyP形式储存(Rao, 2009)。此外, polyP也是能量储库, 是ATP的主要来源(Achbergerová, 2011)。本次实验米氏凯伦藻中检测到polyP含量约4×10–5neq/cell, 第4 d后单位细胞polyP含量逐渐下降, 即使磷恢复也无明显增加。推测磷恢复后, 米氏凯伦藻细胞分裂加快, 稀释细胞polyP含量增加, 掩盖了其变化趋势。
细胞polyP净产生率较细胞polyP含量更好地反映细胞内polyP合成与利用。通过polyP净产生率结果发现, 米氏凯伦藻可能通过利用胞内polyP度过适应阶段, 随后吸收DIP合成polyP以补充消耗及储存, 即磷的过量吸收(luxury uptake, Elizabeth, 2010)。磷饱和状态下, 米氏凯伦藻先达到稳态, polyP净产生率0.33×10–7neq/(cell·d), polyP合成与利用达到平衡。磷胁迫状态下, 米氏凯伦藻前期维持相对较高polyP净产生率[4.72×10–7neq/(cell·d)], 以充分利用外界的磷酸盐, 直至环境中磷耗尽, 合成过程终止。此时polyP : PP比值上升, 这与Martin等(2014)的研究结果一致。若浮游植物受到磷胁迫时主要动用polyP储库来维持生长, polyP : PP应下降, 相较于传统观点认为胞内polyP是浮游植物在磷胁迫下利用的最重要的胞内磷库, 可见polyP不是米氏凯伦藻优先利用且唯一的磷储库。这可能与细胞大小有关, polyP相比Pi所需的空间要小(聚集形成颗粒), 小细胞的浮游植物更加需要累积polyP做为磷储库(Raven, 2010)。因此polyP对大细胞的米氏凯伦藻可能不是首选, 只有达到极度磷限制时才被利用[polyP的净产生率为-1.98×10–7neq/(cell·d)]。在实验后期的磷补充恢复阶段, 极度磷限制的米氏凯伦藻吸收大量DIP, 此时polyP净产生率为-0.76×10–7neq/(cell·d), 未出现过剩反应(overplus response, 即磷胁迫下因另补充Pi出现polyP累积现象(Elizabeth, 2010)), 表明吸收入细胞内的磷并未用于合成polyP, 而是优先补充其他磷储库。如甘油磷脂是细胞膜的基本组成部分, 占细胞总磷10%~20%, 在营养限制条件下是一个可被利用潜在的磷库(Liang, 2019)。假威海链藻()添加磷恢复后能够快速将非磷脂转换回磷脂(Martin, 2011)。米氏凯伦藻也可能存在这种能力, 随后将富余的磷酸盐逐渐合成polyP。
4 结论
米氏凯伦藻有较强的耐磷特性能, 利用胞内磷储库应对低磷环境, 维持生长速率并保持生理活性。PP能够支持米氏凯伦藻至少7 d, 比生长速率0.15 d–1的生长, 可以满足细胞分裂将近2次, 同时光合速率不受影响。一旦磷恢复, 米氏凯伦藻会迅速吸收DIP补充自身PP消耗。磷胁迫状态下米氏凯伦藻polyP : PP比值上升, 可见polyP不是米氏凯伦藻优先利用且唯一的磷储库, 相较于传统观点认为胞内polyP是浮游植物在磷胁迫下利用的最重要的胞内磷库, 米氏凯伦藻对胞内磷资源的分配利用上可能存在其他更为经济、高效的通路, 值得进一步研究。
冯青靓, 2021. 米氏凯伦藻细胞膜脂对环境中磷变化的生理生化响应机制[D]. 广州: 暨南大学.
吕颂辉, 岑竞仪, 王建艳, 等, 2019. 我国近海米氏凯伦藻()藻华发生概况、危害及其生态学机制[J]. 海洋与湖沼, 50(3): 487-494.
李晓东, 2018. 米氏凯伦藻(福建株)毒性效应与毒理机制的研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所).
郜钧璋, 刘亚林, 林义, 等, 2017. 近10年温州近岸海域赤潮灾害特征分析[J]. 海洋湖沼通报(4): 86-90.
黄银爽, 2018. 米氏凯伦藻()对胞外磷源转运及水解机制的初步研究[D]. 广州: 暨南大学.
ACHBERGEROVÁ L, NAHÁLKA J, 2011. Polyphosphate-an ancient energy source and active metabolic regulator [J]. Microbial Cell Factories, 10(1): 63.
ANDERSON D M, KULIS D M, SULLIVAN J J,, 1990. Dynamics and physiology of saxitoxin production by the dinoflagellatesspp. [J]. Marine Biology, 104(3): 511-524.
DIAZ J M, BJÖRKMAN K M, HALEY S T,, 2016. Polyphosphate dynamics at Station ALOHA, North Pacific subtropical gyre [J]. Limnology and Oceanography, 61(1): 227-239.
JESPERSEN A M, CHRISTOFFERSEN K, 1987. Measurements of chlorphyll-a from phytoplankton using ethanol as extraction solvent., 109(3): 445-454.
KARL D M, 2014. Microbially mediated transformations of phosphorus in the sea: new views of an old cycle [J]. Annual Review of Marine Science, 6: 279-337.
KULAEV I S, VAGABOV V M, KULAKOVSKAYA T V, 2004. The Biochemistry of Inorganic Polyphosphates [M]. Chichester, UK: Wiley.
LIANG J B, IQBAL S Y, WEN F,, 2019. Phosphorus-induced lipid class alteration revealed by lipidomic and transcriptomic profiling in oleaginous microalgasp. PJ12 [J]. Marine Drugs, 17(9): 519.
LIU S M, HONG G H, ZHANG J,, 2009. Nutrient budgets for large Chinese estuaries [J]. Biogeosciences, 6(10): 2245-2263.
LUO H, LIN X, LI L,, 2017. Transcriptomic and physiological analyses of the dinoflagellatereveal non-alkaline phosphatase-based molecular machinery of ATP utilisation [J]. Environmental Microbiology, 19(11): 4506-4518.
MARTIN P, DYHRMAN S T, LOMAS M W,, 2014. Accumulation and enhanced cycling of polyphosphate by Sargasso Sea plankton in response to low phosphorus [J]. Proceedings of the National Academy of Sciences of the United States of America, 111(22): 8089-8094.
MARTIN P, LAURO F M, SARKAR A,, 2018. Particulate polyphosphate and alkaline phosphatase activity across a latitudinal transect in the tropical Indian Ocean [J]. Limnology and Oceanography, 63(3): 1395-1406.
MARTIN P, VAN MOOY B A S, 2013. Fluorometric quantification of polyphosphate in environmental plankton samples: extraction protocols, matrix effects, and nucleic acid interference [J]. Applied and Environmental Microbiology, 79(1): 273-281.
MARTIN P, VAN MOOY B A S, HEITHOFF A,, 2011. Phosphorus supply drives rapid turnover of membrane phospholipids in the diatom[J]. The ISME Journal, 5(6): 1057-1060.
MURPHY J, RILEY J P, 1962. A modified single solution method for the determination of phosphate in natural waters [J]. Analytica Chimica Acta, 27: 31-36.
ORCHARD E D, BENITEZ-NELSON C, PELLECHIA P J,, 2010. Polyphosphate infrom the low-phosphorus Sargasso Sea [J]. Limnology and Oceanography, 55(5): 2161-2169.
OU L J, HUANG X Y, HUANG B Q,, 2015. Growth and competition for different forms of organic phosphorus by the dinoflagellatewith the dinoflagellateand the diatoms.l. [J]. Hydrobiologia, 754(1): 29-41.
RAO N N, GÓMEZ-GARCÍA M R, KORNBERG A, 2009. Inorganic polyphosphate: essential for growth and survival [J]. Annual Review of Biochemistry, 78: 605-647.
RAVEN J A, KNOLL A H, 2010. Non-skeletal biomineralization by eukaryotes: matters of moment and gravity [J]. Geomicrobiology Journal, 27(6/7): 572-584.
SOLÓRZANO L, SHARP J H, 1980. Determination of total dissolved phosphorus and particulate phosphorus in natural waters [J]. Limnology and Oceanography, 25(4): 754-758.
XU J, YIN K D, HE L,, 2008. Phosphorus limitation in the northern South China Sea during late summer: influence of the Pearl River [J]. Deep Sea Research Part I: Oceanographic Research Papers, 55(10): 1330-1342.
ZHANG C, LUO H, HUANG L M,, 2017. Molecular mechanism of glucose-6-phosphate utilization in the dinoflagellate[J]. Harmful Algae, 67: 74-84.
ZHANG Q C, YU R C, SONG J J,, 2011. Will harmful dinoflagellategrow phagotrophically? [J]. Chinese Journal of Oceanology and Limnology, 29(4): 849-859.
RESPONSE OF INTRACELLULAR POLYPHOSPHATE INTO THE VARIATION OF PHOSPHORUS IN THE ENVIRONMENT
JIN Wen-Yu1, YAO Wei-Min1, OU Lin-Jian2, ZHENG Li-Ji3
(1. Wenzhou Marine Environmental Monitoring Center Station, Wenzhou 325035, China; 2. Research Center of Harmful Algae and Marine Biology, Jinan University, Guangzhou 510632, China; 3. Zhejiang Zheneng Wenzhou Power Co., Ltd., Yueqing 325602, China)
blooms often occur in phosphorus (P)-limited sea areas and can last for a long time under P deficiency. To classify the major role of P pool during blooms, the growth and the physiological response of intracellular P pool, especially polyphosphate, inwere examined under different P conditions.could sustain growth at a growth rate of 0.15 d–1under P depleted environment and its photosynthetic activity and growth capability showed no difference with those in P-replete conditions, showing the ability of acclimation ofto P deficiency. The particulate phosphorus content in the intracellular P pool could support cells to divide almost twice. Under a low-phosphate condition, intracellular polyphosphate was synthesized adequately, and did not decrease until cell growth was suppressed under P-limited condition, suggesting that polyphosphate was not a preferred utilized intracellular P pool nor the unique P pool. This study provided an insight for understanding P regulation induring its bloom from the perspective of nutritional physiology.
; P-limitation; particulate phosphorus; polyphosphate
*国家重点研发计划, 2017YFC1404300号; 国家自然科学基金, 41776121号。金文育, 硕士研究生, E-mail: jinwenyu@ stu2016.jnu.edu.cn
姚炜民, 高级工程师, E-mail: ywm@ecs.mnr.gov.cn
2021-06-19,
2021-09-30
X173
10.11693/hyhz20210600140
