重金属镉和铅胁迫对海洋微藻的毒性效应研究
2019-07-02蔡卓平刘伟杰骆育敏吴皓刁盼盼段舜山
蔡卓平,刘伟杰,骆育敏,吴皓,刁盼盼,段舜山
1.广东省生态学会,广州 510600
2.暨南大学生态系,广州 510632
0 前言
随着人类社会经济的快速发展,重金属的环境污染问题日趋突出,已引起人们广泛的关注。重金属污染物最终可能会汇入海洋,对海洋生物产生毒害,破坏海洋生态系统的结构和功能。海洋生态系统中的重金属来源主要有陆源输入、天然源和大气沉降,其中陆源输入是海洋重金属污染的常见来源[1-2]。海洋环境中监测到的重金属污染物通常有镉、铅、铜、锌、汞、铬等,它们具有环境残留时间长、难以降解、可沿着食物链传递富集、危害不可逆性等特点。例如重金属铅Pb 能导致生物中枢神经系统损坏,也能引起肾脏、肝脏和大脑功能的衰竭;重金属镉Cd对人类可以产生“三致性”危害(致癌、致畸、致突变)。这些重金属污染物进入近海水体后,可通过食物链传递,威胁到人类健康[3-4]。海洋微藻是海洋生态系统最主要的初级生产者,此外,它们对毒物敏感性强,繁殖迅速,生长周期短,容易获得,因此它们也被认为是一种很好的化学品风险测试生物[5]。米氏凯伦藻(Karenia mikimotoi)属于甲藻门,裸甲藻目,凯伦藻属,营游泳生活,细胞长15.6—31.2 μm,宽 13.2—24 μm,是常见的有毒、有害赤潮藻,属世界广布种,常见于温带和热带浅海水域。其早于1935年在日本地区的海湾被发现,随后在美洲湾、英吉利海峡等全球海域都被发现,1998年中国南海大鹏湾、深圳湾、珠江口及内伶仃岛等一带海域也发生过较大规模的米氏凯伦藻赤潮[6]。米氏凯伦藻具有较强的环境适应能力,其诱发的赤潮给沿海国民经济造成了巨大的损失,也给人们的健康带来威胁。本文选用米氏凯伦藻为生物研究材料,设置不同浓度的重金属镉和铅处理,重点研究重金属Cd2+和Pb2+胁迫对藻细胞生长的影响,分析重金属胁迫下藻体内抗氧化酶和光合效应的变化情况,希望为了解重金属胁迫对海洋微藻的毒性效应提供参考和积累数据。
1 材料与方法
1.1 实验材料
实验生物材料米氏凯伦藻(Karenia mikimotoi)取自暨南大学生命科学技术学院水生生物研究中心藻种室。微藻培养所用的人工海水经高压湿热灭菌,冷却后用于微藻的培养。玻璃三角瓶预先用稀HCl浸泡24 h,经蒸馏水冲洗干净,烘干、灭菌备用。将已知起始密度的目标藻种分别接种于添加f/2 培养基的灭菌人工海水中,玻璃三角瓶放置在人工气候光照培养箱中静止培养,培养温度为(23±1) ,℃ 光照强度约为80 μmol·m-2·s-1,光暗周期为12h:12h。每日定期摇晃玻璃三角瓶,随机改变其位置以减少其他因素作用。实验开始前预先对藻种活化及扩大培养,并选取对数生长期的海洋微藻用于实验。所用的CdCl2和PbCl2均购自上海阿拉丁试剂有限公司,分析纯,纯度≥99.8%。
1.2 研究方法
培养基经高压蒸汽灭菌冷却后,分装于150 mL玻璃三角瓶中,每瓶100 mL。选取对数生长期藻种进行接种,初始接种浓度为1.0×105个·mL-1。重金属离子的工作液由储备液由培养基稀释得到,根据预实验设置重金属Cd2+浓度梯度为0、0.2、0.4、0.6、0.8 和1 mg·L-1;设置Pb2+浓度梯度为0、0.1、0.2、0.4、0.8 和1.6 mg·L-1。每个处理(含对照组)设置3 个平行重复,培养96 h。利用细胞计数观测藻细胞的生长繁殖,并绘制生长曲线并计算比生长速率(μ)。比生长速率(μ)以藻细胞数均值为基础数据,按照下面公式进行计算:

式中:Nt和N0分别为t(96 h)时刻和t0(初始接种)时的藻细胞数。在比生长率速率基础上,采用概率单位-浓度对数法绘制曲线,根据线性回归方程计算96 h的半数抑制浓度(EC50)。
参照有关文献[7-8]测定不同浓度重金属Cd2+和Pb2+对米氏凯伦藻叶绿体色素含量的影响。取10 mL培养96 h 的藻液,经高速冷冻离心机4 ℃,5000 g 离心15 min,弃上清液,加入5 mL 抽提液(丙酮:乙醇= 1:1),震荡摇匀之后,4 ℃黑暗静置24 h 后,同条件离心15 min,取上清液,用紫外-可见光分光光度计UV2450 测定440、645、663 nm 波长下上清液的吸光值,以抽提液作为空白对照,参照以下公式计算叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)的含量(mg·L-1):

受试藻种不同浓度重金属Cd2+和Pb2+暴露处理96 h 后,取2 mL 藻液转移至专用测量小瓶,于暗箱中暗适应30 min,利用植物效率仪(PAM)在室温下进行测定,由3000 µmol·m-2·s-1的连续光诱导,荧光信号记录从10 µs 开始,至2 s 结束。记录最大光能转化效率(Fv/Fm)值。重金属Cd2+和Pb2+暴露处理米氏凯伦藻96 h 后,采用南京建成公司相应的试剂盒,参照操作手册测定藻体超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)的含量。
1.3 数据统计
采用SPSS 软件进行统计分析,结果以平均值±标准误差 (Mean±SE)表示。
2 结果与分析
2.1 重金属镉和铅胁迫对米氏凯伦藻细胞生长的毒性效应
随着实验时间的延长,不同重金属处理下米氏凯伦藻的细胞密度均呈现增长趋势(图1),表明米氏凯伦藻对重金属镉、铅胁迫具有一定的适应性。从24 h 开始,较高浓度(0.6、0.8 和1 mg·L-1)重金属Cd2+处理下米氏凯伦藻的细胞密度明显低于较低浓度(0、0.2 和0.4 mg·L-1)重金属Cd2+处理下的细胞密度。随着Cd2+浓度的提高,毒害作用增强,藻细胞密度下降。至实验结束时(96 h),0、0.2、0.4、0.6、0.8和1 mg·L-1重金属Cd2+处理下米氏凯伦藻的细胞密 度分别为56.7×104、39.4×104、33.1×104、27.5×104、24.3×104和17.6×104个·mL-1。重金属Pb2+处理下米氏凯伦藻的细胞密度呈现出类似变化趋势。随着Pb2+浓度的提高,米氏凯伦藻细胞受到明显的抑制。96 h时,0、0.1、0.2、0.4、0.8 和1.6 mg·L-1重金属Pb2+处理下米氏凯伦藻的细胞密度分别为51.7×104、47.4× 104、43.9×104、31.5×104、26.2×104和18.9×104个·mL-1。结果显示重金属镉和铅胁迫对米氏凯伦藻的细胞生长产生毒害作用,但是两者对米氏凯伦藻的毒害强度不同。实验过程中根据线性回归方程计算重金属镉和铅对米氏凯伦藻96 h 半数抑制浓度(EC50),结果分别为0.684 和0.966 mg·L-1。
2.2 重金属镉、铅胁迫对米氏凯伦藻光合色素含量的影响
重金属镉、铅胁迫对米氏凯伦藻叶绿素a、叶绿素b 和类胡萝卜素的影响情况如图2所示。随着Cd2+浓度的提高,叶绿素a和叶绿素b含量呈现降低的趋势,而类胡萝卜素含量呈现升高的趋势。96 h 时,0、0.2、0.4、0.6、0.8 和1 mg·L-1重金属Cd2+处理下的米氏凯伦藻叶绿素含量分别为0.35、0.35、0.28、0.23、0.15 和0.08 mg·L-1,叶绿素b 含量分别为0.08、0.12、0.05、0.03、0.02 和0.02 mg·L-1,类胡萝卜素含量分别为0.13、0.13、0.25、0.31、0.45 和0.41 mg·L-1。随着重金属Pb2+浓度的提高,米氏凯伦藻叶绿素a 含量降低,叶绿素b 先降低后上升,类胡萝卜素升高。96 h 时,0、0.1、0.2、0.4、0.8 和1.6 mg·L-1重金属Pb2+处理下的米氏凯伦藻叶绿素a 含量分别为0.35、0.28、0.25、0.18、0.12 和0.11 mg·L-1,叶绿素b 含量为0.08、0.05、0.05、0.03、0.03 和0.14 mg·L-1,类胡萝卜素为0.13、0.21、0.23、0.37、0.41 和0.44 mg·L-1。

图1 重金属Cd2+(a)和Pb2+(b)处理对米氏凯伦藻细胞密度的影响 Figure1 Change of cell density of K.mikimotoi grown in different concentration of Cd2+ (a) and Pb2+ (b)

图2 重金属 Cd2+(a)和Pb2+(b)处理对米氏凯伦藻光合色素含量变化 Figure2 Change of photosynthetic pigment content of K.mikimotoi in different concentration of Cd2+ (a) and Pb2+ (b)
2.3 重金属镉、铅胁迫对米氏凯伦藻光合效率的影响
如图3所示,重金属镉、铅胁迫导致米氏凯伦藻的最大光能转化效率降低。0、0.2、0.4、0.6、0.8和1 mg·L-1重金属Cd2+处理下米氏凯伦藻的最大光能转化效率为分别0.59、0.52、0.52、0.47、0.38 和0.29;0、0.1、0.2、0.4、0.8 和1.6 mg·L-1重金属Pb2+处理下米氏凯伦藻的最大光能转化效率分别为0.52、0.50、0.44、0.39、0.29 和0.24。
2.4 重金属镉、铅胁迫下米氏凯伦藻的抗氧化系统响应
2.4.1 重金属镉、铅胁迫下米氏凯伦藻的超氧化物歧化酶(SOD)变化情况
0.4、0.6和0.8 mg·L-1浓度的重金属Cd2+胁迫提高米氏凯伦藻超氧化物歧化酶(SOD)活性,其平均值分别较对照提高了约36%、40%和10%;同样地,0.1、0.2 和0.4 mg·L-1浓度的重金属Cd2+胁迫也一定程度上提高米氏凯伦藻超氧化物歧化酶(SOD)活性,其平均值分别较对照提高了约67%、42%和27%。
2.4.2 重金属镉、铅胁迫下米氏凯伦藻的过氧化氢酶(CAT)变化情况
不同浓度重金属镉、铅胁迫下米氏凯伦藻的过氧化氢酶(CAT)变化情况如图5。米氏凯伦藻的过氧化氢酶(CAT)活性随着重金属Cd2+浓度的提高而增强;同样地,米氏凯伦藻过氧化氢酶(CAT)活性随着重金属Pb2+浓度的提高而增强。0、0.2、0.4、0.6、0.8 和1 mg·L-1重金属Cd2+处理下米氏凯伦藻的过氧化氢酶(CAT)活性平均值分别为0.53、0.59、0.81、12.8、19.1 和22.4 U·mg-1;0、0.1、0.2、0.4、0.8 和1.6 mg·L-1重金属Pb2+处理下米氏凯伦藻的过氧化氢酶(CAT)活性平均值分别为6.10、9.49、15.68、23.15、24.58 和25.10 U·mg-1。
2.2.3 重金属镉、铅胁迫下米氏凯伦藻的丙二醛(MDA)变化情况
重金属镉、铅胁迫导致米氏凯伦藻的丙二醛(MDA)升高(图6)。0.2、0.4、0.6、0.8 和1 mg·L-1重金属Cd2+处理下米氏凯伦藻的丙二醛(MDA)较对照提高的幅度分别为39%、89%、115%、275% 和344%;0.1、0.2、0.4、0.8 和1.6 mg·L-1重金属Pb2+处理下米氏凯伦藻的丙二醛(MDA)较对照提高的幅度分别为 47%、134%、160%、239%和282%。

图3 重金属Cd2+(a)和Pb2+(b)处理对米氏凯伦藻最大光能转化效率变化 Figure3 Change of maximal photochemical efficiency of K.mikimotoi grown in different concentration of Cd2+ (a) and Pb2+ (b)
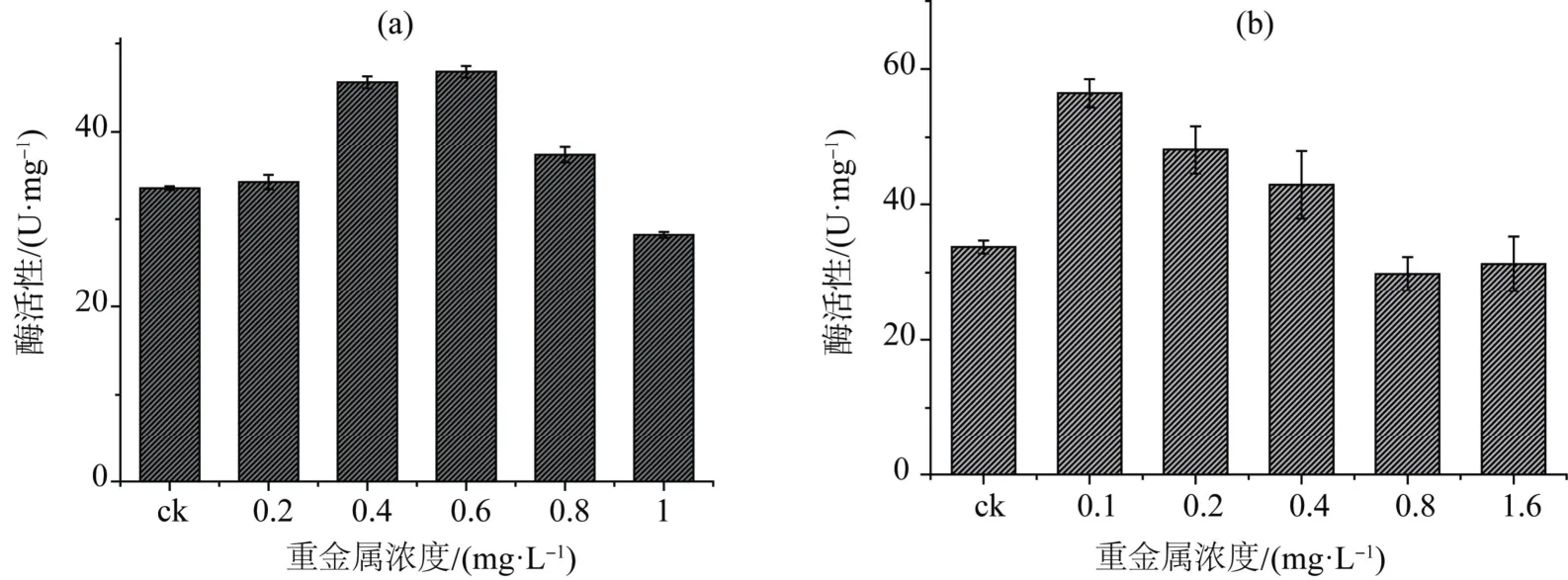
图4 重金属Cd2+(a)和Pb2+(b)处理对米氏凯伦藻超氧化物歧化酶(SOD)变化 Figure4 Change of SOD activity of K.mikimotoi grown in different concentration of Cd2+ (a) and Pb2+ (b)

图5 重金属Cd2+(a)和Pb2+(b)处理对米氏凯伦藻过氧化氢酶(CAT)变化 Figure5 Change of CAT activity of K.mikimotoi grown in different concentration of Cd2+ (a) and Pb2+ (b)
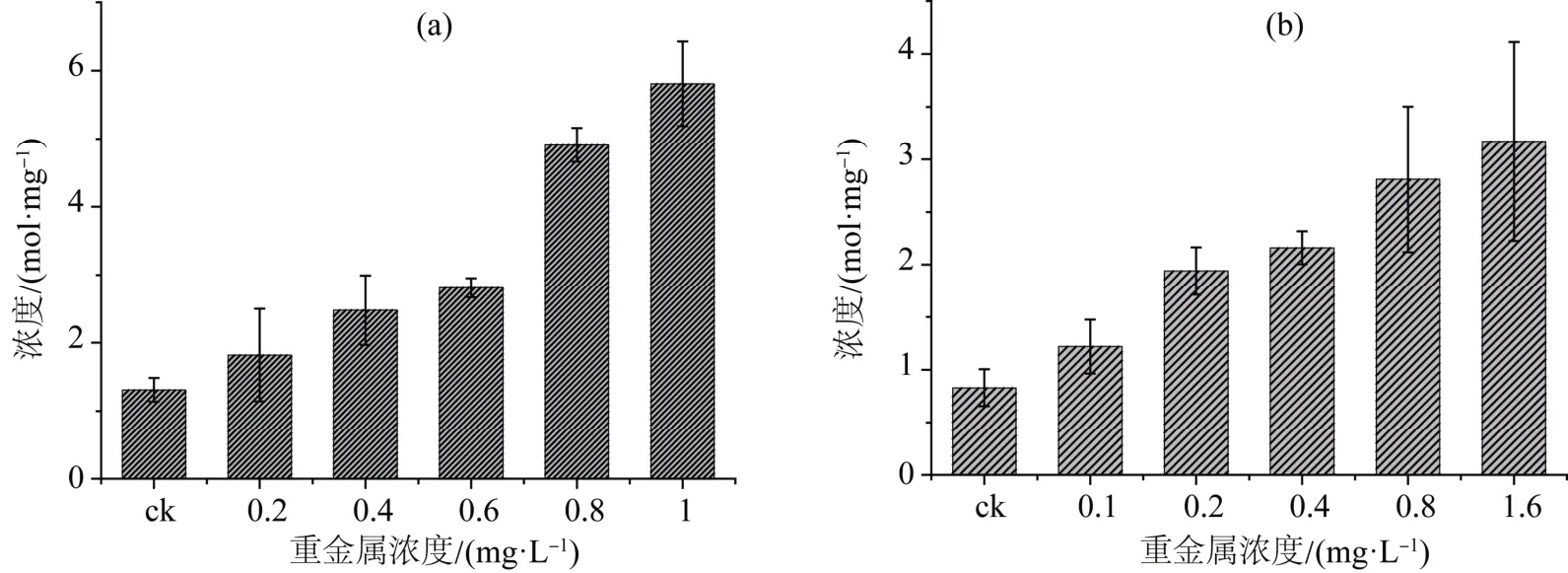
图6 重金属Cd2+(a)和Pb2+(b)处理对米氏凯伦藻丙二醛(MDA)变化 Figure6 Change of MDA activity of K.mikimotoi grown in different concentration of Cd2+ (a) and Pb2+ (b)
3 讨论
因为藻细胞壁上带有的负电荷以及羟基和氨基等官能团,会对含有正电荷的金属离子有着较大的亲和力,所以重金属与微藻接触时,首先是藻细胞对重金属离子的吸附。高浓度重金属胁迫会使得藻细胞表面的许多官能团会与金属离子结合而丧失活性,进而影响藻的新陈代谢和生化反应过程,最终使藻生长受到抑制甚至死亡[9-10]。本研究中,随着Cd2+和Pb2+浓度的提高,其对米氏凯伦藻细胞的毒害作用增强,藻细胞生长受抑制显著。96 h 时,0.2、0.4、0.6、0.8 和1 mg·L-1重金属Cd2+处理下的米氏凯伦藻细胞密度较对照分别下降了31%、42%、51%、57%和69%;0.1、0.2、0.4、0.8 和1.6 mg·L-1重金属Pb2+处理下的米氏凯伦藻细胞密度较对照分别下降了8%、15%、15%、39%、49%和63%,表明不同金属与藻细胞的结合吸附程度不同,表现出来的毒性也有所不同。根据线性回归方程计算重金属镉、铅对米氏凯伦藻的96 h 半数抑制浓度(EC50),结果分别为0.684 和0.966 mg·L-1,表明镉和铅都是对海洋微藻毒性较强的重金属种类。
光合作用是绿色植物最基本和最重要的生命活动过程,叶绿素是植物进行光合作用的主要色素,其含量的高低在一定程度上反映光合作用的强度,是植物受环境胁迫的一个重要表征指标[11-12]。在本研究中,在较高浓度重金属Cd2+胁迫下米氏凯伦藻的叶绿素a和叶绿素b含量降低,推测是由于重金属进入藻细胞后,抑制了叶绿素酸脂还原酶等物质的活性,阻碍了叶绿素的合成;又或者是吸收进体内的重金属跟叶绿体的蛋白质上的—SH 结合,或取代了Zn2+等,破坏了叶绿体的结构和功能活性,导致叶绿素含量降低[13]。类胡萝卜素能将吸收的光能传递给叶绿素,是光合作用不可缺少的光合色素,同时,类胡萝卜素也是植物一种重要保护剂。重金属Cd2+和Pb2+胁迫下,类胡萝卜素有明显提高,推测这可能是米氏凯伦藻应对重金属胁迫的一种适应机制,通过提高体内的类胡萝卜素来降低重金属Cd2+和Pb2+胁迫导致的伤害。叶绿素荧光是光合作用的良好指标和探针,通过对各种荧光参数的分析,可以得到有关光能利用途径的信息,也可以反映植物受胁迫的情况[11]。研究结果发现,重金属镉、铅胁迫下,米氏凯伦藻的最大光能转化效率降低,96 h 时0、0.2、0.4、0.6、0.8 和1 mg·L-1重金属Cd2+处理下米氏凯伦藻的最大光能转化效率为分别0.59、0.52、0.52、0.47、0.38 和0.29;0、0.1、0.2、0.4、0.8 和1.6 mg·L-1重金属Pb2+处理下米氏凯伦藻的最大光能转化效率分别为0.52、0.50、0.44、0.39、0.29和0.24,表明重金属胁迫使得藻PSⅡ反应中心受损,抑制了光合作用的原初反应,阻碍光合电子传递的过程。
丙二醛(MDA)是膜脂质过氧化的重要产物,它能交联脂类、核酸、糖类及蛋白质从而对质膜结构和功能造成不良影响。MDA 含量的高低可以反映藻细胞膜脂过氧化的程度,同时也间接反映藻细胞的损伤程度[14-15]。本研究结果发现,重金属胁迫下,藻细胞的MDA 含量增高,表明藻细胞膜透性增加,细胞膜系统受损,细胞结构遭到破坏。海洋微藻在遭受到重金属胁迫,体内会产生过多的活性氧物质,使得活性氧的产生与清除处于一种非平衡状态,此时微藻体内抗氧化系统就可能增强以清除多余的活性氧,从而减轻由活性氧积累产生的氧化伤害。保护酶体系SOD、CAT 是抗氧化酶防御系统中的重要保护酶,能够在一定浓度重金属污染范围内对过氧化物起到清除作用,这可能是微藻对重金属有一定抗性的主要原因之一[16]。本研究的结果显示,较低程度的重金属Cd2+和Pb2+胁迫下SOD 活性提高,表明较低浓度的重金属离子能使机体抗氧化酶系统对其产生应激性,清除机体产生过多的自由基,相对活性增强,而随着重金属胁迫的增强,活性不再增强,甚至SOD 酶系统遭到了破坏,活性受到抑制。重金属胁迫下,藻细胞的CAT 活性增强,有利于将SOD 酶反应产生的H2O2分解为H2O 和O2,对细胞起到保护作用,以减少重金属胁迫对微藻的毒害效应。此外,还有研究表明,海洋微藻应对重金属胁迫的生理生态机制还包括诱导或调节体内金属硫蛋白(Metallothionein,MT)等相关蛋白基因的表达等。金属硫蛋白是一种富含半胱氨酸、热稳定性、可诱导型非酶低分子量金属结合蛋白,有研究表明大多数生物体内金属硫蛋白分子结构,由两个大小相近的结构域构成哑铃型,两个结构域通过赖氨酸残基相连[17-18]。金属硫蛋白的-SH 能强烈螯合有毒的游离金属离子,减弱重金属离子毒性,并可将之排出体外,其在必需金属元素的调节和非必需金属元素的解毒等方面起到重要的作用。
