白茅苷缓解STZ诱导的I型糖尿病幼龄鼠肝损伤
2021-04-14丁艳琴汤兴萍
丁艳琴,汤兴萍,徐 奎,李 萍,李 玲
(1.河西学院附属张掖人民医院儿科,甘肃张掖 734000;2.张掖市中医院糖尿病专科,甘肃张掖,734000;3.河西学院临床医学院教科办,甘肃张掖 734000)
I 型糖尿病又称为胰岛素依赖性糖尿病,是指体内胰岛素缺乏导致葡萄糖、蛋白质、脂肪代谢紊乱,血糖水平持续升高,并最终形成糖尿病[1]。该病多发于儿童和青少年,起病迅速,长时间的胰岛素不足容易造成酮症酸中毒,严重威胁人类生命健康。据统计,我国I 型糖尿病全年龄段发病率为1.01/10 万人,由于人们的不重视及生活习惯差等因素,近几年发病率呈逐年递增的趋势[2]。目前,临床上针对I 型糖尿病的治疗方案主要有胰岛移植、基因治疗及外源性补充胰岛素,但需要患者长期坚持以及良好的生活习惯[3]。白茅苷是白芷根的活性成分之一,具有除湿止痛、消肿排脓、抗炎症、抗肿瘤等功效[4]。有研究报道,白茅苷已被用于高血压、心血管及急性肝损伤等疾病中[5-7]。但白茅苷在I型糖尿病中的研究鲜见报道,因此,本研究通过建立链脲佐菌素(streptozotocin,STZ)诱导的I型糖尿病幼鼠模型,探讨白茅苷对I型糖尿病幼鼠肝损伤、过氧化应激和免疫反应的影响,为白茅苷的临床应用提供理论依据。
1 材料与方法
1.1 药物、试剂和仪器
白茅苷(纯度≥98%)购自上海源叶生物科技有限公司(货号B20929),链脲佐菌素购自(纯度≥98%)购自北京索莱宝科技有限公司(货号S8050),HE 染色试剂盒、TUNEL 试剂盒和ELISA 试剂盒均购自北京索莱宝科技有限公司,超氧化物歧化酶(SOD)和丙二醛试剂盒购自上海碧云天生物技术公司,BCA蛋白浓度测定试剂盒和ECL化学发光试剂购自美国Sigma 公司,兔单克隆抗体及HRP 标记的对应二抗均购自美国Abcam 公司,酶标仪(Rayto,RT6100),台式高速离心机(大龙,D3024R,最大离心力21 380×g),成像系统(上海天能科技公司,Tanon-1600R),光学显微镜(日本尼康,Nikon Eclipse E100)。全自动生化分析仪(日本HITACH,7600)。
1.2 动物分组、建模及给药
无特殊病原菌(SPF)级BALB/c雄性幼龄鼠(1~2 周龄,体质量15~20 g)购自北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2016-0008,使用许可证号SYXK(京)2017-0022,健康状况良好,实验动物使用过程中严格遵守3R 原则,并通过河西学院动物实验中心伦理委员会审核批准。动物饲养条件:每只幼鼠给予24 h昼夜灯光照射控制及严格、规范的卡片登记管理,24 ℃条件下封闭群养。建模:参照文献[8]建立I型糖尿病幼鼠模型,健康对照组幼鼠进行正常喂食饮水,模型组和模型加药组禁食不禁水,12 h 后模型组进行腹腔注射60 mg/kg 的链脲佐菌素诱导I 型糖尿病幼鼠模型,幼鼠出现多饮、多食、多尿等症状时表明造模成功,造模成功后,模型加药组幼鼠参照文献[9]分别灌胃给药3、6 和12 mg/kg 的白茅苷,72 h 后测定空腹血糖、血清胰岛素、肥胖指数,采用全自动生化分析仪测量血脂四项,处死小鼠,收集肝脏组织和主动脉血进行后续实验。
1.3 HE染色观察肝损伤
取幼鼠肝组织,用40 g/L 多聚甲醛固定幼鼠肝组织,石蜡包埋切片,经乙醇脱水,二甲苯透明,石蜡包埋后,二甲苯脱蜡,行HE 染色,脱水透明并封片后,在光镜下观察拍照并记录组织学形态变化。
1.4 TUNEL染色观察细胞凋亡
取各组幼鼠肝组织,用40 g/L 多聚甲醛固定,石蜡切片脱蜡至水,经组织修复、阻断内源性过氧化物酶和室温平衡后,加入反应液按TUNEL 试剂盒说明书进行染色。细胞核被染成蓝色或蓝紫色,阳性细胞被染成棕黄色或褐色。
1.5 Western blot 检测线粒体损伤标记蛋白表达水平
取各组幼鼠肝组织,预冷的PBS 洗涤2~3 次,然后用手术剪成小块并置于匀浆研磨仪中研磨,研磨均匀后用RIPA 蛋白裂解液于冰上提取总蛋白,12 000 r/min(离心机半径为84.993 mm)离心15 min取上清,用BCA 蛋白浓度测定试剂盒测定组织蛋白浓度,每孔上样15~20 µg,经SDS-PAGE 凝胶电泳、转膜、脱脂奶粉封闭后,加入一抗(1:500),4℃摇床孵育过夜,回收一抗并加入HRP 标记的对应二抗(1:4 000),室温孵育2 h。采用ECL 化学发光试剂于暗室下曝光显影。将胶片进行扫描存档,经PS 整理去色,Alpha 软件分析光密度值,计算各组幼鼠中Bax、Bcl-2、caspase-3 和c-Myc 蛋白相对表达量(内参ACTIN),结果以目标条带与内参比值表示,独立进行试验3次,最终结果取平均值。
1.6 ELISA检测炎症因子水平
收集各组幼鼠主动脉血,3 000 r/min(r=84.993 mm)4 ℃条件下离心10 min,取血清样本,按ELISA试剂盒操作说明书进行检测各组幼鼠血清中SOD、MDA、IL-6、TNF-α和IL-1β的含量水平。
1.7 统计学分析
使用SPSS17.0和GraphPad Prism6.0软件分析,符合正态分布的计量资料表示为均数±标准差(xˉ±s)。多组数据比较采用单因素方差分析,方差分析有统计学意义时,两两比较采用Sidak 法,以P<0.05为组间差异有统计学意义。
2 结果
2.1 白茅苷对I 型糖尿病幼龄鼠血清胰岛素和血糖水平的影响
采用糖耐量实验(OGTT)检测各组小鼠血糖和空腹血清胰岛素水平,并测量各组小鼠肥胖指数,经单因素方差分析,五组间肥胖指数、空腹血清胰岛素水平(µU/L)和空腹血糖水平(mmol/L)差异具有统计学意义(F=47.262、94.570、119.696,P=0.000、0.000、0.000),采用Sidak 法进一步作两两比较,发现模型组与3 mg/kg 白茅苷组比较差异无统计学意义(P=0.997、1.000、0.999),而与6 mg/kg 白茅苷组比较差异具有统计学意义(P=0.000、0.000、0.000),与12 mg/kg 白茅苷组比较差异具有统计学意义(P=0.000、0.000、0.000;图1)。

图1 小鼠肥胖指数、空腹血清胰岛素和血糖指标Fig.1 Obesity index,fasting serum insulin and fasting glucose in mice
2.2 白茅苷对I型糖尿病幼龄鼠血脂水平的影响
自动生化分析仪检测各组小鼠血清中总胆固醇(TC,mmol/L)、甘油三酯(TG,mmol/L)、高密度脂蛋白(HDL,mmol/L)、低密度脂蛋白(LDL,mmol/L)水平,经单因素方差分析,五组间TC、TG、LDL、HDL 水平差异具有统计学意义(F=95.474、27.156、42.704、153.816,P=0.000、0.000、0.000、0.000),采用Sidak 法进一步作两两比较,发现模型组与3 mg/kg 白茅苷组比较差异无统计学意义(P=1.000、1.000、1.000、0.989),而与6 mg/kg 白茅苷组比较差异具有统计学意义(P=0.000、0.007、0.000、0.000),与12 mg/kg白茅苷组比较差异具有统计学意义(P=0.000、0.000、0.000、0.000,图2)。

图2 血脂四项检测Fig.2 Four items of blood lipid tests
2.3 白茅苷对I型糖尿病幼龄鼠肝损伤的影响
HE 染色观测I 型糖尿病小鼠肝损伤程度。健康对照组小鼠肝组织形态正常,排列规则,无炎性浸润等病变情况。模型组小鼠肝组织紊乱,无完整肝小叶结构,肝细胞胞质疏松、弥漫性水肿,汇管区可见炎性细胞浸润和纤维组织增生。低剂量组(3 mg/kg白茅苷组)小鼠肝组织结构紊乱,可见少量正常的肝小叶结构,仍然可见大量炎性细胞浸润。中高剂量组(6 和12 mg/kg 白茅苷组)小鼠肝组织结构趋于正常,肝小叶结构排列规则,汇管区未见炎性细胞浸润,肝细胞索以中央静脉为中心呈辐射状排列(图3)。
2.4 白茅苷对I型糖尿病幼龄鼠肝细胞凋亡的影响
TUNEL 染色观测各组小鼠肝细胞凋亡情况。健康对照组小鼠肝组织中未见凋亡细胞,肝组织结构正常。模型组小鼠肝组织中可见大量凋亡细胞,组织结构紊乱。低剂量组(3 mg/kg 白茅苷组)小鼠肝组织中仍可见大量凋亡细胞,组结构紊乱。中高剂量组(6和12 mg/kg白茅苷组)小鼠肝细胞凋亡数目明显减少,组织结构趋于正常(图4)。

图3 肝组织病理染色图Fig.3 Pathological staining image of liver tissue
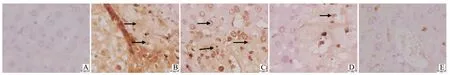
图4 肝组织凋亡染色图Fig.4 Staining image of liver tissue apoptosis
2.5 白茅苷对I 型糖尿病幼龄鼠血清中氧化应激指标的影响
SOD 和MDA 试剂盒检测各组小鼠血清中SOD(U/mL)和MDA(mmol/mL)含量水平,经单因素方差分析,五组间SOD 和MDA 含量差异具有统计学意义(F=26.216、24.309,P=0.000、0.000),采用Sidak法进一步作两两比较,发现模型组与3 mg/kg白茅苷组比较差异无统计学意义(P=1.000、1.000),而与6 mg/kg白茅苷组比较差异具有统计学意义(P=0.068、0.022),与12 mg/kg 白茅苷组比较差异具有统计学意义(P=0.001、0.001;图5)。

图5 SOD、MDA含量水平Fig.5 SOD and MDA content levels
2.6 白茅苷对I型糖尿病幼龄鼠线粒体损伤的影响
Western blot 检测各组小鼠线粒体中Bax/Bcl-2、caspase-3 和c-Myc 蛋白表达水平,经单因素方差分析,五组间Bax/Bcl-2、caspase-3、c-Myc 差异具有统计学意义(F=255.894、42.415、159.547,P=0.000、0.000、0.000),采用Sidak 法进一步作两两比较,发现模型组与3 mg/kg 白茅苷组间差异无统计学意义(P=0.991、0.998、1.000),而与6 mg/kg 白茅苷组比较差异具有统计学意义(P=0.000、0.000、0.000),与12 mg/kg 白茅苷组比较差异具有统计学意义(P=0.000、0.000、0.000;图6)。
2.7 白茅苷对I 型糖尿病幼龄鼠血清中炎症因子水平的影响
ELISA 检测各组小鼠血清中IL-6(pg/mL)、TNF-α(pg/mL)和IL-1β(pg/mL)含量水平,经单因素方差分析,五组间IL-6(F=15.893,P=0.000)、TNF-α(F=48.912,P=0.000)、IL-1β(F=25.166,P=0.000)含量差异具有统计学意义,采用Sidak 法进一步作两两比较,发现模型组与3 mg/kg 白茅苷组比较差异无统计学意义(P=1.000、1.000、1.000),而与6 mg/kg 白茅苷组比较差异具有统计学意义(P=0.017、0.007、0.003),与12 mg/kg 白茅苷组比较差异具有统计学意义(P=0.007、0.000、0.001;图7)。

图6 Bax/Bcl-2、cleaved cas3/cas3和c-Myc蛋白表达水平Fig.6 Bax/Bcl-2,cleaved cas3/cas3 and c-Myc protein expression levels
3 讨论

图7 IL-6、TNF-α和IL-1β含量水平Fig.7 Content levels of IL-6,TNF-α and IL-1β
I型糖尿病是自身异常免疫应答破坏胰岛B 细胞,从而引起的一种自身免疫代谢性疾病,胰岛B细胞的损伤与多种免疫细胞和炎症因子有关,如T淋巴细胞、肿瘤坏死因子-α(TNF-α)、白介素(IL)等[10-12]。STZ 是一种天然的化学物质,能特异性的破坏分泌胰岛素的胰岛B 细胞,由于其诱导的I 型糖尿病动物模型临床表现与人的组织病理表现极为相似,且导致I 型糖尿病产生自身免疫反应及氧化应激等,因此,STZ 诱导的I型糖尿病动物模型常被用于实验研究[13]。本研究利用STZ诱导I型糖尿病动物模型,观测白茅苷对I 型糖尿病模型幼鼠肝损伤、过氧化应激及免疫应答的影响,结果发现,白茅苷能够缓解STZ诱导的I型糖尿病模型幼鼠肝损伤,降低过氧化应激反应,调控免疫应答等。
本研究结果显示,经白茅苷给药治疗后,I型糖尿病幼鼠肥胖指数、空腹血糖、空腹血清胰岛素和血脂四项水平均明显降低,结果提示,白茅苷在I型糖尿病幼鼠胰岛功能中具有调节作用,为明确白茅苷调节I 型糖尿病胰岛功能的作用机制,我们还检测了幼鼠肝损伤、细胞凋亡、过氧化应激指标和炎症因子的水平。
I 型糖尿病发生时,由于胰岛素分泌不足或相对缺乏会使肝脏脂代谢紊乱,严重时发生酮症酸中毒,引起肝脏肿大,脂肪组织浸润,最终导致肝组织功能损伤[14]。因此,增加I 型糖尿病患者体内胰岛素分泌的同时,还应防止肝功能受损。本研究结果显示,白茅苷显著改善I 型糖尿病幼鼠肝组织病理损伤,抑制肝细胞凋亡,结果进一步提示白茅苷在I型糖尿病幼鼠胰岛功能和肝功能中的具有调控作用。
氧化应激也是胰岛B 细胞受损的重要因素之一,超氧化物歧化酶(SOD)是氧自由基清除酶,能够清除细胞内过氧化产物保护细胞免受氧化和过氧化产物的损害[15]。丙二醛(MDA)是脂质过氧化产物,机体内大量产生或积累MDA 会破坏细胞膜结构,并导致细胞代谢紊乱,从而影响细胞正常功能[16]。研究发现,STZ 诱导的I 型糖尿病小鼠SOD水平均有明显降低,MDA明显增高,且MDA和SOD含量能间接的反应细胞损伤程度和氧化应激反应[17]。本研究结果显示,经白茅苷给药治疗后,STZ 诱导的I 型糖尿病幼鼠SOD 含量明显增高,MDA 含量明显降低。结果提示,白茅苷通过调节I型糖尿病幼鼠氧化应激水平缓解幼鼠胰岛功能和肝功能损伤。
线粒体是机体有氧代谢和能量转换的主要场所,与I型和Ⅱ型糖尿病发病机制密切相关。I型糖尿病发生时,机体内胰岛素分泌异常导致细胞能量代谢紊乱,引起线粒体通透性转换(MPT)孔开放,使线粒体中促凋亡蛋白的大量释放并最终导致细胞死亡[18]。Bax/Bcl-2、caspase-3 和c-Myc 是线粒体损伤标志物,同时也是凋亡标记蛋白。Bax/Bcl-2和caspase-3高表达预示线粒体功能损伤严重,凋亡细胞增多[19]。而c-Myc 则与之相反,在I 型糖尿病幼鼠中,c-Myc 能够激活分泌胰岛素的胰岛素基因转录表达[20]。本研究结果显示,经白茅苷给药治疗后,I 型糖尿病幼鼠线粒体中Bax/Bcl-2 和caspase-3 蛋白表达明显降低,c-Myc 表达增高,结果提示,白茅苷对I 型糖尿病幼鼠线粒体功能也具有调节作用。
前文提到I型糖尿病是由于机体自身异常免疫反应导致胰岛B 细胞受损的代谢性疾病,因此,检测I型糖尿病幼鼠免疫反应调节因子水平能够间接明确幼鼠胰岛功能,而白细胞介素6(IL-6)、TNF-α和白介素-1β(IL-1β)是重要的炎症和免疫调控因子。研究表明,在I型糖尿病发生过程中,巨噬细胞通过释放IFN-γ 激活并释放IL-6、IL-1β 和TNF-α等,导致胰岛B 细胞损伤甚至死亡[21-22]。研究结果发现,经白茅苷给药治疗后,I 型糖尿病幼鼠IL-6、TNF-α 和IL-1β 含量均有明显降低,结果提示,白茅苷通过调节I型糖尿病幼鼠免疫炎症因子水平缓解幼鼠因过度免疫反应引起的胰岛功能损伤。
综上所述,白茅苷在STZ 诱导的I 型糖尿病幼鼠肝功能、胰岛功能和线粒体功能中具有调节作用,其机制与降低幼鼠肝细胞凋亡、过氧化应激反应和免疫反应有关。
