一站式CTP对预测急性脑梗死患者预后的评估价值
2021-04-14谢炎钊谢定祥杨旭峰陈红兵
韦 丹 ,赵 静,党 超,谢炎钊,谢定祥,杨旭峰,陈红兵,江 利
(1.惠州市中大惠亚医院医学影像科,广东惠州 516081;2.中山大学附属第一医院医学影像科,广东广州 510080;3.中山大学附属第一医院神经内科,广东广州 510080;4.广东省中医院珠海医院放射科,广东珠海 519015)
急性缺血性脑梗死(acute ischemic stroke,AIS)是临床常见的威胁人类生命和健康的脑血管病,随着人口老龄化趋势的加快,其发病率逐年增加,给家庭和社会造成了沉重的负担[1]。为了对个体患者做出合理的预测、提供合理的治疗方案以及帮助患者和家属理解疾病病程,临床医生有必要了解影响预后的重要因素。如何通过影像学评价并预测AIS 预后一直是研究的热点。对于AIS 患者,首先需要应用非增强CT(non-contrast CT,NCCT)排除颅脑出血,基于NCCT 的Alberta Stroke Program Early CT Score(ASPECTS)评分也广泛适用于临床来评价和预测AIS 预后[2]。随着CT 灌注成像(CT perfusion imaging,CTP),CT 血管造影(CT angiography,CTA)和一站式CTP 技术(NCCTCTA-CTP)的问世,CT 在急性脑卒中的实用性已有所增强。与单用NCCT 评估相比,联合3 种技术(NCCT、CTA 和CTP)的一站式CTP 评估检测急性梗死的能力增强[3-6]。此外,包括CTA 和CTP 的多模式评估可评估血管闭塞的位置、梗死核心、可挽救的脑组织及侧枝循环的程度[7-8]。研究认为就评估AIS 而言,头颅CT 联合CTP 的效用可能与MRI相当[9],而在实践中,MRI 相对于CT 更容易因患者禁忌证或不耐受而受限。然而,鲜有研究探讨定量的一站式CTP 与AIS 患者预后的关系,定量一站式CTP参数能否反映AIS患者的预后尚不得而知。因此,在这项研究中,我们根据AIS 患者不同的临床预后分组,分析一站式CTP灌注参数与临床预后的相关性。
1 材料与方法
1.1 一般资料
收集2016 年1 月至2019 年5 月连续收治的发病时间<24 h,并愿意接受重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator,rt-PA)进行溶栓、抗凝或血管腔内治疗的急性脑梗死患者113 例。本研究得到中山大学附属第一医院伦理委员会批准,所有接受检查患者均由本人或法定代表人签署知情同意书。纳入标准:①18 岁≤年龄≤80 岁;②发病时间≤24 h 的临床疑诊急性脑卒中患者;③完成颅脑一站式CTP 检查;④基线病史采集(由神经科医师完成):症状或体征出现的时间、持续的时间,若于睡眠中起病,应以最后表现正常的时间作为起病时间;其他包括神经症状发生及进展特征;血管及心脏病危险因素,感染、创伤、肿瘤及妊娠史等;一般体格检查与神经系统检查;进行治疗前后美国国立卫生研究院卒中量表the National Institutes of Health Stroke Scale(NIHSS)评分。⑤由临床医师决定下一步的临床决策:rtPA 静脉溶栓和/或抗凝治疗和/或血管腔内治疗。记录相关临床信息,包括:治疗决策/方法,溶栓时间、剂量;⑥首诊5~7 d 时进行临床及影像复查。排除标准:①CT 平扫确诊脑出血患者(n=23);②CT 增强造影剂禁忌症(n=3);③有过大面积陈旧脑梗死/或出血软化灶,病灶容积≥20 mL(n=11);④临床资料不全(n=37)。
所有AIS 患者均在确诊后4.5~6 h 内进行溶栓(n=11),抗凝(n=20)或血管腔内介入(n=8)治疗;首诊5~7 d 对AIS 患者行临床和影像学复查(CT:n=18 或MRI:n=21),记录当时的NIHSS 评分。以复查时CT 或MRI T2WI 上病变范围作为最终病变大小。首诊90 d,电话随诊获取患者的Modified Rankin Scale(mRS)评分,mRS 评分越高表明预后越差,90 d 后mRS 评分≤2 分表明远期预后良好,90 d后mRS评分>3分表明远期预后不良[10]。
1.2 一站式CTP检查
采用东芝320 排640 层螺旋CT(Aquilion ONE,Toshiba Medical Systems)。首先,CT 平扫排除颅脑出血,扫描参数:120 kV,300 mAs,0.5 mm层厚容积扫描,10 mm 层厚重建。如无颅脑出血,则进行动态容积全脑CTA-CTP 检查:在肘静脉埋置18 G 静脉留置针,采用双通道高压注射器,根据患者体质量的不同,以5 mL/s 注入40 mL 非离子对比剂(碘普罗胺,370 mgI/mL,拜耳,德国)后续以30 mL 生理盐水冲管;扫描参数:80 kV,150 mAs,层厚0.5 mm,延迟7 s 开始扫描,11~34 s 为动脉期扫描,间隔时间为2 s,37~60 s为静脉期扫描,间隔时间为5 s,扫描总时间60 s,覆盖范围16 cm,平均有效剂量:5.25 mSv。
1.3 一站式CTP图像后处理和灌注参数分析
由两名经验丰富的神经影像诊断医师对平扫CT 图像行ASPECTS 评分(层厚10 mm)[2],两者评分不一致时由20 年工作经验的神经影像诊断医师做出决定。
采用佳能后处理工作站灌注软件(Vital Images VES Client 6.9.2,Vital Images,Minnetonka,MN)对动态容积灌注图像行后处理。手动选择输入动脉和输出静脉,选择健侧大脑中动脉为输入动脉,上矢状窦或直窦为输出静脉,由分析软件自动获得感兴趣区的时间-密度曲线,利用SVD+去卷积算法生成灌注参数图。包括脑血容量(cerebral blood volume,CBV)、脑血流量(cerebral blood flow,CBF)、平均通过时间(mean transit time,MTT)、达峰时间(time to peak,TTP)及延迟达峰时间(delay time to peak,Delay-TTP)。每个灌注参数图由320 幅层厚为0.5 mm的图像组成。
根据双侧大脑半球的TTP和CBV差异,后处理自动生成梗死核心区标记为红色(CBV较对侧正常脑实质下降大于41%)和缺血半暗带标记为黄色(TTP 较对侧正常脑实质延长大于6.8 s)。分别记录梗死核心区和缺血半暗带体积及其比值。
在灌注图像上手动绘制感兴趣区(region of interest:ROI),尽量避开大血管,分别放置大小相仿的3 个(大小:直径约1 cm)ROI 于梗死核心区(红色)、缺血半暗带(黄色)及镜像对侧正常脑实质区域(绿色),取各参数平均值进行统计,并计算病侧与健侧比值。以上结果均由两名经验丰富的神经影像诊断医师采用盲法独立完成测量(图1)。
1.4 统计学方法
根据AIS 患者90 d mRS 评分,将患者分为两组。分析临床及CTP 参数同治疗后90 d mRS 评分之间的相关性,比较两组间临床及CTP灌注参数差异,分析临床及CTP 参数同治疗后90 d mRS 评分之间的相关性。数据分析采用SPSS 20.0 统计软件,其中性别变量为定性资料,采用卡方检验,其余纳入的临床和CTP参数均为定量资料,首先对数据进行正态性检验,如数据符合正态分布则行两独立样本的t检验和Pearson 相关;如若不符合正态性分布,则行Mann-whitneyUtest 检验和Spearman 秩相关检验,均为双侧检验;进一步通过ROC 分析各临床和灌注参数的诊断效能,并计算其敏感度、特异度和拐点值。P<0.05认为存在统计学差异。
2 结果
2.1 患者基本资料
最终入组AIS 患者39 例,其中男性21 例,女性18 例,年龄23~75 岁,平均(65±12)岁。根据AIS患者90 d mRS评分,将患者分为两组,A组:mRS评分≤2(n=20),B 组:mRS 评分>3(n=19),两组AIS患者的详细临床和影像资料详见表1、2。其中CTA发现颈内动脉闭塞8例、重度狭窄2例;大脑中动脉闭塞13 例、重度狭窄5 例;大脑后动脉重度狭窄1例;椎动脉闭塞3 例;合并两支及以上颈部血管、脑血管闭塞4 例,其中颈内动脉合并大脑中动脉闭塞2 例。其中,5 例患者合并无症状脑动脉瘤,分为位于大脑中动脉(n=2),大脑后动脉(n=1)和椎动脉(n=2),并未对上述动脉瘤行急诊腔内介入治疗。
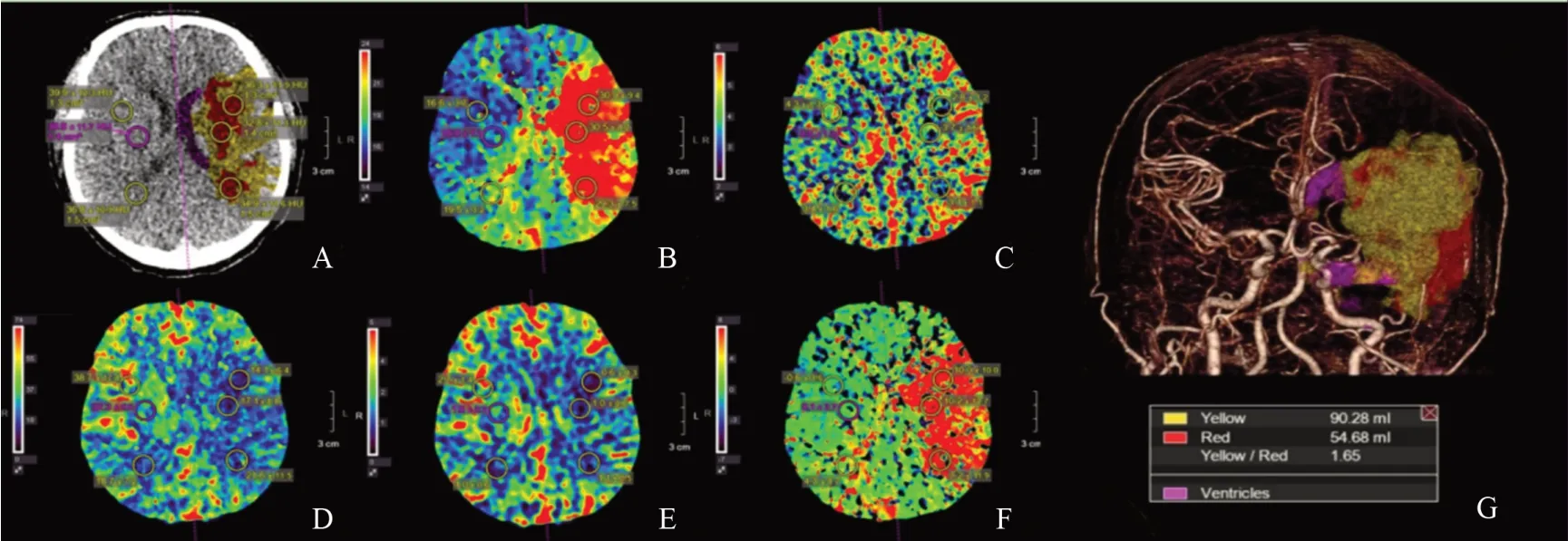
图1 急性脑梗死CTP后处理参数图Fig.1 Parameters map of CTP after acute cerebral infarction
表1 不同预后的两组患者一般临床资料比较Table 1 General clinical data of two groups with different prognosis [,M(P25~P75)]

表1 不同预后的两组患者一般临床资料比较Table 1 General clinical data of two groups with different prognosis [,M(P25~P75)]
Pre-NIHSS:NIHSS score before treatment;Later-NIHSS:NIHSS score after treatment;mRS at 90 days:mRS score after 90 days;Pre-ASPECTS:ASPECT score before treatment;Later-ASPECTS:ASPECTS score after treatment.
2.2 定量CTP灌注参数与AIS患者预后的相关性
数据不满足正态性和方差齐性,Spearman秩相关分析发现,治疗前后NIHSS 评分、梗死核心区体积、缺血半暗带MTT及相应区域Delay-TTP 与随访90 d mRS评分成明显正相关(P≤0.04);而梗死核心区CBF 值和治疗后ASPECTS 评分与90 d mRS 评分成明显负相关(P<0.05)。其余各临床指标和灌注参数与90 d mRS评分不存在明显相关性。
2.3 临床和一站式CTP灌注定量参数的单因素分析
数据不满足正态性和方差齐性,Mann-whitneyUtest 两组对比分析发现,临床和一站式CTP 灌注定量参数可以预测AIS 患者预后。在所有的临床和CTP 灌注参数中,治疗前后NIHSS 评分、治疗后ASPECTS 评分、梗死核心区体积及梗死核心CBF值在组间差异有统计学意义(P≤0.03)。其中,预后较好组(A组)较预后较差组(B组)具有较低的治疗前后NIHSS 评分平均值(治疗前A 组3.00 分,B 组10.00 分;治疗后A 组2.00 分,B 组13.00 分)及较低的梗死核心体积(A 组6.80 mL,B 组35.99 mL);然而,A 组的梗死核心区CBF 值(A 组每100 g 脑组织内每分钟的血流17.30 mL,B组每100 g脑组织内每分钟的血流14.10 mL)和复查ASPECTS 评分(A 组8.00 分,B 组4.00 分)明显高于B 组(表1,图2、3)。ROC 分析显示治疗后NIHSS 评分对于预测AIS 患者预后有着最高的诊断效能[AUC:0.90,AUC95%CI:(0.891,1.000)],其中敏感度、特异度及拐点值分别为79%,85%和4.5;而梗死核心区CBF 具有最佳的特异度(89%),治疗后ASPECTS评分在预测预后方面具有最高的敏感度(94%;图4)。
表2 不同预后的两组患者一站式CTP参数比较Table 2 CT perfusion parameters of two groups with different prognosis [,M(P25~P75)]

表2 不同预后的两组患者一站式CTP参数比较Table 2 CT perfusion parameters of two groups with different prognosis [,M(P25~P75)]
CBF%:CTF ratio of lesion side to contralateral side;CBV%:CBV ratio of lesion side to contralateral side;MTT%:MTT ratio of lesion side to contralateral side;TTP%:TTP ratio of lesion side to contralateral side.
3 讨论
脑梗死是由脑缺血部位血液供应障碍引起的缺血、缺氧从而导致脑组织缺血性坏死,其发病的主要原因包括动脉粥样硬化、血栓或异物阻塞血管,使血管狭窄,血流量减少。本研究纳入39 例AIS患者,通过分析其临床和一站式CTP影像,发现梗死核心区体积、梗死核心区CBF值、治疗前后NIHSS 评分及治疗后ASPECTS 评分与患者的预后密切相关。其中,单因素和多因素分析显示治疗后NIHSS 评分对于预测急性脑梗死患者预后有着最高的诊断效能,而梗死核心区CBF具有最佳的特异度(89%),治疗后ASPECTS评分在预测预后方面具有最高的敏感度(94%)。
在很多调查研究和越来越多的临床实践中,采用NIHSS 评分来定量评估神经功能障碍。若干研究已证实NIHSS 评分是脑梗死结局的良好预测指标[11]。这与本文的研究结论相一致,认为治疗前后NIHSS 评分均可以预测急性脑梗死的预后;但是以治疗后5~7 d 的NIHSS 评分预测价值最高,认为当NIHSS 评分>4.5 时预后可能不佳;这与Sumer[12]等研究相仿,他们认为NIHSS 评分≤6 预示恢复良好,而评分≥16时发生死亡或严重失能的可能性高。

图2 急性脑梗死治疗后预后不良病例Fig.2 The case with poor prognosis after treatment of acute cerebral infarction
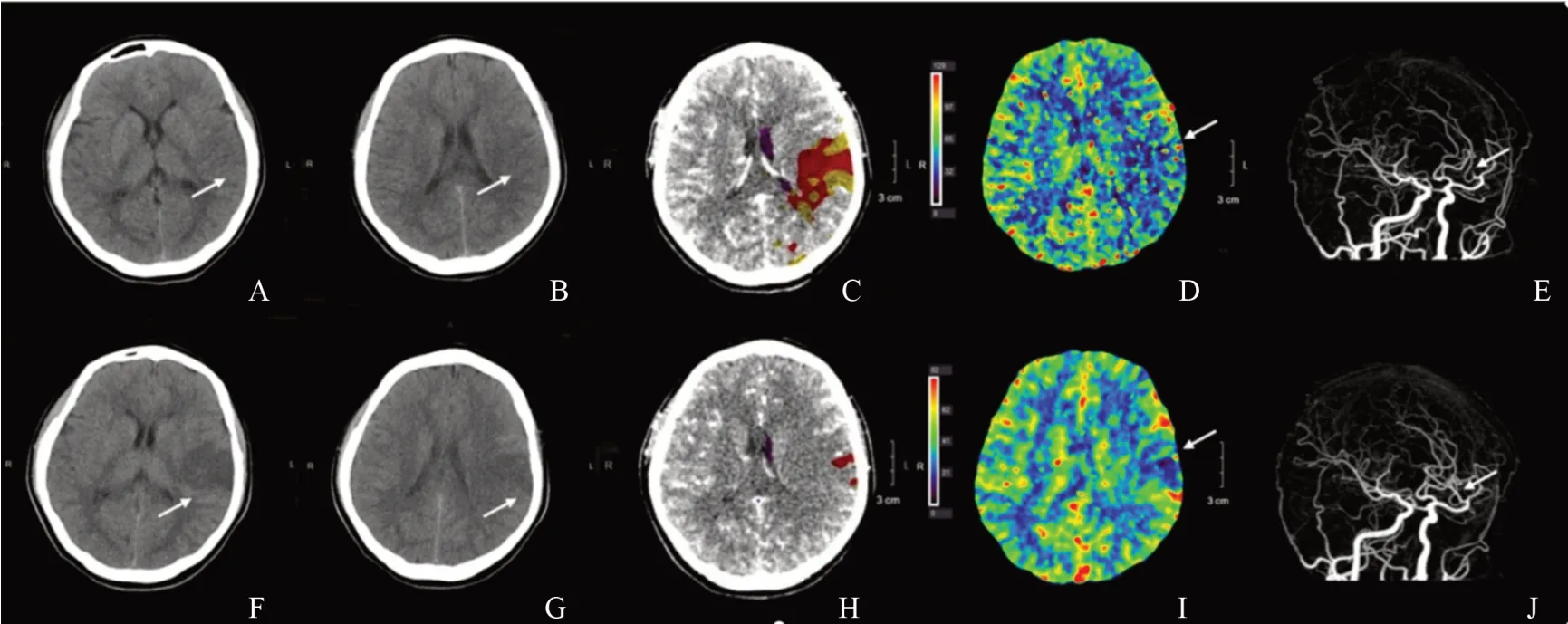
图3 急性脑梗死治疗后预后良好病例Fig.3 The case with good prognosis after treatment of acute cerebral infarction
ASPECTS 评分有着良好的观察者本身和观察者间信度,也常常用来预测AIS 的预后,早在2000年Barber[2]的研究表明通过ASPECTS 评分可以预测AIS 患者的功能结局有着较高的敏感性和特异性,这与我们研究的结论相仿。但是,现有数据显示对NCCT 结果进行ASPECT 分析不能鉴别出可能通过溶栓治疗获益的患者[13-14],这可能是因为,NCCT 上低密度影并不完全代表不可逆脑梗死,与NCCT 相比,分析CTA 和CTP 的源图像进行ASPECT 评分可以更好地确定最终梗死体积[15],更好地预测患者预后。此外,ASPECT 评分并不适用于腔隙性脑梗死或大脑中动脉分布区外的脑梗死,进一步局限了ASPECT评分的临床应用。
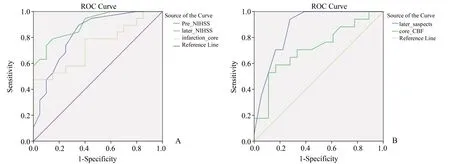
图4 梗死核心体积、CBF值及结合临床特征预测急性脑梗死患者预后的ROC曲线Fig.4 ROC curve of Core infarct volume,CBF and clinical characteristics for predicting prognosis of patients with acute cerebral infarction
通过分析CTP灌注参数,本研究发现相比较预后较差的AIS 患者,预后较好的AIS 患者有着较小的梗死核心区体积和较低的CBF 值。这与Vogt[16]和Schiemanck[17]的研究结果相仿。近年来,血管腔内治疗开始逐渐应用于临床,血管腔内治疗可以将急性脑梗死患者的治疗时间窗延长至24 h。Lansberg[18]的研究表明CTP 可以用来预测筛选能通过血管介入治疗获益的患者。另外两个临床随机对照研究[19-20]表明,小的梗死核心与AIS 患者的预后明确相关。进一步,Jelle 研究[21]表明与ASPECT 评分相比,急性脑梗死梗死核心区体积更能反映AIS患者的预后。然而,本研究发现多因素分析发现梗死核心的体积,梗死核心区CBF值用来预测急性脑梗死的预后价值有限。Rüdigerv[22]认为当CBF 值低于15 mL/100 g·min 时,脑组织将发生不可逆损伤;而本文发现AIS 患者预后较差组的平均CBF 值均低于上述该阈值。这一研究结果支持本研究中单因素分析中CBF 可以用来预测AIS 患者,然而本研究较少的样本量,或许会对研究结果产生偏倚,本研究结果尚需更大样本量的证实。
本文的研究局限性有以下几点:病例数较少,未双盲、随机分组对统计分析会产生一定的影响。影响脑梗死结局的其他重要影响因素包括梗死部位、缺血性脑卒中的机制、共存疾病、流行病学因素及脑卒中并发症,本文因为病例数较少,并没有涉及该方面讨论。此外,本文多因素分析发现纳入治疗后NIHSS 评分和年龄,同AIS 患者预后最相关,而CBF 和梗死核心区体积同AIS 的预后尚不具有明确相关性。这也恰恰说明了急性脑梗死预后相关的影响因素很多。但是,预测AIS 患者预后,通过研究手段去选择合理的治疗人群,一站式CTP可以作为一个很好的方法提供更多有价值的信息。
AIS 患者梗死核心区体积、CBF、治疗前后NIHSS 及治疗后ASPECTS 评分与患者的预后密切相关。相比较NIHSS评分,梗死核心区体积及CBF对于预测急性脑梗死预后有着更高的特异度。
致谢:感谢高振华教授在统计学和论文撰写方面给予的指导。感谢广东省卒中学会的支持。
