后腹腔镜下供肾切取自体肾移植术治疗复杂性肾血管源性高血压
2021-04-12刘高磊童大力文亚渊
刘高磊,张 尧,童大力,张 军,文亚渊,江 军
(陆军军医大学大坪医院:1.泌尿外科;2.心血管外科,重庆 400042)
复杂肾血管源性高血压是继发性顽固性高血压的常见病因之一,由肾动脉病变引起,并且修补病变血管或肾切除可缓解[1]。肾动脉狭窄和肾动脉瘤是导致肾血管源性高血压和肾功能损害的主要原因[1-2]。动脉粥样硬化、先天性纤维发育不良、创伤、多发大动脉炎等疾病常引起肾动脉狭窄和肾动脉瘤[2-4]。目前治疗方式主要包括药物、血管腔内成形术(percutaneoustransluminal angioplasty,PTA)和手术等[5-6]。然而,手术主要适用于药物难以控制的高血压以及治疗依从性差、肾动脉狭窄进展或PTA失败的患者。由于手术的复杂性、潜在的并发症,以及微创手术技术的发展,使得包括肾切除、旁路手术在内的传统手术方式逐渐被淘汰[7-9]。目前自体肾移植术作为一种替代治疗方式,应用于肾动脉瘤或PTA失败的继发难治性高血压的国内报道较少。我们回顾性分析大坪医院收治的行后腹腔镜下供肾切取自体肾移植术并进行了长期随访的2例肾血管源性高血压患者资料,现报告如下。
1 病例报告
1.1 临床资料病例1,男性,26岁,因严重难治性高血压10年就诊我院,入院前于当地医院行PTA确诊左肾动脉狭窄,行球囊血管成形与支架植入术但未成功。应用多种降压药物,血压仍难以控制。入院时测血压170/120 mmHg(1 mmHg=0.133 kPa),术前PTA和肾动脉CT血管造影(computed tomography angiography,CTA)提示左肾动脉开口处可见1个1 cm长狭窄节段(图1A、C);肾动脉超声提示左肾动脉起始段收缩期峰值流速升高(Vmax=141 cm/s,正常范围 60~120 cm/s),而动脉阻力指数(resistent index,RI)正常(RI=0.59,正常范围0.55~0.70)(图1B);左肾周亦可见多处迂曲血管分支(图1C),对侧肾动脉未见明显异常。双侧肾上腺未见明显占位。
病例2,女性,19岁,因体检发现高血压2年入院,血压波动在150~160/95~110 mmHg(1 mmHg=0.133 kPa)。肾CTA和PTA提示左肾动脉多发动脉瘤伴多节段肾动脉狭窄(最高狭窄程度达80%)。双侧肾上腺未见明显异常。
2例患者相关检查结果详见表1。
1.2 手术方法麻醉后患者先行右侧折刀位,采用后腹腔镜方式完全游离出肾脏,尽可能游离出较长的肾动静脉暂不阻断,游离尽可能长的输尿管并切断,然后取左下腹Gibson切口,腔镜下先后离断尽可能长的肾动静脉,迅速从Gibson切口取出肾脏放入冰水中,并用4 ℃ 威斯康星大学溶液(University of Wisconsin solution,UVsolution)肾脏保存液灌注直至肾脏颜色变白后修肾。与此同时,取平卧位,并沿原Gibison切口游离出髂外动静脉血管以备吻合。病例1,切除1 cm长的肾动脉狭窄段,检查其他节段无异常以备移植。病例2,切除多发动脉瘤及狭窄段后,剩余肾动脉主干长度<1 cm,于是我们选取5 cm长自身大隐静脉用以血管重建。2例患者均通过原Gibson切口移植至同侧髂窝,其中左肾动脉间断吻合至髂外动脉,左肾静脉连续吻合至左髂外静脉,输尿管吻合至膀胱左顶部。

表1 2例患者临床基本资料
2 结 果
手术过程顺利,肾热缺血时间3 min,恢复血流后尿液从输尿管残端流出。病例1术后6个月血压降至正常,且随着时间推移,降压药物种类及剂量逐渐减少,18个月后无需降压药物。病例2手术 6个月后无需药物控制血压(表2)。术后1年2例患者移植肾大小、形态及肾功能正常,动脉瘤无复发,肾血管及输尿管吻合口无狭窄。患者手术前后影像学资料见图1、图2。
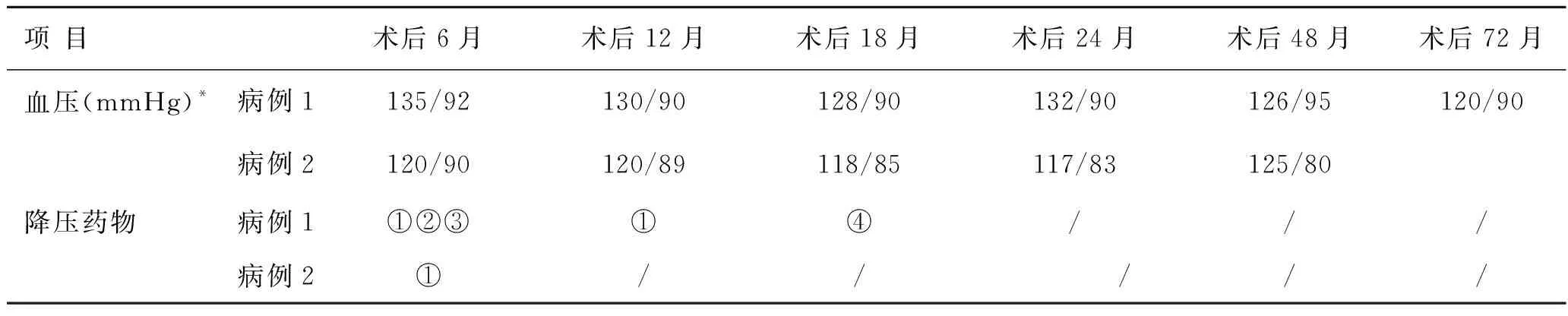
表2 术后血压及降压药物随访资料

A:术前血管造影检查(红色箭头:狭窄段);B:术前左肾动脉超声;C:术前左肾动脉CT血管造影(CTA)(红色箭头:狭窄段);D:术后移植肾CTA。
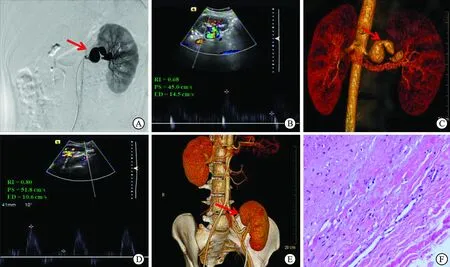
A:术前血管造影(红色箭头:狭窄段及动脉瘤);B:术前左肾动脉;C:术前左肾动脉三维重建(红色箭头:狭窄段);D:术后移植肾肾动脉超声;E:术后移植肾动脉CT血管造影(CTA);F:术后病理(HE,×200)
3 讨 论
自体肾移植术主要应用于复杂肾血管疾病,包括直径>2 cm肾动脉瘤、肾内血管栓塞、肾动脉瘤导致的严重肾动脉狭窄以及孕妇;另外,肌纤维发育不良、大动脉炎及动脉粥样硬化导致的肾动脉狭窄,也是其重要适应证[9-10]。除此之外,自体肾移植也适用于药物难以控制的高血压、依从性差、难以原位肾血管重建或PTA失败的患者[11]。国外SEVMIS等[12]报道了5例由于肾动脉狭窄和肾动脉瘤导致的肾血管源性高血压患者,接受自体肾移植术后血压和血肌酐明显改善,初步证明了自体肾移植治疗复杂肾血管病变的有效性和安全性。国内外许多学者对自体肾移植应用于肾血管疾病的研究结果也进一步验证了其有效性和安全性[13-15]。本研究中,病例1左肾动脉狭窄段位于起始段,肾周见蔓状血管丛,既往行PTA治疗失败;病例2左肾动脉多发动脉瘤及多节段狭窄,介入治疗以及肾动脉原位修复重建难以实施。原位肾血管重建要求高,空间小、视野差、手术时间和热缺血时间长,并且可能出现吻合口瘘和狭窄,假性动脉瘤和临近脏器副损伤等并发症,因此,我们选择行后腹腔镜供肾切取自体肾移植术。病例1术后血压降至正常,且随着时间推移,降压药物种类及剂量逐渐减少,术后18月停用降压药物。病例2术后6月无需药物控制血压。术后12~18月随访中,2例患者血压逐渐恢复正常,且无需药物控制,也无动脉瘤复发,供肾功能未见受损。继续随访48~72月,2例患者血压自行维持正常范围。
如果肾动脉病变节段较长,将其切除后残存的肾动脉较短,则需使用血管移植物进行血管重建。目前常见的血管移植物主要包括大隐静脉、髂内动脉、股浅动脉、桡动脉、脾动脉或卵巢血管等[16-18]。尽管血管重建方式有许多选择,作为外科医生仍需评估移植物获取及移植后的潜在并发症,包括再狭窄、血管源性高血压、动脉瘤等[9]。多项研究表明,大隐静脉具有较低的术后破裂风险和动脉瘤发生率,已被广泛应用于血管移植,具有安全、有效、可行等特性[19-20]。因大隐静脉的厚度和直径与肾动脉相似,并且容易获取,可作为肾动脉血管的良好替代品。在病例2中,由于该患者肾动脉合并多发动脉瘤及多节段狭窄,切除病变后,残存肾动脉较短,我们利用自体大隐静脉进行了肾动脉重建。在术后1年的随访中,复查肾动脉CTA及血管彩超,未见移植肾动脉狭窄、破裂及动脉瘤复发,表明大隐静脉作为血管移植物应用于肾动脉重建中安全、可行,这与以往的报道一致[19]。
近年来,腹腔镜下供肾切取方式得到广泛应用,我院自2004年便将腹腔镜应用于活体供肾切除术[21]。腹腔镜下供肾切取具有视野清晰、处理肾相关血管精准、肠道干扰小等优点,此外延长腹部取肾切口进行自体肾移植避免了腰部巨大切口,大幅降低了手术创伤,减少了患者痛苦,利于患者快速康复。该术式主要难点在供肾切取时保护供肾、保留足够长度血管、降低热缺血时间及血管重建技术等[22]。本研究也展现了一种微创的手术方式,即先采用后腹腔镜方式切肾,联合开放方式行自体肾移植。
原位肾移植主要适用于双侧髂血管严重粥样硬化、下腔静脉血栓、多次肾移植、膀胱有病变而行尿流改道等患者,并且其效果与移植髂窝相似[17,23-25]。原位肾移植保留了上尿路引流,避免了膀胱输尿管返流、无膀胱输尿管吻合口瘘和狭窄等并发症;且患者恢复后,自体移植肾位于腹膜后,位置深在不易受伤,在生理上或心理上更接近于正常人[18]。除此之外,原位肾移植动脉重新吻合在主动脉,不易发生动脉粥样硬化;单次手术切口方便肾切除和自体移植[26]。一般认为,髂窝肾移植能密切监测排斥反应,方便切除移植肾,手术操作简便易行。但是,由于原位移植切口深,暴露较为困难,手术操作难度极大,势必导致手术操作时间和延长,且移植过程中难以保证较短冷缺血时间,因此自体肾移植通常移植到同侧髂窝。本研究中,2例患者年轻、无糖尿病、大动脉炎、动脉粥样硬化和高血脂等合并症,双侧髂血管条件好,并且我们中心长期开展肾脏髂窝移植,技术成熟,因此我们选择移植至同侧髂窝。用手将供肾从Gibson切口取出,并利用同一切口将肾脏移植至同侧髂窝处,与传统方式相比,腰部无大切口,创伤小且美观,术后恢复快。
本研究局限性在于所选择的术式要求医师具有丰富的腹腔镜手术和器官移植经验、样本量较小等;然而,鉴于该疾病的发病率相对较低,很难招募大量患者,未来进行多中心研究具有重要意义。尽管如此,初步经验表明,对于复杂性肾血管源性高血压,该术式安全有效。当患者无法行PTA或药物难以控制血压时,尤其是年轻的难治性肾血管源性高血压患者,该术式可作为首选治疗方法,疗效确切。
