保健酒急性毒性和亚急性毒性实验研究
2021-04-11蒋中仁
郭 艳,王 睿,蒋中仁
(四川省疾病预防控制中心,四川成都 610041)
保健酒在我国有深厚的文化传统和群众基础,由中药材泡制的保健酒尤其受到消费者欢迎。某牌保健酒以传统中药材黄芪、大枣、枸杞子、茯苓、制何首乌、三七、熟地黄、黄精为主要原料,经浸渍、渗漉后与白酒(60 %vol)配制,再经陈化、冷藏、过滤等工艺制成。黄芪、制何首乌、三七、熟地黄属于可用于保健食品的物品名单,大枣、枸杞子、茯苓、黄精属于“既是食品又是药品的物品名单”。现代药理学研究结果表明,某品牌保健酒配方中原料含有丰富的有效成分,具有多种生物活性(见表1)[1-15]。黄芪、大枣、枸杞子、茯苓、三七、黄精等具有补中益气之效;制何首乌也是补益药材,同时也含有具有体外肝细胞毒性的没食子酸和大黄素[16]。对此保健酒进行急性毒性和亚急性毒性研究,为科学评价其食用安全性提供了试验依据。
1 材料与方法
1.1 材料、试剂及仪器
受试物:某公司研发生产的某品牌保健酒,其功效成分粗多糖含量15 mg/100 g,总皂苷含量10 mg/100 g,人体推荐量为100 mL/60 kg·BW,试验样品为其23倍浓缩液,酒精度0%vol。用60%vol基酒和蒸馏水配制受试物溶液,冷藏保存。

表1 某品牌保健酒原料的主要有效成分和生物活性
动物:由四川省中医药科学院实验动物中心提供的SPF 级KM 小鼠、SD 大鼠,生产许可证号SCXK(川)2013-19;由四川省医学科学院四川省人民医院实验动物研究所提供的饲料,生产许可证号SCXK(川)2015-01;四川省疾病预防控制中心屏障级实验动物房,温度20~25 ℃,相对湿度40%~70%,使用许可证号SYXK(川)2016-043。
仪器设备:奥林巴斯AU-400 全自动生化分析仪、XT-2000i 型全自动血细胞分析仪、OLYMPUSBH-2 型显微镜、超净工作台、METTLER 电子天平、解剖器械。
1.2 试验方法[17]
1.2.1 大鼠、小鼠急性经口毒性试验
采用最大耐受剂量法,大鼠、小鼠分别随机分成2 组,共4 组,每组同系同性10 只动物。设15000 mg/kg·BW 1 个剂量组,1 次经口灌胃,观察1周内动物中毒表现和死亡情况,试验结束后称体重,处死动物作大体解剖。
1.2.1 30 d喂养试验
设3个剂量组1.81 mL/kg·BW、3.62 mL/kg·BW、7.25 mL/kg·BW(分别相当于人体推荐摄入量的25倍、50 倍、100 倍)、蒸馏水对照组、15 %vol 基酒对照组,采用灌胃法,首次染毒后观察30 d。
1.3 统计分析
使用SPSS 17.0 for Windows 软件统计处理数据,30 d喂养试验数据使用方差分析。
2 结果与分析
2.1 大鼠、小鼠急性经口毒性试验
给予受试物后,大鼠、小鼠未见异常,观察期内未见死亡(见表2),试验结束时处死动物,大体解剖肉眼未见异常。实验保健酒对大、小鼠急性经口MTD 值均大于15000 mg/kg·BW,按急性毒性分级属无毒级。
2.2 30 d喂养试验
试验期间动物健康状况良好,体重持续增长,每组大鼠每天经口喂饲不同剂量的受试物后均未出现中毒表现,未见动物死亡。
2.2.1 保健酒对大鼠体重的影响
15 %vol 基酒对照组雌、雄大鼠的初始体重、1~4 周体重、第30 天体重与阴性对照组比较均无统计学意义(P>0.05);3 个剂量组雌、雄大鼠的初始体重、1~4 周体重、第30 天体重与15 %vol 基酒对照组比较均无统计学意义(P>0.05)(见表3)。
2.2.2 保健酒对大鼠每周进食量的影响
15 %vol 基酒对照组雌、雄大鼠的每周进食量与阴性对照组比较均无显著性差异(P>0.05);3 个剂量组雌、雄大鼠的每周进食量与15%vol 基酒对照组比较均无显著性差异(P>0.05)(见表4)。
2.2.3 保健酒对大鼠食物利用率的影响
15 %vol 基酒对照组雌、雄大鼠的每周食物利用率及总食物利用率与对照组比较无显著性差异(P>0.05);3 个剂量组雌、雄大鼠的每周食物利用率以及总食物利用率与15%vol 基酒对照组比较,各项指标均无显著性差异(P>0.05)(见表5)。
2.2.4 保健酒对大鼠血液学的影响
15 %vol 基酒对照组雌、雄大鼠的血液学常规检测结果与阴性对照组比较,除雌鼠的白细胞计数升高显著性差异外(P<0.05),其余各项指标均无显著性差异(P>0.05);3 个剂量组雌、雄大鼠的血液学常规检测结果与15%vol 基酒对照组比较,各项指标均无显著性差异(P>0.05)。以上所测值均在本室正常值范围内(见表6)。
2.2.5 保健酒对大鼠末期血生化的影响
15%vol 基酒对照组雌、雄大鼠的末期血生化指标检测结果与阴性对照组比较,除雌鼠的尿素氮和甘油三酯升高有显著性差异外(P<0.05,P<0.01),其他指标无显著性差异(P>0.05);3 个剂量组雌、雄大鼠的末期血生化指标检测结果与15%vol基酒对照组比较,各项指标均无显著性差异(P>0.05)。以上所测值均在本室正常值范围内(见表7)。
表2 某品牌保健酒对大鼠、小鼠急性经口毒性试验结果()

表2 某品牌保健酒对大鼠、小鼠急性经口毒性试验结果()
表3 某品牌保健酒对大鼠体重的影响()

表3 某品牌保健酒对大鼠体重的影响()
表4 某品牌保健酒对大鼠每周进食量的影响()
表5 某品牌保健酒对大鼠食物利用率的影响()
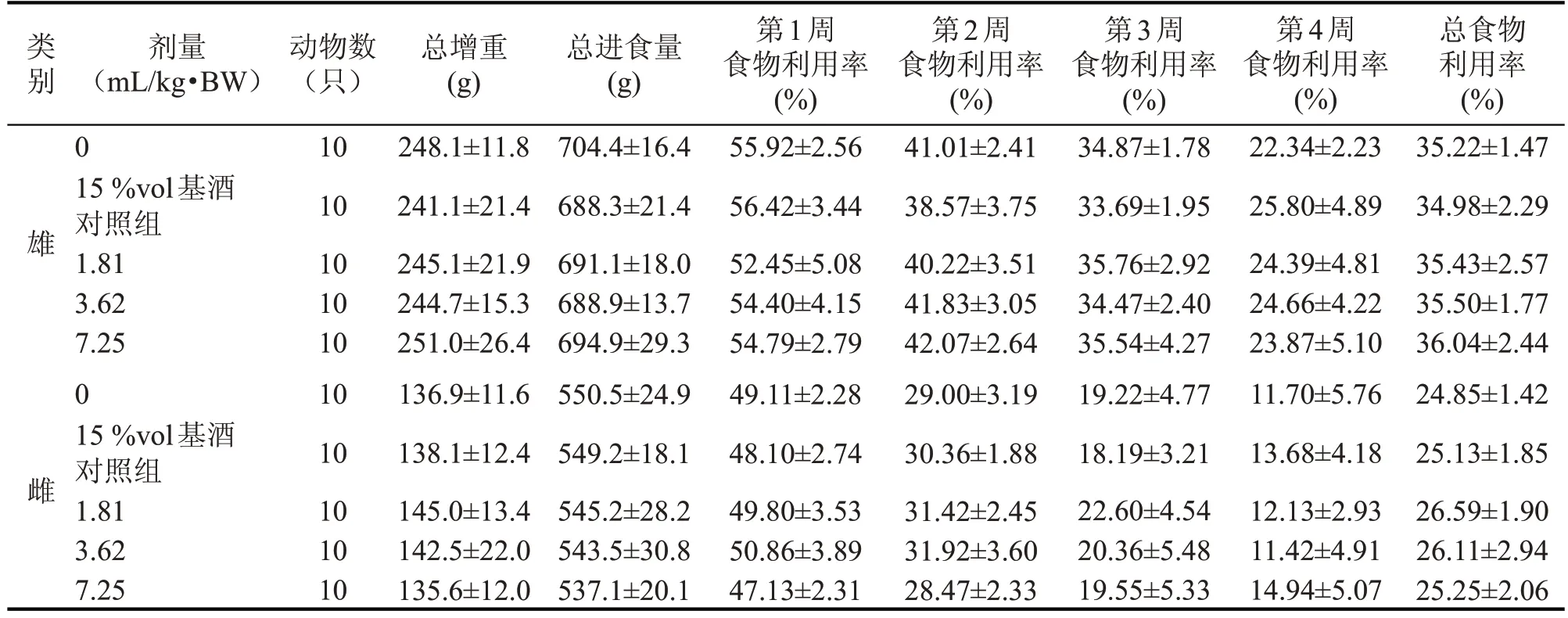
表5 某品牌保健酒对大鼠食物利用率的影响()
表6 某品牌保健酒对大鼠血液学指标的影响()
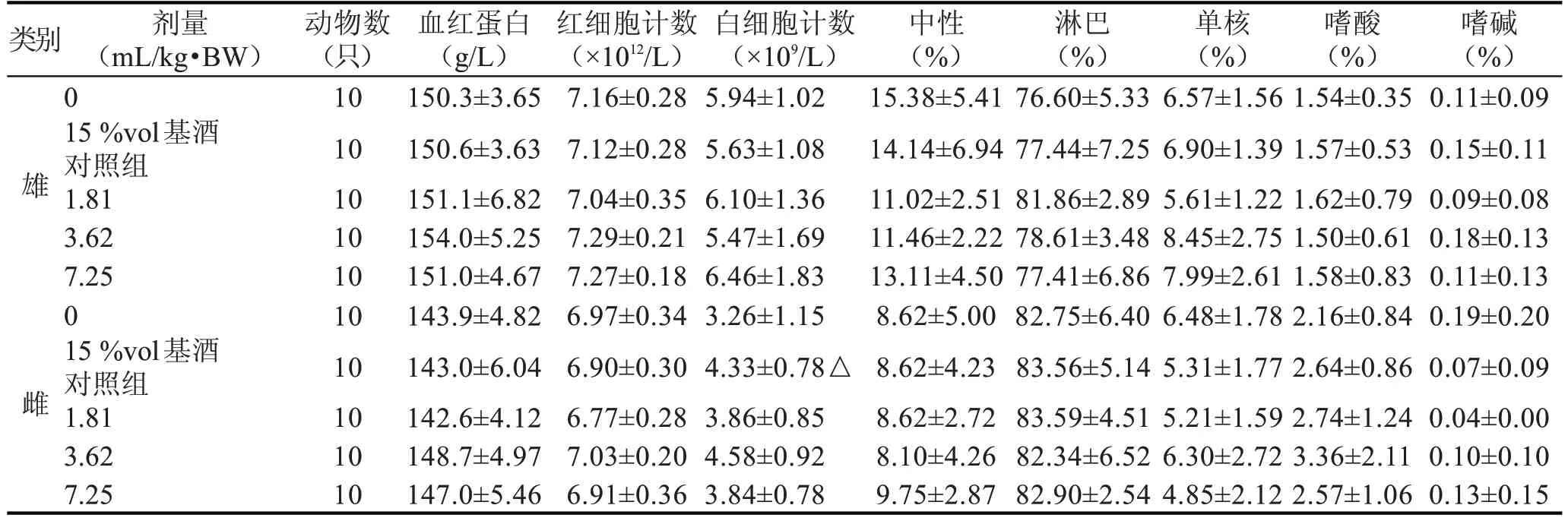
表6 某品牌保健酒对大鼠血液学指标的影响()
注:△表示与阴性对照组比较P<0.05。
表7 某品牌保健酒对大鼠末期生化检验结果()

表7 某品牌保健酒对大鼠末期生化检验结果()
注:与阴性对照组比较△P<0.05,△△P<0.01。
表8 某牌保健酒对大鼠脏体比的影响()

表8 某牌保健酒对大鼠脏体比的影响()
2.2.6 保健酒对大鼠脏体比的影响
15 %vol 基酒对照组雌、雄大鼠的脏体比值与阴性对照组比较均无显著性差异(P>0.05)。3 个剂量组雌、雄大鼠的脏体比值与15%vol 基酒对照组比较,经统计学处理,各项指标均无显著性差异(P>0.05)(见表8)。
2.2.7 病理学检查
试验结束后处死动物,进行大体解剖,肉眼未见异常改变。组织病理学检查结果显示:蒸馏水对照组有1 例动物肾组织局灶性肾小管轻度扩张;15%vol 基酒对照组有1 例动物肝组织汇管区局灶性轻度炎细胞浸润;受试物高剂量组有肾组织局灶性肾小管轻度扩张;其余受检组织形态结构正常。以上所发现均为动物自发病变,未见受试物高剂量组引起动物中毒性损伤改变。
3 讨论
实验结果显示,某品牌保健酒对大、小鼠急性经口毒性试验结果MTD 值均>15000 mg/kg·BW。30 d 喂养试验,可见动物生长发育及活动正常,未见动物出现中毒症状及死亡。15%vol 基酒对照组的动物体重、每周进食量、每周食物利用率及总食物利用率、脏体比值、血液学常规检测及末期血生化指标检验结果与蒸馏水对照组比较,雌鼠的白细胞计数、尿素氮和甘油三酯均升高有显著性差异(P<0.05,P<0.05,P<0.01),其他各项指标无显著性差异(P>0.05)。3 个剂量组雌、雄大鼠的每周体重、每周进食量、每周食物利用率、总食物利用率、脏体比值、血液学指标及末期血生化指标检测结果与15%vol 基酒对照组比较,各项指标均无显著性差异(P>0.05)。以上所测值均在本室正常值范围内。组织病理学检查结果,除动物自发病变外,未见受试物高剂量组引起动物中毒性损伤改变。由此可见,在本试验条件下,某品牌保健酒按急性毒性分级属无毒级,且无亚急性摄入危害。可在此基础上针对长期饮用某品牌保健酒的安全性进行进一步研究,并开展功能学试验,将其开发成保健食品,以满足消费者需求。
