核转录因子NFAT5对LPS致伤小鼠肾集合管细胞iMCD3的影响
2021-04-09张丹凤严尚学王德光
张丹凤, 严尚学, 王德光
近年来抗生素的应用以及支持治疗手段在不断改善,脓毒症(Sepsis)的发病率依然逐年递增,成为重大公共健康问题。据美国NIH统计,每年脓毒症发病人数在百万以上,并造成20万人死亡。肾脏是脓毒症最常受损器官之一。大约50%脓毒症休克患者会并发急性肾功能衰竭。目前脓毒症导致急性肾损伤(acute kidney injury, AKI)的发病机制尚不明确,更没有很好的对策。激活T细胞核因子5 (nuclear factor of activated T cells 5,NFAT5) 是核转录因子,与NF-κB同属于Rel-like结构体家族,最早发现该因子对高渗透压引起的损害具有保护作用,近年来大量研究表明NFAT5与炎症的发病机制有关,NFAT5参与介导高盐敏感性高血压、类风湿关节炎、冠状动脉粥样硬化糖尿病微血管病变(肾病及视网膜病变)疾病的炎症反应。Küper et al近期研究表明在脓毒症小鼠中NFAT5通过调控集合管细胞中Aqua2和CIC-2的转录和合成,降低尿渗透压。目前尚无研究阐明NFAT5在脓毒症并发急性肾损害炎症瀑布效应产生过程中的作用及是否参与介导肾小管细胞炎症因子的产生。该实验通过研究NFAT5在脂多糖(lipopolysaccharide, LPS)刺激的小鼠肾小管细胞iMCD3中炎症的调节作用,探讨NFAT5是否可以成为治疗败血症并发急性肾损害的新靶点。
1 材料与方法
1.1 材料
1.1.1
实验细胞 小鼠肾集合管细胞iMCD3购自美国ATCC细胞库。1.1.2
实验试剂与仪器 DMEM培养基购自introvigen公司(德国),反转录试剂盒购自Promega公司(德国),NFAT5抗体和Beta actin抗体均购自Santa cruz公司(美国),histone3 抗体购自Enzo life science公司,Lipofectamine 2000购自Invitrogen公司(美国),NFAT5 siRNA和Control siRNA 购自Santa Cruz公司(美国),ElISA试剂盒购自R&D systems公司(美国),Premix taqman引物购自Thermo Scientific公司(美国),染色质免疫共沉淀试剂盒(SimpleChIP® Plus Sonication Chromatin IP Kit)购自Cell signaling公司(德国)。1.2 方法
1.2.1
细胞培养 小鼠肾集合管细胞iMCD3细胞培养液,在含5% FBS、1%青霉素和1%链霉素的DMEM培养液于37 ℃、5% CO条件下培养。细胞状态良好并处于对数期时,进行实验处理,每组重复3个孔。1.2.2
实验分组 iMCD3细胞用终浓度分别为150 mmol/L NaCl高渗组(阳性对照组),0 ng/ml和10 ng/ml LPS 记为对照组和实验组,共刺激12 h。分别用NFAT5 siRNA和 scramble siRNA转染细胞,分别使用上述三组条件再次刺激细胞共12 h。1.2.3
细胞siRNA转染 将iMCD3细胞置于12孔细胞培养板中,每孔加入无双抗的DMEM培养基,将适量的Lipofectamine 2000和NFAT5 siRNA 分别加入DMEM培养液中,室温下静置5 min,将两者合并混合,静置20 min,使其充分结合。将混合液体以8字回旋法加入培养孔中,轻轻摇晃,放入37 ℃培养箱中。12 h后更换新的细胞培养液,24 h后提取细胞进行Western blot检验,鉴别转染效果。1.2.4
Western blot检测iMCD3细胞核内NFAT5蛋白的表达 将iMCD3细胞收集以后,在细胞中添加PBS洗涤2次,分裂液A液(100 mmol/L HEPES, pH 7.9, 1 mmol/L KCl, 1 mmol/L MgCl,0.5 mmol/L EDTA,100 mmol/L DTT和200 mmol/L PMSF)孵育15 min,高速离心后弃上层溶液(即细胞质蛋白溶液),分离液B液反复吹打离心沉渣后冰上振荡30 min,高速离心后留存溶液即为细胞核溶液。用Comoosine方法进行定量检测后,每孔取20 μg蛋白,并同1/5体积的loading buffer混合,上样至SDS-PAGE胶的孔中,以200 V电压电泳50 min后,使用Trans-Blot Turbo TM transfer system机器中的“半干转”程序转膜30 min。将PVDF膜放在新鲜5% 牛奶TBST溶液中室温振荡1 h。将抗NFAT5抗体以1 ∶200稀释,将PVDF膜放在稀释的Ⅰ抗反应液中,置于摇床上反应过夜。将Ⅱ抗按照1 ∶2 000稀释后,将PVDF膜放置于其中,在室温中孵育2 h。以ECL法发光以后,扫描图像。Histone3为内参照。1.2.5
qRT-PCR 检测iMCD3细胞内NFAT5、TNFα以及MCP-1 mRNA表达 在iMCD3细胞中添加TRIzol裂解液,提取细胞中总RNA。以总RNA作为模板,合成cDNA,体系包括1.0 μl MultiScrie TM Reverse Transcriptase、2 μl random primer(×10)、0.8 μl 25×dNTP Mix(100 mmol/L)、1 μl sample RNA、2 μl RT buffer(×10)和1.0 μl RNase inhibitor,添加R Nase free HO 至10 μl,每个孔内加入10 μl RT master mix(×2),按照 37 ℃、120 min, 85 ℃、5 min, 4℃、5 min 进行逆转录。 qPCR 的反应体系为0.5 μl TaqMan® Gene Expression Assay(×20)、10 μl TaqMan® Gene Expression Master Mix(×2)、cDNA template 1 μl, 添加R Nase free HO 至20 μl。 使用ABI StepOneTM plus one 机器进行扩增,扩增条件为50 ℃、2 min,95 ℃、10 min,95 ℃、 15 s, 60 ℃、1 min,共40个循环。内参照为 GAPDH,根据反应的 Ct 值计算 NFAT5的表达水平。1.2.6
细胞培养液中TNFα与MCP-1蛋白水平测定 采用双抗夹心酶联免疫吸附(ELISA)法,具体操作步骤按试剂盒说明书逐步进行。1.2.7
染色质免疫共沉淀(ChIP) 在含有iMCD3细胞的T75培养瓶中加入最终浓度为1%的甲醛浓度,37 ℃孵育10 min,加入甘氨酸(终浓度0.125 mol/L)终止交联,室温孵育5 min。4 ℃ PBS清洗细胞2次。细胞刮刀收集细胞于15 ml离心管中,离心后收集细胞。倒去上清液,加入SDS Lysis Buffer(100 μl每106个细胞)。进行超声破碎(Bioruptorr®Plus)共30个循环 (30 s 冲击,30 s间隙)。每100 μl的超声破碎产物中,加入900 μl ChIP Dilution Buffer和20 μl的PIC(×50),再各加入60 μl ProteinA Agarose。 4 ℃颠转混匀1 h,静置10 min后离心1 min。取上清液。各取20 μl作为input,一管中加入1 μl NFAT5抗体,另一管则不加抗体。4 ℃颠倒过夜。第二天各管中加入60 μl ProteinA Agarose,4 ℃颠转2 h,静置10 min后离心(700 r/min)离心1 min,除去上清液。分别用低浓度NaCl缓冲液、高浓度NaCl缓冲液、LiCl缓冲液进行洗涤。清洗完后进行洗脱,室温下颠转15 min,静置离心,收集上清液。添加750 μl DNA binding buffer 到每份DNA样品中,转移450 μl到收集管中的DNA离心柱上,14 000 r/min离心30 s,收集离心柱,重复以上步骤。加入750 μl DNA wash buffer至收集管的离心柱上,14 000 r/min离心30 s,保留离心柱,加入50 μl DNA Elution Buffer到离心柱上,放在1.5 ml的EP管中,14 000 r/min离心30 s,洗脱物为纯化的DNA。通过SYBR-Green PCR法扩增DNA片段,引物设计如图4A。使用input样品百分数法计算IP效率。
2 结果
2.1 核转录因子NFAT5在内毒素(LPS)刺激的肾小管细胞核中的蛋白和mRNA表达水平
不同浓度内毒素(LPS)(10 ng/ml和1、5 μg/ml)、高渗NaCl溶液(500 mOsm)和细胞培养液刺激肾小管细胞12 h作为实验组、阳性对照组和阴性对照组,使用Western blot方法测量NFAT5在细胞核中的蛋白表达水平,使用RT-PCR方法测量NFAT5 mRNA表达水平,如图1所示,高渗NaCl溶液(500 mOsm)可导致NFAT5发生核转位,在细胞核中表达增高,不同浓度内毒素(LPS)和对照组均不能导致NFAT5发生核转位,在细胞核中无表达增加。如图2A显示,阳性对照组高渗NaCl溶液(500 mOsm)可导致NFAT5 mRNA表达水平增高,内毒素(LPS)和对照组均不能导致NFAT5 mRNA表达水平增加。
图1 Western blot检测NaCl和LPS分别刺激肾iMCD3细胞NFAT5蛋白表达水平
2.2 TNFɑ和MCP-1在内毒素(LPS)刺激的肾小管细胞表达水平
内毒素(LPS)(10 ng/ml)和细胞培养液刺激肾小管细胞12 h作为实验组和阴性对照组,使用RT-PCR方法和ELISA方法分别测量TNFα和MCP-1 mRNA水平和在细胞培养液中的蛋白水平。如图2B所示,内毒素 (LPS) 可导致肾小管细胞中TNFα和MCP-1 mRNA水平表达增加,释放到培养液中的TNFα和MCP-1蛋白增加。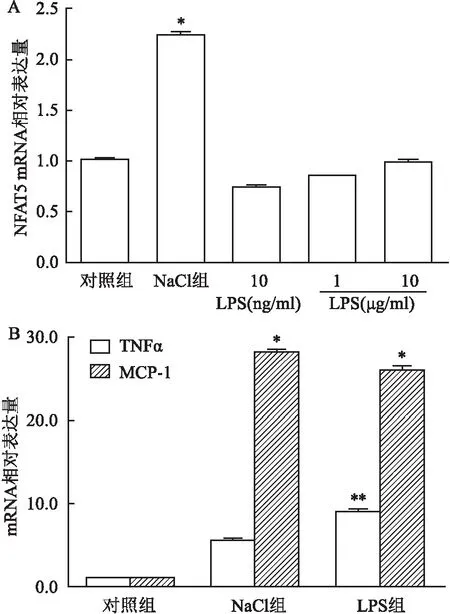
图2 qRT-PCR 检测mRNA表达水平A: NaCl(500 mOsm)和LPS(10 ng/ml、1 μg/ml及10 μg/ml)分别刺激肾iMCD3细胞,NFAT5 mRNA的表达; B: NaCl(500 mOsm)和LPS(10 ng/ml)分别刺激肾iMCD3细胞,TNFα 和MCP-1 mRNA的表达,与对照组比较:*P<0.05
2.3 TNFɑ和MCP-1在内毒素(LPS)刺激的NFAT5敲除的肾小管细胞表达水平
内毒素(LPS)(10 ng/ml)刺激被NFAT5 siRNA和Scramble RNA转录的肾小管细胞12 h作为实验组和阴性对照组,使用qRT-PCR方法和ELISA方法分别测量TNFα和MCP-1 mRNA水平和在细胞培养液中的蛋白水平。如图3所示,使用NFAT5 siRNA相较于scramble RNA转录肾小管细胞,细胞中NFAT5 mRNA表达水平降低,差异有统计学意义(P
<0.05),提示敲除细胞中NFAT5基因表达成功。然后用LPS刺激两组细胞12 h,相较于对照组,NFAT5 siRNA 转录细胞中TNFα和MCP-1 mRNA水平表达降低,与对照组比较,差异有统计学意义(P
<0.05)。释放到培养液中的TNFα和MCP-1蛋白水平降低,与对照组比较,提示NFAT5参与LPS导致肾小管细胞的炎症反应的调节。
图3 NFAT5 siRNA 转染肾集合管细胞iMCD3后 TNFα和MCP-1的蛋白及mRNA表达A: ElISA检测TNFɑ 蛋白表达;B:ElISA检测MCP-1蛋白表达; C:qRT-PCR检测NFAT5 mRNA相对表达水平;D:qRT PCR检测 TNFɑ mRNA相对表达水平;E:qRT PCR检测 MCP-1 mRNA相对表达水平;与对照组比较:*P<0.05
2.4 核转录因子NFAT5与内毒素(LPS)刺激的肾小管细胞产生的TNFα和MCP-1 mRNA启动子结合能力水平
内毒素(LPS)(10 ng/ml)刺激和无任何刺激肾小管细胞2、4 h分别作为实验组和对照组,使用染色质免疫共沉淀(ChIP)的方法分别测量NFAT5与TNFα和MCP-1 mRNA启动子片段结合的水平。如图4所示,实验组中,iMCD3细胞分别受到LPS(10 ng/ml)刺激2 h和4 h后,MCP-1和TNFα mRNA启动子中的DNA片段相对于IgG抗体存在富集倍数,提示脂多糖刺激的肾小管细胞的炎症反应是由核转录因子NFAT5通过结合MCP-1和TNFα mRNA启动子从而调控基因转录。
图4 染色质免疫共沉淀(ChIP)检测NFAT5与MCP-1和TNFα基因启动子结合位点的相互作用A:TNFα和MCP-1启动子片段的表达;B、C:ChIP分别测量LPS(10 ng/ml)刺激iMCD3 细胞2 h及4 h后NFAT5与TNFα和MCP-1 mRNA启动子片段的富集倍数
3 讨论
2016年第三版国际专家共识给出的关于脓毒症的定义为宿主对感染的反应失调而致的危及生命的器官功能障碍。相较于以往的专家共识,新定义强调器官功能障碍,其中肾脏是最易受到累及的器官,脓毒血症患者约一半以上的患者发生急性肾衰竭。虽然目前抗感染治疗及器官功能支持等技术得到很大的发展,但病死率仍居高不下,很大程度上与对AKI发病机制的理解不足有关。目前学说认为多种因素参与AKI发病机制,包括炎症瀑布效应、内皮细胞功能障碍、肾内血流动力学紊乱、肾小球微血栓形成及肾小管堵塞等。其中炎症瀑布效应的失衡是上述所有因素的起始和源头,是造成脓毒症肾损伤的重要分子机制。该研究围绕核转录因子NFAT5对于脓毒症肾损伤炎症调节作用的影响展开。
该研究采用LPS干预肾小管上皮细胞,建立脓毒血症肾脏损害体外模型,表现为肾小管上皮细胞表达和分泌细胞因子TNFα和化学趋化因子MCP-1增加。研究表明TNFα通过促进细胞凋亡、纤维蛋白形成及促血管收缩等机制在脓毒症进程中造成肾损害。临床试验表明使用TNFα抗体证实对脓毒症治疗有良好的疗效。MCP-1被认为脓毒症肾损害的出现特异性升高,通过NF-κB和AP-1升高IL-6和ICAM-1对机体造成损害。此外,该研究表明将NFAT5表达沉默后,LPS干预肾小管上皮细胞转录和合成TNFα、MCP-1减少,提示核因子NFAT5是调节脓毒血症肾损伤炎症瀑布效应的关键转录因子。在LPS刺激肾小管上皮细胞中,使用蛋白免疫印迹(Western blot)实验方法并没有探测到NFAT5表达增加,这与Western blot 该种实验方法的精度有关,无法精确测量刺激后转移到细胞核内少量的NFAT5,于是该实验进一步采用更敏感更精确的染色质免疫共沉淀方法,通过使用抗NFAT5的抗体分别沉淀NFAT5和TNFα、MCP-1启动子部分片段的蛋白-DNA复合物,直接精准的阐明了LPS刺激肾小管上皮细胞后,NFAT5进入细胞核内分别与TNFα、MCP-1启动子结合,开启TNFα和MCP-1 mRNA的转录,从而完成目的蛋白的翻译和合成,提示虽然少量的NFAT5参与了脓毒症肾损害的炎症调节功能,但是该分子调节是炎症瀑布效应重要的一环,因为其量少且难以用普通的实验室手段检测,从而导致NFAT5一直未被发现和关注,该实验抓住了NFAT5基因敲除后炎症因子表达减少这一现象,深入挖掘出NFAT5的功能和相关机制,是该实验的特色和亮点之一。
该研究的局限性在于仅仅在细胞层面阐述了脓毒症肾损害的相关分子机制,在接下来的研究中计划采用基因编辑技术敲除小鼠NFAT5,建立脓毒症的动物模型,进一步研究NFAT5在脓毒症急性肾损害病理生理机制中的作用。
