miR-483-5p在棕榈酸损伤的足细胞中的作用及机制
2021-04-09潘天荣
江 斓,钟 兴,潘天荣
糖尿病肾病(diabetic nephropathy, DN) 是糖尿病常见的并发症之一,大部分患者会发展为晚期肾病。尽管目前临床采用抗高血压等方法治疗DN患者,但其治疗效果不佳。DN发病机制的中心环节为足细胞损伤。因此,预防或改善足细胞损伤对延缓DN的进展具有重要意义。
miRNAs是具有高度保守性的单链非编码小RNA。近年来研究显示miRNAs与DN关系密切。最新的研究报道,miR-483-5p与糖尿病有关。基于此,该研究采用棕榈酸(palmitic acid, PA)模拟高脂环境处理小鼠肾足细胞,探讨miR-483-5p在棕榈酸诱导损伤的足细胞中的作用及潜在机制,为明确DN的机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1
细胞株 小鼠肾足细胞购自ATCC。1.1.2
主要试剂 PA(P0500,纯度≥99%)、小鼠重组干扰素-γ(407320)、0.25%胰蛋白酶(T4049)均购自美国Sigma公司;RMPI 1640培养基(31800)、CCK-8试剂(YZ-CK04)、RIPA buffer(P0013)、丙二醛(MDA;BC0025)、超氧化物歧化酶(SOD;BC0170)和BCA蛋白分析(PC0020)试剂盒均购自北京索莱宝生物科技有限公司;TRIzol(15596-026)、Lipofectamine3000(L3000015)、pcDNA3.1 vector(V79020)、pMIR-Report luciferase vector (AM5795)均购自美国Thermo Fisher Scientific公司;miR-483-5pinhibitor (miR20004782-1-5)、miRNA inhibitor阴性对照(iR2N0000001-1-5)、miR-483-5p mimic(miR10004782-1-5)、miRNA mimic阴性对照(miR1N0000001-1-5)均购自广州锐博生物技术有限公司;双荧光素酶报告测定系统(Promega,E1910) 购自北京普洛麦格生物技术有限公司;逆转录试剂盒PrimeScriptRT Master Mix(RR036A)、SYBR Premix Ex Taq II Kit(RR820A)均购自北京TaKaRa生物医学技术有限公司;12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE;P0012A)、PVDF膜(FFP28)、ECL kit(P0018FS)均购自上海碧云天生物技术有限公司;兔Cleaved Caspase-3 抗体(1/500,ab2302)、兔Nephrin抗体(1/1 000,ab216341)、鼠GAPDH抗体(1/500,ab8245)、山羊抗兔辣根过氧化物酶(HRP)偶联的二抗(1/5 000,ab205718,)、山羊抗鼠辣根过氧化物酶(HRP)偶联的二抗(1/5 000,ab205719)均购自上海艾博抗贸易有限公司;兔Podocin抗体(Santa,sc-22294)购自美国圣克鲁斯生物技术有限公司(Dallas, Texas)。1.1.3
仪器 MultiskanFC 酶标仪购自美国Thermo Fisher Scientific公司;C1000 ThermalCycler转录仪购自美国BIO RAD公司;ABI7500实时荧光定量PCR仪购自美国Applied Biosystems公司;Lumat LB 9507 luminometer购自德国Berthold Technologies公司。1.2 方法
1.2.1
细胞培养 小鼠肾足细胞加入含10%胎牛血清和10 U/ml小鼠重组干扰素-γ的RMPI 1640培养基,在37 ℃、5% CO的细胞培养箱中培养。1.2.2
细胞分组 ① 为确定棕榈酸对小鼠肾足细胞的最佳损伤浓度,使用梯度浓度棕榈酸(0、0.05、0.1、0.2、0.5、1 mmol/L)处理小鼠肾足细胞24 h。② 为探究miR-483-5p在小鼠肾足细胞损伤中的作用,将小鼠肾足细胞分为4组:control、PA、PA+NC、PA+miR-483-5p inhibitor。③ 为进一步探究miR-483-5p mimic和KLF2在小鼠肾足细胞损伤中的作用,将小鼠肾足细胞分为4组:control、PA+NC、PA+miR-483-5p mimic、PA+miR-483-5p mimic+KLF2。1.2.3
细胞转染 使用Lipofectamine3000试剂将miR-483-5p inhibitor、miRNA inhibitor control、miR-483-5p mimic、miRNA mimic control、KLF2过表达质粒和空载pcDNA3.1 vector按上述细胞分组转染到细胞中,转染48 h,通过qRT-PCR检测转染效率。1.2.4
荧光素酶质粒构建及报告基因检测 Starbase预测miR-483-5p靶基因。含有miR-483-5p预测靶点的KLF2 3′‐UTR mRNA和定点诱变的KLF23′‐UTR mRNA由RiboBio公司扩增并克隆到Report luciferase vector。分别对应KLF2-WT和KLF2-MUT。小鼠肾足细胞(1.5×10)接种于12孔板培养1 d,然后利用Lipofectamine 3000将转染50 nmol/L miR-483-5p mimic, miRNA mimic阴性对照和1 ng pMIR-KLF2-WT或KLF2-MUT,50 ng pRL-Tk-Renilla荧光素酶质粒转染进细胞。转染48 h,在Lumat LB 9507 luminometer上用双荧光素酶报告测定系统测定荧光活性。1.2.5
CCK-8 转染或未转染的小鼠肾足细胞以2.5×10个/ml浓度接种于96孔板。RMPI 1640培养基培养24 h后,使用棕榈酸处理小鼠肾足细胞24 h。随后加入10 μl CCK-8试剂孵育1 h,酶标仪测定450 nm处吸光度值并计算细胞活力。1.2.6
实时荧光定量PCR(qRT-PCR) 使用TRIzol 试剂分离细胞中的总RNA。以1 μg总RNA为原料,用PrimeScriptRT Master Mix及反转录仪合成cDNA。荧光定量聚合酶链反应利用SYBR Premix Ex Taq II Kit进行。扩增条件设置如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环。基因水平的表达用2表示。引物序列:KLF2-F,5′-ACCAAGAGCTCGCACCTAAA-3′和KLF2-R,5′-GTGGCACTGAAAGGGTCTGT-3′;GAPDH-F,5′-AGG TCGGTGTGAACGGATTTG-3′和GAPDH-R,5′-GGG GTCGTTGATGGCAACA-3′;miR-483-5p-F,5′-AAG ACGGGAGGAAAGAAGGGAG-3′和miR-483-5p-R,5′-GTGCAGGGTCCGAGGTATTC-3′;U6-F,5′-CTCG CTTCGGCAGCACA-3′和U6-R,5′-AACGCTTCACG AATTTGCGT-3′。U6和GAPDH分别作为miRNA和KLF2的内参。1.2.7
检测细胞凋亡 收集细胞,用1 ml 1×Binding Buffer重悬细胞(1×10个/ml)。向每100 μl的细胞悬液(1×10个)中加入5 μl Annexin V-FITC和 PI,室温避光孵育10 min后,尽快通过流式细胞术分析染色的细胞。1.2.8
检测氧化应激指标 细胞离心破碎取上清液,置冰上待测。利用分光光度计按照试剂盒操作计算得到细胞中MDA和SOD的含量。1.2.9
Western blot 每1 ml冷裂解缓冲液中加入10 μl磷酸酶抑制剂,1 μl 100 mmol/L蛋白酶抑制剂。将细胞转移到预冷的1.5 ml EP管中,并将制备好的裂解缓冲液加入细胞中,4 ℃裂解15 min。离心后,得上清液。利用BCA试剂盒测定蛋白含量。用12% SDS-PAGE分离蛋白,后转移至PVDF膜。膜与一抗孵育,4 ℃过夜。加入二抗,室温孵育1 h。使用ECL试剂进行化学发光检测。用ImageJ软件分析条带净吸光度值,GAPDH作为内参。1.3 统计学处理
该研究中的数据通过SPSS 22.0分析统计。两组间差异通过Student双尾t
检验比较;两组以上数据间的差异通过单因素方差分析(one-way ANOVA)比较,然后通过Bofferroni检验进行两两比较。P
<0.05被认为差异有统计学意义。2 结果
2.1 miR-483-5p inhibitor部分逆转棕榈酸对细胞活力的抑制作用
棕榈酸浓度依赖性地抑制细胞活力(图1A,P
<0.05,F
=47.12)并促进细胞miR-483-5p的表达(图1B,P
<0.05,F
=112.6)。当棕榈酸浓度为0.5 mmol/L时,细胞活力(45±5)%减少大于50%,见图1A。因此选择0.5 mmol/L作为后续实验处理条件。0.5 mmol/L棕榈酸能够促进miR-483-5p表达(图1C,P
<0.05,F
=56.56),而miR-483-5p inhibitor在一定程度上逆转此作用(图1C,P
<0.05)。细胞经0.5 mmol/L棕榈酸处理24 h后,细胞活力降低(图1D,P
<0.05,F
=42.88),而miR-483-5p inhibitor逆转此作用(图1D,P
<0.05)。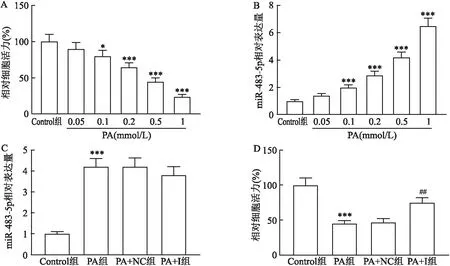
图1 miR-483-5p inhibitor部分逆转棕榈酸对细胞活力的抑制作用A:CCK-8检测不同浓度棕榈酸对小鼠肾足细胞活力的影响;B、C:实时荧光定量PCR(qRT-PCR)检测miR-483-5p表达水平;D:CCK-8检测细胞活力,U6起内参作用;PA:棕榈酸;NC:miRNA inhibitor阴性对照;I:miR-483-5p inhibitor;与Control组比较:*P<0.05,***P<0.001;与PA+NC组比较:##P<0.01
2.2 miR-483-5p inhibitor部分逆转棕榈酸对细胞凋亡和氧化应激的促进作用
棕榈酸促进细胞凋亡,而miR-483-5p inhibitor部分逆转此作用(图2A、B,P
<0.05,F
=86.26)。棕榈酸促进细胞MDA表达水平(图2C,P
<0.05,F
=85.64),抑制SOD表达水平(图2D,P
<0.05,F
=104.1),而miR-483-5p inhibitor部分逆转此作用(图2C、D,P
<0.05)。
图2 miR-483-5p inhibitor部分逆转棕榈酸对细胞凋亡和氧化应激的促进作用A、B:流式细胞仪检测各组细胞凋亡;C、D:比色法检测各组MDA和SOD表达水平;PA:棕榈酸;NC:miRNA inhibitor阴性对照;I:miR-483-5p inhibitor;与Control组比较:***P<0.001;与PA+NC组比较:###P<0.001
2.3 miR-483-5p直接靶向KLF2
Starbase结果表明,miR-483-5p在KLF2基因的3′-UTR上具有结合位点,见图3A。双荧光实验结果显示,与Blank+KLF2-WT组比较,miR-483-5p mimic+KLF2-WT组荧光活性降低(图3B,P
<0.05,t
=12.44),miR-483-5p mimic+KLF2-MUT组荧光活性改变(图3B,P
>0.05,t
=0.6367)。棕榈酸组较Control组的KLF2表达降低(图3C,P
<0.05,F
=20.94),miR-483-5p inhibitor部分逆转棕榈酸的作用(图3C,P
<0.05)。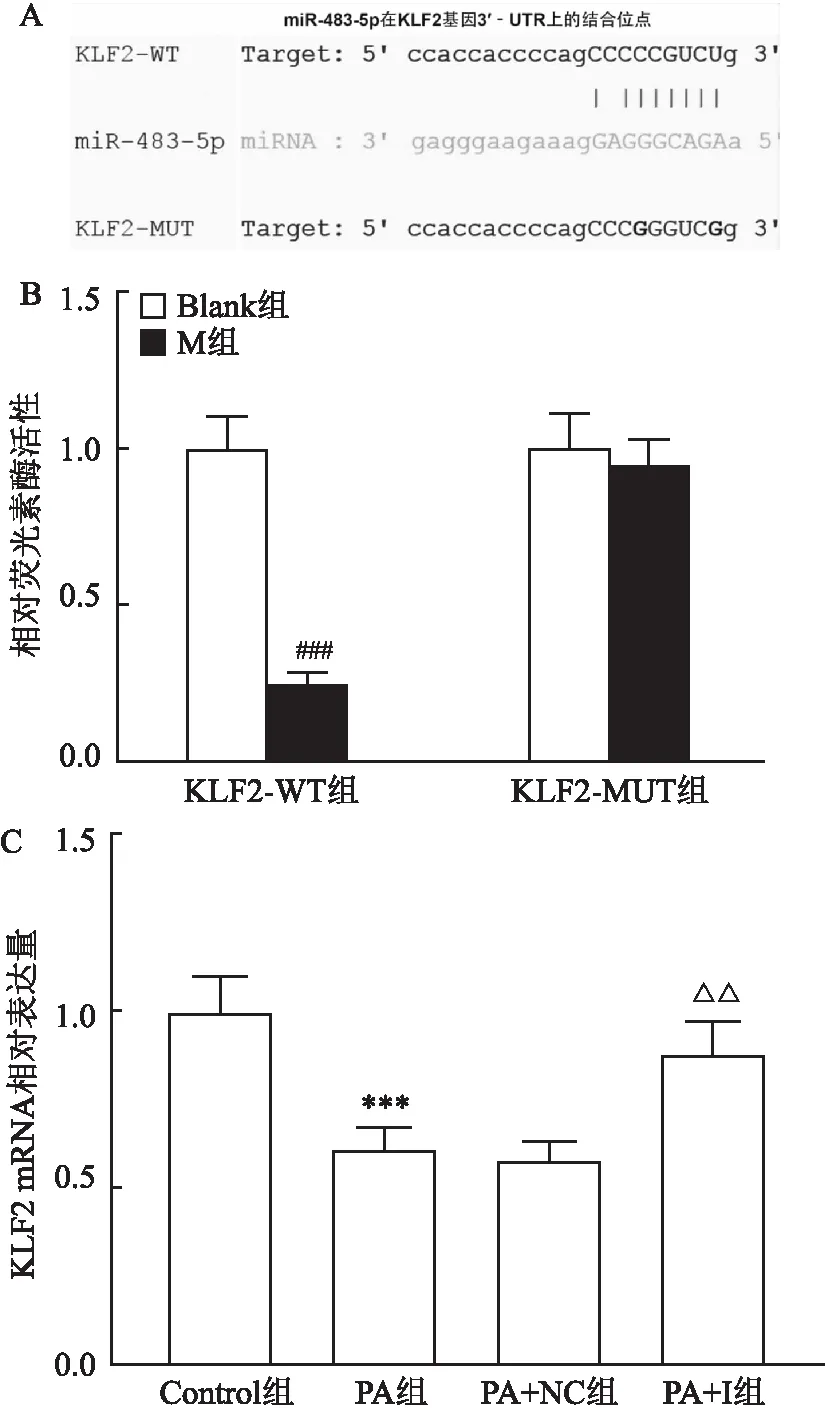
图3 miR-483-5p直接靶向KLF2A:Starbase 预测miR-483-5p在KLF2基因3′‐UTR上的结合位点;B:足细胞转染KLF2-WT或KLF2-MUT和M,双荧光报告实验检测足细胞的荧光素酶活性;C:PA处理I 或 NC转染的足细胞,实时荧光定量PCR(qRT-PCR)检测足细胞中KLF2的表达水平,GAPDH起内参作用;PA:棕榈酸;M:miR-483-5p mimic;NC:miRNA inhibitor阴性对照;I:miR-483-5pinhibitor;KLF2-WT:野生型KLF2;KLF2-MUT:突变型KLF2;与Blank组比较:###P<0.001;与Control组比较:***P<0.001;与PA+NC组比较:△△P<0.01
2.4 KLF2部分逆转miR-483-5p mimic的作用
0.5 mmol/L棕榈酸处理小鼠肾足细胞后,KLF2表达水平降低(图4A,P
<0.05,F
=92.27),细胞活力降低(图4B,P
<0.05,F
=81.67),MDA水平升高(图4C,P
<0.05,F
=89.49),SOD水平降低(图4D,P
<0.05,F
=130.8),C caspase3的表达升高(图4E、F,P
<0.05,F
=54.16),Nephrin(图4E、F,P
<0.05,F
=80.82)和Podocin(图4E、F,P
<0.05,F
=100.6)的表达降低,miR-483-5p mimic增强棕榈酸作用(图4A~F,P
<0.05),而miR-483-5p mimic作用被KLF2过表达部分逆转(图4A~F,P
<0.05)。
图4 KLF2部分逆转miR-483-5p mimic的作用A:qRT-PCR检测KLF2在各组中的表达水平;B:CCK-8检测各组细胞活力;C:比色法检测各组中MDA的表达水平;D:比色法检测各组中SOD的表达水平;E、F:Western blot检测各组中C caspase3、Nephrin以及Podocin表达水平,GAPDH起内参作用;PA:棕榈酸;NC:miRNA inhibitor阴性对照;M:miR-483-5p mimic;1:Control;2:PA+NC;3:PA+M;4:PA+M+KLF2; 与Control组比较:***P<0.001;与PA+NC组比较:△△△P<0.001;与PA+M组比较:###P<0.001
3 讨论
肾小球足细胞是一种高度分化的终末上皮细胞,缺乏增殖能力,在DN的发病过程中,足细胞的损伤扮演着举足轻重的角色。在该研究中,梯度浓度的棕榈酸作用于小鼠肾足细胞后,小鼠肾足细胞活力被抑制,且呈一定的浓度依赖性,这与相关的研究具有一致性,说明棕榈酸处理可导致小鼠肾足细胞增殖能力相对减弱,诱导细胞损伤。
血清miR-483-5p的上调可能与急性排斥反应所引起的肾损伤有关。在该研究中,棕榈酸能够呈浓度依赖性地促进miR-483-5p表达,说明miR-483-5p可能参与了棕榈酸损伤足细胞的过程。进一步表明,抑制miR-483-5p表达后,细胞活性得到恢复,而细胞凋亡受到抑制,说明抑制miR-483-5p可以部分逆转棕榈酸所抑制的细胞增殖以及棕榈酸促进的细胞凋亡。研究表明,氧化应激反应对肾组织造成的损伤是糖尿病肾病的重要发病机制之一,同时也是造成足细胞损伤的重要原因:MDA是氧化应激反应的常用指标,而SOD是重要的抗氧化酶。在本研究中,棕榈酸能够升高MDA表达水平,降低SOD水平,而miR-483-5p抑制后,MDA表达降低,SOD表达升高。由此可见,抑制miR-483-5p表达可以通过促进细胞活力,抑制凋亡和氧化应激反应,有效地保护棕榈酸诱导的足细胞损伤。
在糖尿病小鼠中,KLF2对预防肾小球内皮细胞和足细胞损伤具有至关重要的作用,且KLF2是小鼠和人类蛋白尿的重要调节因子。一些研究报道了miRNA可以通过靶向KLF2表达,进而调节机体内多种生理和病理机制。结果显示,在棕榈酸损伤的足细胞中,miR-483-5p直接靶向KLF2,并负反馈调节KLF2的表达。后续研究表明,在棕榈酸处理的足细胞中,miR-483-5p mimic能够进一步促进棕榈酸对细胞活力的抑制作用并促进氧化应激反应,然而,KLF2过表达部分逆转miR-483-5p mimic的作用。
裂解的caspase3(C caspase3)被认为是凋亡途径的执行者,C caspase3的激活是诱导凋亡所必需的步骤。Nephrin和Podocin是足细胞损伤的重要标志,均对足细胞裂孔隔膜的结构和功能维持发挥重要作用,并且Nephrin和Podocin表达下降与蛋白尿的发生及肾小球疾病进展密切相关。有研究表明,棕榈酸可剂量依赖性地减弱足细胞Nephrin、Podocin 表达水平。该研究表明,在棕榈酸损伤的足细胞中,miR-483-5p mimic能够促进C caspase3表达并抑制Nephrin和Podocin表达,KLF2过表达能够部分逆转miR-483-5p mimic对C caspase3、Nephrin和Podocin表达的作用。结果显示,miR-483-5p过表达可以通过抑制KLF2的表达,进而抑制足细胞活力、促进凋亡以及氧化应激反应,进一步增强棕榈酸对足细胞的损伤作用。
