巨噬细胞Lamtor2基因敲除小鼠对肺炎克雷伯菌易感性的研究
2021-04-09徐方明陈昊然刘艳艳兰燕虎李家斌
苏 丛,伍 婷,徐方明,陈昊然,刘艳艳,,4,律 娜,兰燕虎,4,李家斌,,,4
近些年,肺炎克雷伯菌(klebsiella
pneumoniae
, Kp)的高致病性感染在世界范围内不断被报道,人类健康也因此受到严重威胁。当微生物侵入机体时,巨噬细胞首先对病原体发挥吞噬作用,此为固有免疫;而晚期核内体溶酶体适配器(late endosomal/lysosomal adaptor 2,Lamtor2)在吞噬的发生过程中发挥重要作用;Lamtor2也是丝裂原活化蛋白激酶(MAPK)以及哺乳动物雷帕霉素(mTOR)激活物/调节剂复合物2的靶点。巨噬细胞在抗感染免疫过程中,巨噬细胞的Lamtor2分子与细胞向M1分化及其对病原菌杀伤力密切相关。该实验通过构建、饲养、繁育和鉴定Lamtor
2条件性基因敲除小鼠,获得Lamtor
2/Lyz
2-Cre鼠,建立Lamtor
2巨噬细胞条件敲除小鼠感染Kp模型,为探究Lamtor
2基因在抗Kp感染免疫过程中的机制提供线索。1 材料与方法
1.1 材料
1.1.1
实验动物Lamtor
2/+小鼠共 3 只,雌鼠 1 只、雄鼠 2 只;Lyz
2-Cre工具鼠共2只,雌、雄各1只,均购自赛业(广州)生物科技有限公司,20~30 g/6周龄,小鼠品系为C57BL/6J,无特殊病原体(SPF级),实验动物生产许可证号:SCXK(粤)2018-0032,使用许可证号:SYXK(皖)2017-006;伦理审批号:LLSC20190253。实验过程遵循3R原则。1.1.2
试剂与仪器 基因组DNA提取试剂盒(货号:JL45852)购自北京天根生化科技有限公司;Taq PCR Master Mix(货号:RR901)、TB Green Premix Ex Taq(货号:RR420)以及DL2 000 bp DNA marker(批号:A1A0438)均购自日本TaKaRa公司;琼脂糖粉(批号:111860)购自上海生工生物工程股份有限公司。β-Actin抗体(货号:sc-47778)购自美国Santa Cruz公司;iNOS抗体(货号:AF0199)购自美国Affinity公司;二抗山羊抗IgG/辣根酶标记[货号:ZB-2305(抗鼠)、ZB-2301(抗兔)]购自北京中杉金桥公司。荧光定量PCR仪(罗氏LightCycler 96,瑞士),基因扩增仪(Biometra Tone,德国),Western blot电泳仪(Bio-Rad,美国),凝胶电泳成像仪(Tanon 5 200 Multi,上海天能)。
1.2 实验方法
1.2.1
小鼠的饲养与繁殖 根据国家实验动物饲养和使用指南,将小鼠饲养于安徽医科大学SPF级动物房中,室温控制在20~25 ℃,湿度50%~60%,保证12 h光照,昼夜交替。饲养过程中保持无菌环境,观察并记录小鼠生长发育情况。将性成熟(6~9周龄)的雌鼠与其中一只雄鼠同笼合养进行繁殖,每周给予灭菌的蛋黄和瓜子补充营养。小鼠的平均发情周期为4~5 d,发情时间约20 h,妊娠期19~21 d,子代出生后20~21 d断奶分笼,雌性幼鼠和雄性幼鼠分笼饲养。1.2.2
小鼠亲代及子代信息记录 为详细记录繁殖后代的信息,设计亲代和子代标签,在亲代标签中,针对小鼠的笼号、基因型、出生日期、周龄、合笼日期、产仔日期和数量进行详细记录;在子代标签中,对幼鼠的笼号、出生日期、周龄、来源笼进行详细记录。1.2.3
小鼠基因型鉴定 鼠出生后3~4周与母鼠分笼,剪取小鼠脚趾0.3~0.5 cm置无菌1.5 ml EP管中,并依据剪取的不同脚趾标记小鼠。用基因组DNA提取试剂盒提取小鼠基因组DNA,所得样品置-20 ℃保存。采用PCR法:flox
基因上游引物: 5′-CCAAATGAACCAAAGTCCAGTCTGC-3′;下游引物:5′-GGAACACAGTGAACAGGAACTAAGG-3′;Cre基因上游引物:5′-TGGAATGGCTGGCTACTATGG-3′;下游引物:5′-TGCAATTGATCCCACAGGCA-3′,5′-CCCAGAAATGCCAGATTACG-3′。反应体系为25 μl,反应程序:95 ℃、3 min,95 ℃、30 s,60 ℃、30 s,72 ℃、30 s,共35个循环;72 ℃、10 min,4 ℃、1 h。配制2.5%的琼脂糖凝胶:称取2.5 g琼脂糖粉末溶于100 ml 1×TAE电泳缓冲液中,微波炉中高火加热3 min,冷却约7 min后加入10 μl EB核酸染料,轻轻摇匀,避免产生气泡,制胶。取5 μl PCR产物和3 μl DL 2 000 bp DNA marker加入上样孔中进行电泳分析,恒压150 V,时间45 min;然后置于凝胶电泳成像仪中成像,观察电泳条带。若PCR条带出现与flox基因、Cre基因PCR产物大小一致的条带则为阳性结果,即Lamtor
2/Lyz
2-Cre。1.2.4
Lamtor
2基因敲除效果验证 待小鼠成熟至8周龄,收集Lamtor
2/Lyz
2-Cre小鼠和Lamtor
2/Lyz
2-Cre小鼠肺泡巨噬细胞,采用qRT-PCR方法检测两组Lamtor
2 mRNA的表达。Lamtor
2基因上游引物:5′-ATAATGAGGGATCGCTGCTGG- 3′;下游引物:5′-CTACGGTCTCCTTGGCATACA- 3′;内参GAPDH基因上游引物:5′-GTCAAGGCCGAGAATGGGAA-3′;下游引物:5′-CTCGTGGTTCACACCCATCA-3′。1.2.5
小鼠肺泡巨噬细胞iNOS表达水平检测 用RIPA裂解液提取Lamtor
2/Lyz
2-Cre和Lamtor
2/Lyz
2-Cre小鼠肺泡巨噬细胞蛋白,吸取30 μl上清液与上样缓冲液混合后金属浴煮沸10 min变性,将所制蛋白样品进行SDS-PAGE电泳,恒压75 V、120 min;电泳结束后将蛋白转至经甲醇浸泡数分钟且适当大小的PVDF膜上,恒流220 mA,冰上转膜1~2 h后用5%脱脂奶粉室温封闭2 h。分别加入经Western blot一抗稀释液稀释的β-Actin抗体(1 ∶5 000)、Lamtor2抗体(1 ∶1 000)和iNOS抗体(1 ∶1 000),4 ℃孵育过夜;1×TBST缓冲液洗膜3 次,每次10 min;加入5%脱脂奶粉稀释的山羊抗兔或山羊抗鼠的二抗(1 ∶10 000)孵育2 h,1×TBST缓冲液洗脱3 次后化学发光成像系统进行拍照。观察Lamtor2和iNOS的表达情况,进一步确定Lamtor
2敲除后的杀菌活性效果。1.2.6
小鼠肺泡巨噬细胞内炎症因子表达水平检测 收集繁殖子代中野生型小鼠的肺泡巨噬细胞作为对照组,而纯合子小鼠的肺泡巨噬细胞作为实验组,分别感染肺炎克雷伯标椎菌株(ATCC 43816)(细菌 ∶细胞=10 ∶1),刺激6 h后收集细胞,采用RT-qPCR方法检测两组细胞分泌的炎性因子肿瘤坏死因子(TNF)-α、白细胞介素(interleu kin,IL)-1β和Cxcl1的mRNA相对表达量。1.2.7
小鼠Kp肺部感染 小鼠处于麻醉状态下,鼻内注射1×10CFU的Kp(ATCC 43816)50 μl,观察小鼠的生存状况。1.3 统计学处理
采用SPSS 16.0软件进行统计学分析,每组实验重复3 次,组间比较采用t
检验。对于生存曲线比较,使用Log-rank (Mantel-Cox) test分析结果,P
<0.05为差异有统计学意义。2 结果
2.1 小鼠繁殖及发育
Lamtor
2/+自交后雌鼠 1 个月内生产幼鼠10 只,幼鼠出生后由母鼠母乳喂养,新生小鼠无毛发,全身粉红色;哺乳期约3周,存活10只,其中,Lamtor
2/1只,雄性。Lamtor
2/+雄鼠与Lyz
2-Cre雌鼠杂交后1月内生产幼鼠共8只,其中Lamtor
2/+Lyz
2-Cre3只。Lamtor
2/雄性小鼠与Lamtor
2/+Lyz
2-Cre雌性小鼠交配1个月内生产幼鼠共 5只。2.2 小鼠基因型鉴定结果
取幼鼠脚趾组织进行PCR扩增,flox
基因型鉴定如图1所示。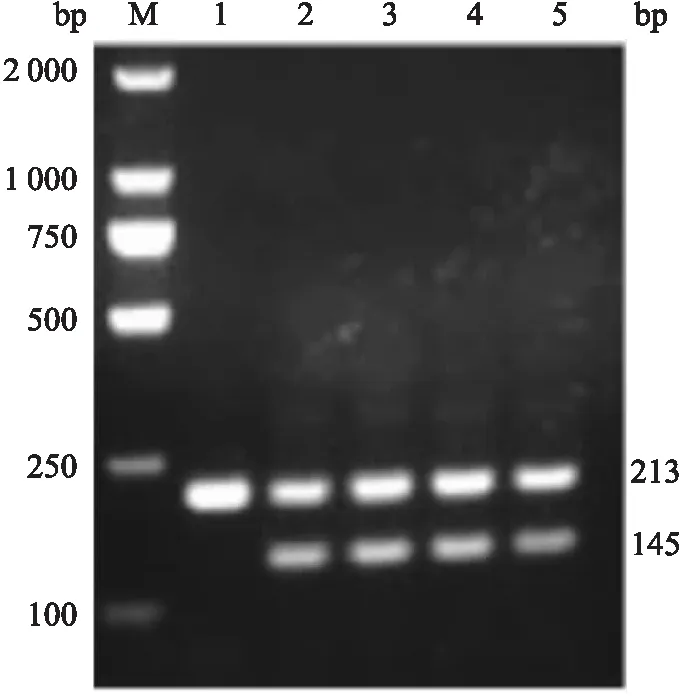
图1 flox基因型鉴定结果M:Marker;1:Lamtor2flox/flox纯合子小鼠;2、3、4、5:Lamtor2flox/+杂合子小鼠
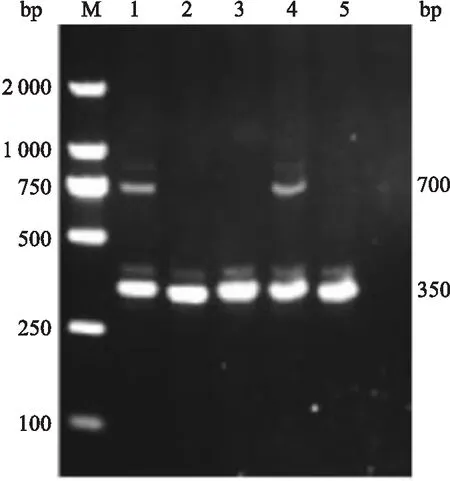
图2 Cre基因型鉴定结果M:Marker;1和4:Lyz2-Cre+/-;2、3、5:Lyz2-Cre-/-
2.3 条件基因敲除小鼠肺泡巨噬细胞
2 mRNA水平鉴定
分别提取10只实验组和10只对照组小鼠肺泡巨噬细胞RNA,逆转录为cDNA,RT-qPCR结果如图3所示,Lamtor
2/Lyz
2-Cre小鼠Lamtor
2 mRNA的表达低于Lamtor
2/Lyz
2-Cre小鼠[(0.06±0.006)vs
(1.00±0.003),P
<0.01]。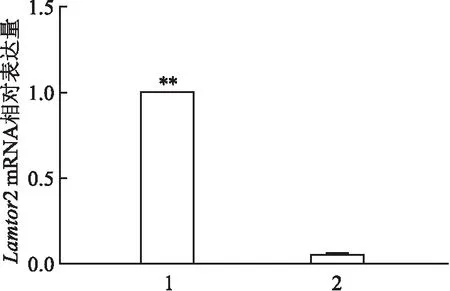
图3 两组小鼠Lamtor2 mRNA表达量1:Lamtor2flox/floxLyz2-Cre-/-小鼠;2:Lamtor2flox/flox Lyz2-Cre+/-小鼠;与Lamtor2flox/floxLyz2-Cre+/-比较:**P<0.01
2.4 蛋白水平的
2基因敲除鉴定和肺泡巨噬细胞感染后iNOS表达
提取两组小鼠肺泡巨噬细胞蛋白进行Western blot检测,结果如图4所示,与Lamtor
2/Lyz
2-Cre小鼠比较,Lamtor
2/Lyz
2-Cre小鼠Lamtor2蛋白不表达,且Lamtor
2/Lyz
2-Cre小鼠肺泡巨噬细胞在感染Kp 6 h后,iNOS表达减少。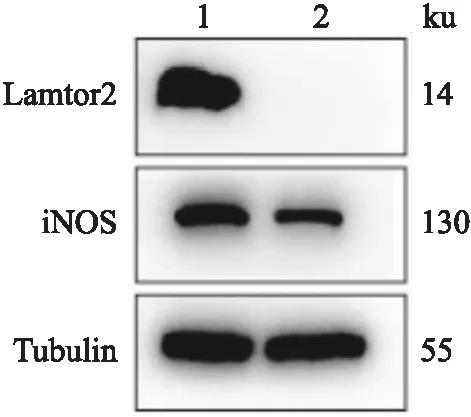
图4 两组小鼠肺泡巨噬细胞Lamtor2及感染后iNOS蛋白表达1:Lamtor2flox/floxLyz2-Cre-/-小鼠;2:Lamtor2flox/flox Lyz2-Cre+/-小鼠
2.5
2
2-Cre
小鼠感染Kp后生存状况观察
为了研究Lamtor
2基因在Kp感染中发挥的作用,对照组和实验组分别取10只小鼠,通过鼻滴法制作感染Kp小鼠肺炎模型,监测小鼠7 d病死率。Lamtor
2/Lyz
2-Cre小鼠组7 d病死率为30%,Lamtor
/Lyz
2-Cre小鼠7 d病死率为80%(中位生存时间=89.5 h,P
=0.032 6),差异有统计学意义(图5)。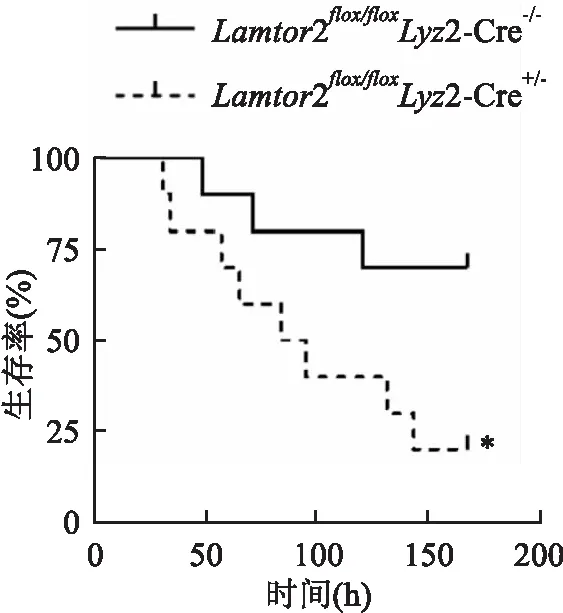
图5 两组小鼠感染后7 d存活率与Lamtor2flox/floxLyz2-Cre-/-比较:*P<0.05
2.6 Kp感染
2条件性基因敲除小鼠的肺泡巨噬细胞炎症因子的分泌水平
选取Lamtor
2/Lyz
2-Cre小鼠的肺泡巨噬细胞为对照组,而Lamtor
2/Lyz
2-Cre小鼠的肺泡巨噬细胞为实验组,分别感染Kp后,实验组细胞内的炎性因子TNF-α(t
=17.54,P
=0.003 2)、IL-1β(t
=15.37,P
=0.004 2) 和Cxcl1(t
=37.82,P
=0.000 7)的相对表达量均低于对照组,差异均有统计学意义(图6)。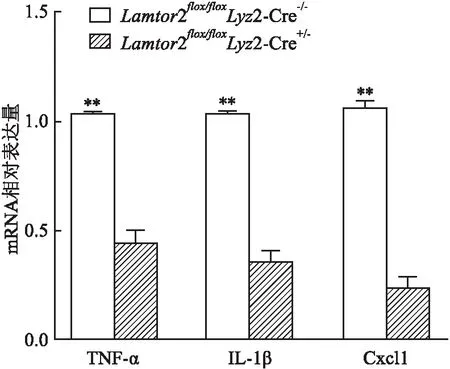
图6 两组小鼠肺泡巨噬细胞感染后炎症因子mRNA表达与Lamtor2flox/floxLyz2-Cre+/-比较:**P<0.01
3 讨论
基因敲除技术是在20世纪80年代后半期根据DNA同源重组原理而发展起来的。它从分子水平上去除或替代一个基因,整体水平观察实验动物,以此检测被敲除基因功能的实验方法。有文献指出,基因敲除可能对小鼠的生殖功能有影响,但该实验表明条件性基因敲除Lamtor
2基因后并没有影响小鼠的生育能力。利用Cre-flox重组酶系统敲除小鼠中Lamtor
2基因,通过繁育和基因鉴定,成功筛选出纯合子幼鼠(Lamtor
2/Lyz
2-Cre);繁殖子代中的纯合子可用作实验组,野生型用作对照组。当病原体侵入机体时,巨噬细胞的吞噬作用是固有免疫应答的关键环节;Lamtor
2调节着内体-溶酶体系统,激活巨噬细胞MAPK中的ERK信号通路,进一步激活NADPH吞噬氧化酶的组装,使吞噬体获得完整抗菌特性。它的缺失会影响NADPH吞噬氧化酶及诱导型一氧化氮合酶(iNOS)的活化,从而抑制ROS及NO的产生,降低细胞感染病原体时所发挥的抗菌活性。在吞噬过程中,病原体表面同源配体与细胞膜上受体的相互作用导致其内化为噬菌体,需要与内体组分融合形成成熟吞噬体,最终与溶酶体融合杀死微生物。事实上,Lamtor
2基因在吞噬体与溶酶体的融合过程中充当重要角色。Lamtor
2基因的缺失会导致晚期内体(Rab7)在吞噬小泡上的分布和表达的急剧下降,使得吞噬体-内泌体复合物向溶酶体的错误转运,杀菌功能下降。该实验结果显示,条件基因敲除小鼠对Kp感染的抵抗能力减弱,病死率高。iNOS的表达随着Lamtor
2基因的敲除而降低,说明MAPK-ERK信号通路杀菌效应受到了影响,而Lamtor
2基因对杀菌效应蛋白iNOS的调控作用,可能也是宿主抵抗Kp感染的机制之一。此外,感染Kp的Lamtor
2条件敲除小鼠肺泡巨噬细胞中炎症因子TNF-α、IL-1β和Cxcl1的mRNA相对表达量均降低,由此可见,Lamtor
2促进了Kp感染巨噬细胞的杀菌过程。该研究成功构建的Lamtor
2条件基因敲除小鼠可以为后续研究Lamtor
2基因在宿主抗感染的免疫机制奠定了基础。