槲皮素对蛛网膜下腔出血大鼠脑损伤的影响机制
2021-04-09缪昌峰
薛 智,彭 倩,李 璟,缪昌峰
蛛网膜下腔出血(subarachnoid hemorrhage, SAH) 是临床常见的一种严重的急性脑血管疾病,多发生于颅内动脉瘤、外伤、药物或其他原因。槲皮素是一种天然的黄酮类化合物,具有广泛的药理活性。之前的研究报道,槲皮素可以抑制细胞凋亡、保护神经细胞、减少氧化应激造成的脑损伤。但是关于槲皮素在蛛网膜下腔出血早期对脑损伤的作用目前的研究较少,该研究通过颈内动脉穿刺法建立SAH大鼠模型,探讨槲皮素对SAH 24 h后大鼠脑损伤的影响。
1 材料与方法
1.1 实验动物与分组
SPF级SD雄性大鼠,体质量270~300 g,6~8周龄,购自上海西普尔必凯实验动物有限公司,动物合格证号SCXK(沪)2019-0012,室温23~25 ℃饲养,食物和水分按时摄入,昼夜节律规律。将实验大鼠随机分为Sham组、SAH组和模型+槲皮素50 mg/kg组(SAH+Que 50 mg/kg)和模型+槲皮素100 mg/kg组(SAH+Que 100 mg/kg),槲皮素用0.9%氯化钠溶液溶解,采取灌胃给药,给药体积为1 ml,持续14 d,每组15只,其中5只用于脑水肿检测,5只用于免疫组织化学检测,5只用于蛋白印迹实验。1.2 模型制备
采用颈内动脉穿刺法建立SAH大鼠模型,经大鼠腹腔注射10%水合氯醛(4.0 ml/kg)后,分离颈总、颈内、颈外动脉和枕动脉,结扎颈总动脉近心端,颈外动脉远心端和距颈动脉分叉处5 mm处。用纤芯从颈外动脉进入,向颈内动脉插入,入颅内直到有明显抵抗感,再用力向前推3 mm刺破大脑中动脉,停留15 s后拔出纤芯并结扎颈外动脉,缝合消毒。造模成功的标准:① 有明显的血管刺破感。② 大鼠出现呼吸急促,心率加快症状。③ 脑组织剥离后可观察到明显的血液散布在脑底和环池等部位。每组15只大鼠,造模过程中出现动物死亡随机给予补充。1.3 试剂与仪器
槲皮素(≥95%)和伊文思蓝均购自美国Sigma公司;TUNEL染色试剂盒、大鼠抗LC3抗体、抗Cleaved caspase-9抗体、抗Bax抗体、抗Bcl-2抗体、抗Nrf2抗体、抗HO-1抗体、抗NQO1抗体和GAPDH均购自中国赛默飞世尔公司;DYY-7C型电泳仪购自北京市六一仪器厂;凝胶成像系统购自美国Bio-Rad公司;Click-iT®TUNELAlexa 488试剂盒购自上海赛默飞公司。1.4 实验方法
1.4.1
神经功能评分 在造模后23 h,依据Garcia神经功能评分标准,对实验大鼠的自发活动、前爪运动及力量、四肢自发运动、本体感觉、攀爬能力及触须刺激反应等进行评分。1.4.2
脑组织含水量检测 在完成神经功能评分后,采用干湿重法测定脑组织含水量,动物麻醉处死后,去大脑称重为湿质量,在100 ℃恒温箱干燥烘烤3 d后再次称重为干质量,计算脑组织含水量百分比。1.4.3
EB含量测定 通过测定EB外渗来分析血脑屏障通透性。在完成神经功能评分后,取7只大鼠用水合氯醛麻醉,通过尾静脉注入2% EB(2 ml/kg),打开胸腔,心内灌注0.9%氯化钠溶液+20 U/ml肝素钠共300 ml,断头取脑,然后将大鼠大脑在10倍体积的50%三氯乙酸溶液中匀浆沉淀蛋白质并离心。 上清液用乙醇(1 ∶3)稀释,并在610 nm处测量荧光,以测量EB的吸光度。1.4.4
免疫荧光染色 在Garcia神经功能评分后麻醉大鼠,并用盐水和10%福尔马林磷酸盐缓冲液经心脏灌注。取出脑,在多聚甲醛中固定24 h,随后石蜡包埋并切下20 μm厚的切片,对切片进行TUNEL染色。将切片脱石蜡,再水化并在PBS中洗涤两次。4%(W/V) PFA中固定切片15 min,PBS洗涤后,将切片在室温下用3% HO孵育15 min,并用含有0.1% Triton X-100的PBS和5%牛血清白蛋白在37 ℃下封闭30 min。将切片分别与Ⅰ抗[1 ∶500稀释的NeuN(神经元标记)、LC3]在4 ℃下孵育过夜,PBS中洗涤后,在室温下与山羊抗兔Alexa Fluor 488 Ⅱ抗孵育1 h。使用ECLPSE 80i(Nikon,日本)显微镜拍摄每个样品的5个随机视野的图像。1.4.5
蛋白印迹实验 取脑皮质组织100 mg放入试管,剪碎,裂解液充分研磨,冰上裂解1 h,12 000 r/min离心15 min,取上清液,测蛋白浓度(Bio-Rad试剂盒),分别取50 μg蛋白样本经SDS-PAGE电泳分离蛋白后(于4%~12%聚丙烯酰胺凝胶电泳)2 h,转至硝酸纤维膜上,5%脱脂奶粉封闭2 h,分别与抗Cleaved caspase-9、Bax、Bcl-2、Nrf2、HO-1和NQO1一抗(兔抗鼠,1 ∶1 000)37 ℃摇床孵育2.5 h,PBST洗涤3次,与二抗(羊抗兔,1 ∶2 000)37 ℃摇床孵育0.5 h。PBST洗涤后经ECL荧光显色,SMARTVIEW软件分析蛋白表达量。
2 结果
2.1 神经功能评分、脑组织水含量测定及伊文思蓝渗出测定结果
采用Garcia神经功能评分对各组进行神经功能评定,与Sham组(0.20±0.05)比较,SAH组(5.27±0.35)Garcia神经功能评分增高(F
=13.31,t
=4.518,P
<0.001),脑组织水含量升高(F
=26.21,t
=15.827,P
<0.001),伊文思蓝渗出增加(F
=10.84,t
=5.275,P
<0.05);与SAH组比较,SAH+Que 50 mg/kg组(3.7±0.1)Garcia神经功能评分降低(F
=13.31,t
=5.520,P
<0.05),脑组织水含量降低(F
=26.21,t
=14.963,P
<0.05);与SAH组比较,SAH+Que 100 mg/kg组(3.7±0.1)Garcia神经功能评分降低(F
=13.31,1.8±0.2)(t
=5.028,P
<0.01),脑组织水含量降低(F
=26.21,t
=12.430,P
<0.001),伊文思蓝渗出减少(F
=10.84,t
=4.963,P
<0.01)。见图1。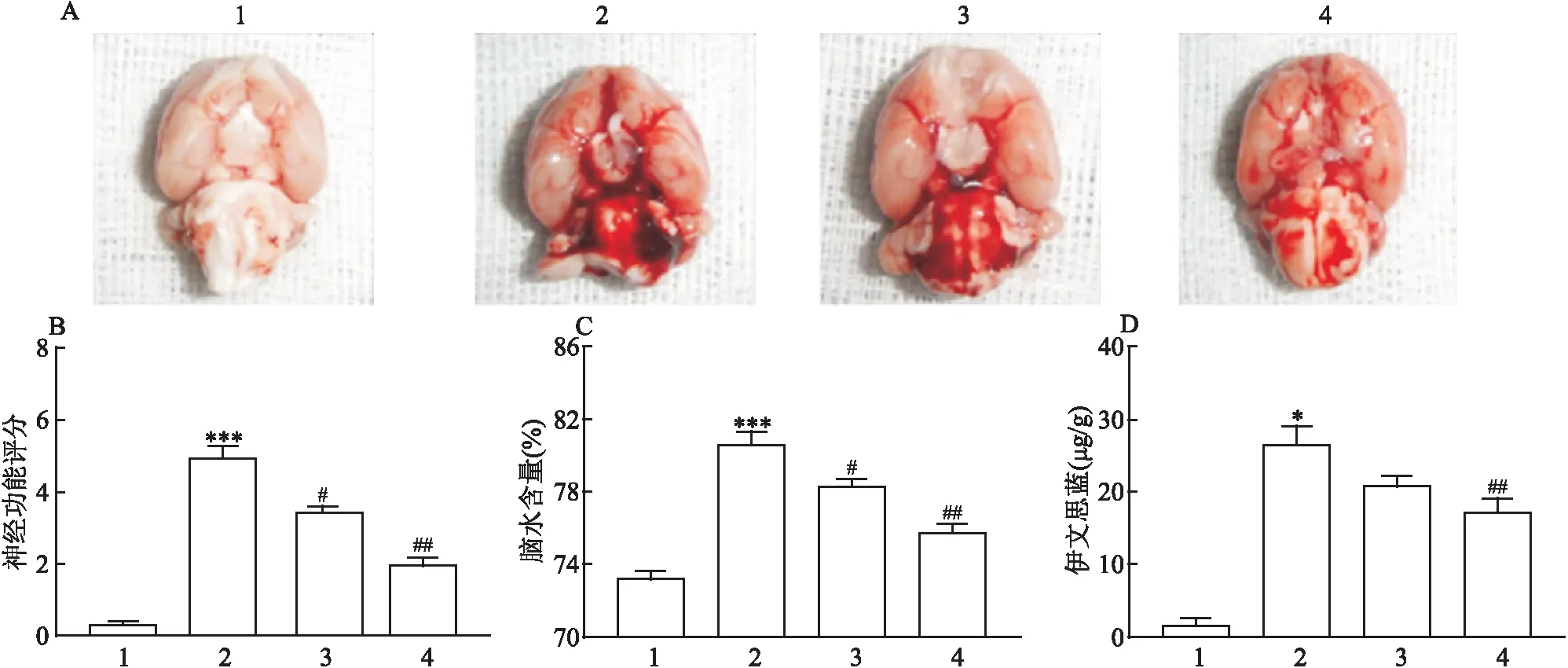
图1 神经功能评分、脑组织水含量测定及伊文思蓝法检测血-脑屏障通透性(n=5)A:各组大鼠大脑组织代表图;B:各组神经功能评分;C:各组脑组织水含量测定;D:各组伊文思蓝渗出量;1:Sham组;2:SAH组;3:SAH+Que 50 mg/kg组;4:SAH+Que 100 mg/kg组;与Sham组比较: *P<0.05,***P<0.001;与SAH组比较: #P<0.05,##P<0.01
2.2 TUNEL/NeuN双荧光染色结果
TUNEL/NeuN双荧光染色结果表明,与Sham组比较,SAH组TUNEL/NeuN双阳性细胞占NeuN阳性细胞比例增加(F
=31.32,t
=21.729,P
<0.001);与SAH组比较,SAH+Que 50 mg/kg组和SAH+Que 100 mg/kg组TUNEL/NeuN双阳性细胞占NeuN阳性细胞比例减少(F
=31.32,t
=17.528、19.482, 均P
<0.05),且呈现出Que剂量依赖性。见图2。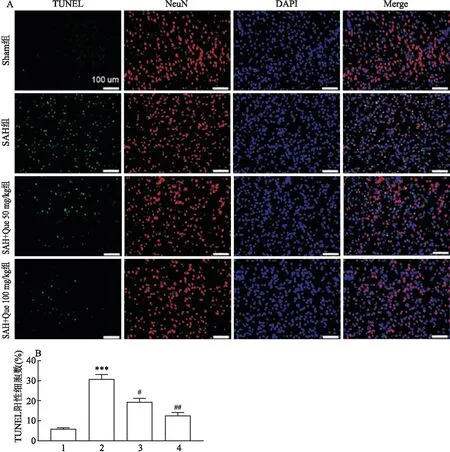
图2 TUNEL/NeuN双荧光染色结果(n=5)A:绿色荧光蛋白为TUNEL标记的凋亡细胞,红色荧光蛋白为NeuN标记的神经元,红绿混合荧光为TUNEL/NeuN双标记的效果;B:TUNEL阳性细胞数;1:Sham组;2:SAH组;3:SAH+Que 50 mg/kg组;4:SAH+Que 100 mg/kg组;与Sham组比较: ***P<0.001;与SAH组比较: #P<0.05,##P<0.01
2.3 LC3/NEUN双荧光染色结果
LC3/NeuN双荧光染色结果表明,与Sham组比较,SAH组LC3/NeuN双阳性细胞占比增加(F
=16.64,t
=6.470,P
<0.001);与SAH组比较,SAH+Que 50 mg/kg组和SAH+Que 100 mg/kg组LC3/NeuN双阳性细胞占比减少(F
=16.64,t
=7.263、8.108, 均P
<0.05),且呈现出Que剂量依赖性。见图3。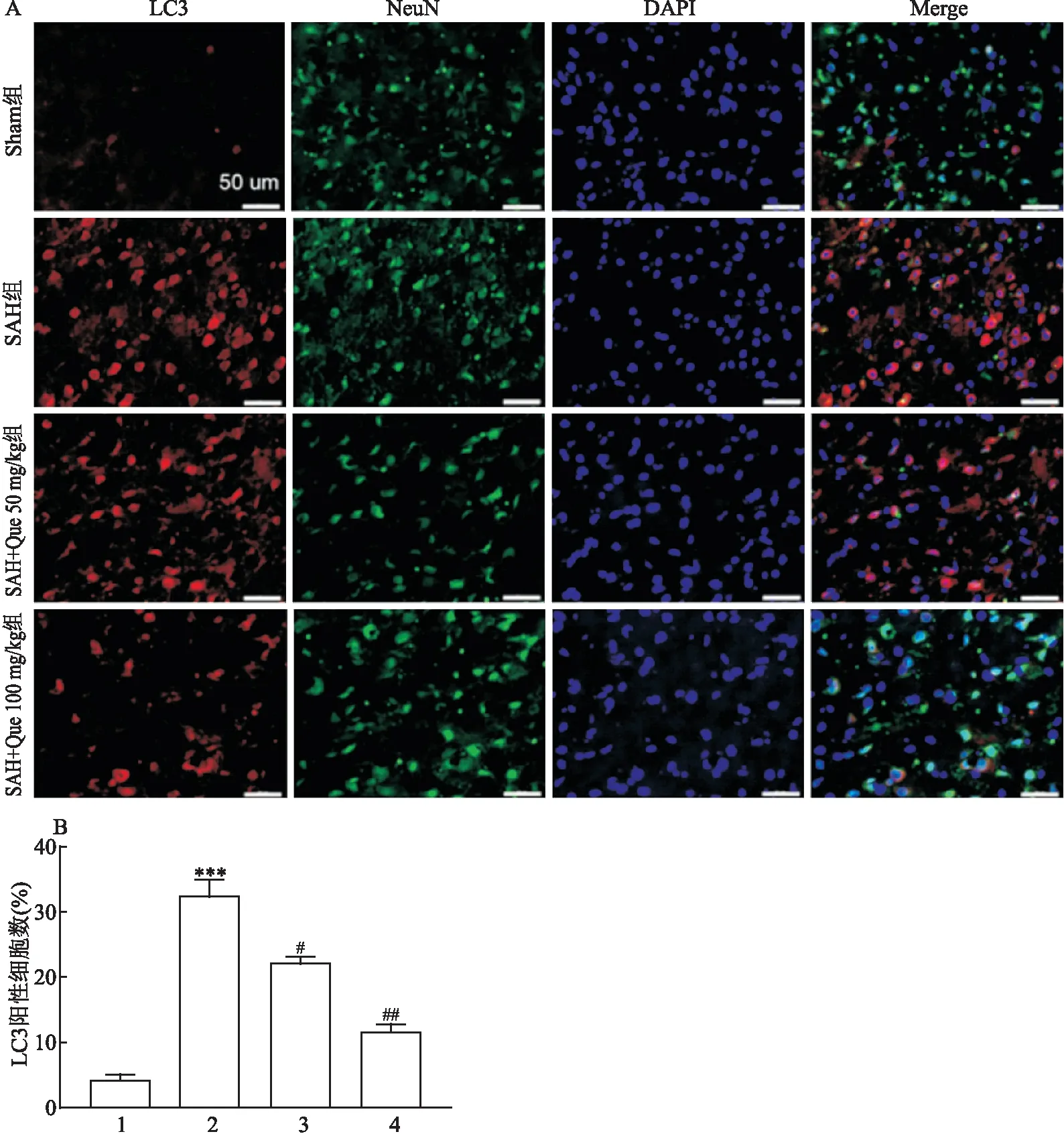
图3 LC3/NEUN双荧光染色结果(n=5)A:绿色荧光蛋白为LC3阳性细胞,红色荧光蛋白为NeuN标记的神经元,红绿混合荧光为LC3/NeuN双阳性的细胞;B:LC3阳性细胞数;1:Sham组;2:SAH组;3:SAH+Que 50 mg/kg组;4:SAH+Que 100 mg/kg组;与Sham组比较:***P<0.001;与SAH组比较:#P<0.05,##P<0.01
2.4 蛋白印迹实验结果
蛋白印迹实验表明,与Sham组比较,SAH组凋亡相关蛋白Cleaved caspase-9和 Bax表达增高,Bcl-2表达降低(F
=19.75,t
=4.352、4.587、4.269,P
<0.001),Nrf2、HO-1和NQO1表达均降低(F
=17.32,t
=4.823、5.285、4.920,P
<0.001);与SAH组比较,SAH+Que 50 mg/kg组和SAH+Que 100 mg/kg组Cleaved caspase-9和 Bax表达降低,Bcl-2表达增高(F
=21.65,t
=4.150~6.825, 均P
<0.05),Nrf2、HO-1和NQO1表达均增高(F
=19.21,t
=4.050~6.520, 均P
<0.01)。见图4。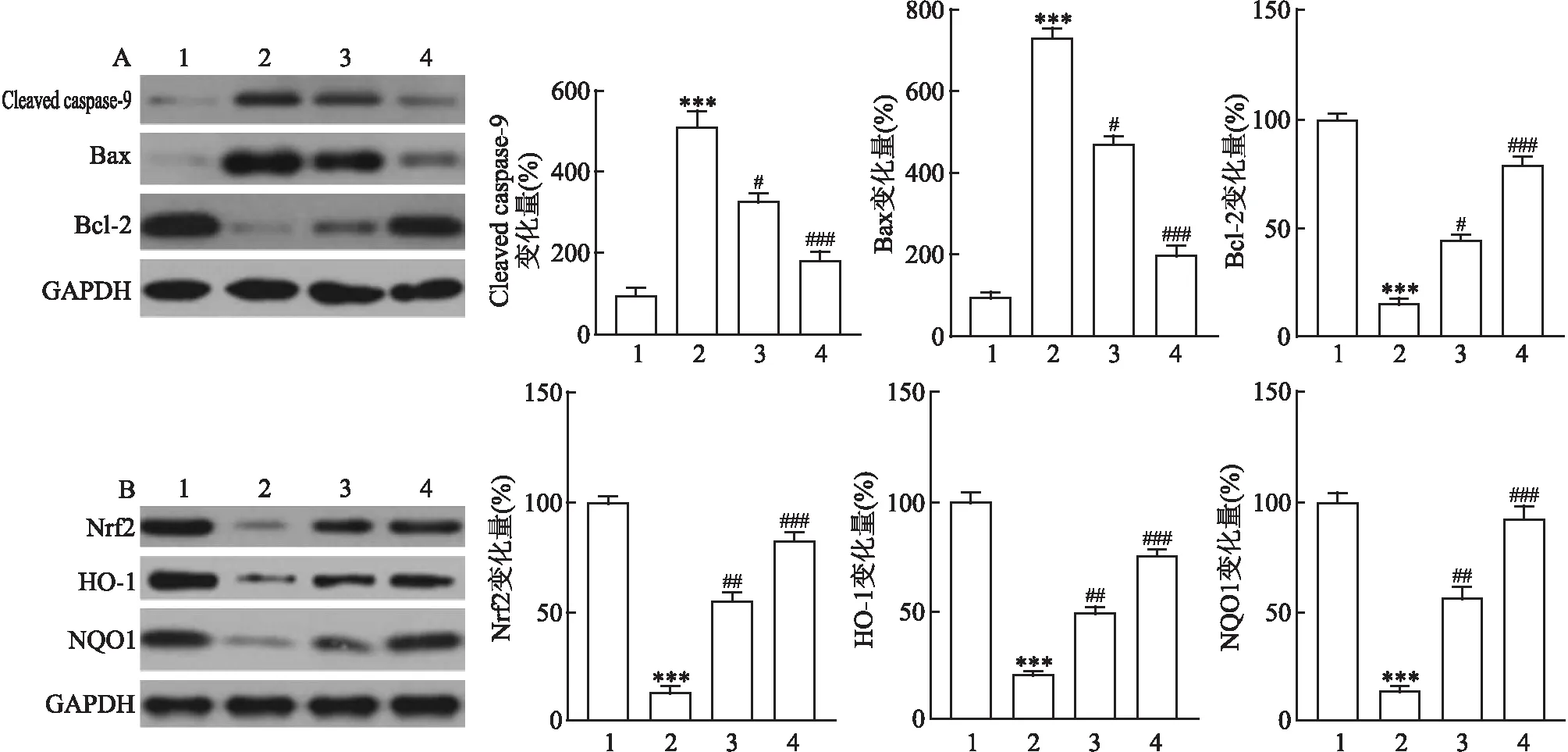
图4 蛋白印迹实验结果(n=5)A、B:各相关蛋白的表达;1:Sham组;2:SAH组;3:SAH+Que 50 mg/kg 组;4:SAH+Que 100 mg/kg 组;与Sham组比较:***P<0.001;与SAH组比较:#P<0.05,##P<0.01,###P<0.001
3 讨论
SAH引起的广泛的神经细胞凋亡是SAH后早期脑损伤中的关键部分。该研究表明,与Sham组比较,SAH组神经功能评分、脑组织水含量均显著升高,血脑屏障通透性显著减弱,表明SAH后出现脑水肿、细胞死亡和神经功能减弱。与SAH组比较,Que干预后神经功能评分、脑组织水含量均降低,血脑屏障通透性改善,表面Que改善了SAH后的脑水肿和神经细胞功能。TUNEL染色中SAH组TUNEL阳性细胞高于Sham组,但低于Que干预组,也表明Que可以显著减少SAH后神经细胞凋亡。
自噬和凋亡信号通路存在广泛的联系,它们相互作用共同调节细胞死亡。正常水平的自噬是一种通过降解细胞内异常组分以维持细胞稳态的过程,然而过度自噬则引起细胞自噬性死亡。LC3是细胞膜表面参与自噬小体形成的蛋白,是自噬过程的标志性蛋白,免疫荧光染色结果显示,SAH组LC3/NeuN双阳性细胞在NeuN阳性细胞中占比高于Sham组,但低于Que干预组,表明SAH后神经细胞出现过度自噬导致大量神经细胞死亡,Que干预可以抑制过度自噬导致的神经细胞死亡。
之前的研究表明,线粒体通路在蛛网膜下腔出血后早期脑损伤细胞凋亡中起重要作用,Bcl-2和Bax基因是线粒体凋亡通路的关键调控基因,Bcl-2家族包括抗细胞凋亡的基因(如Bcl-2)和促细胞凋亡的基因(如Bax),Bax在线粒体外膜形成同源二聚体从而形成通道,使细胞色素C释放到胞质中进而激活caspase-9,最终导致细胞凋亡。蛋白印迹实验表明,SAH组凋亡相关蛋白Cleaved caspase-9和 Bax表达高于Sham组,但低于Que干预组,表明SAH通过Bax/caspase-9通路促进细胞凋亡,Que干预通过Bax/caspase-9通路抑制细胞凋亡。本核因子E2相关因子2(Nrf2)是一种氧化应激过程中的防御性转录因子,受到刺激时被激活向细胞核转移,HO-1和NQO-1是Nrf2的下游分子,激活Nrf2-HO-1/NQO-1通路已被报道可通过减缓氧化应激对神经细胞起保护作用。该研究表明,SAH组Nrf2、HO-1和NQO1表达低于Sham组和Que干预组,Que可激活被SAH抑制的Nrf2/HO-1通路,提示Nrf2/HO-1通路参与Que发挥的神经细胞保护作用。
