亮菌多糖对LPS诱导的肠上皮细胞炎性损伤的保护作用及机制探讨
2021-04-09朱耀东
张 梅,吴 悦,苏 丽,朱耀东,李 平,王 婷
肠黏膜屏障作为机体最重要的屏障之一,能够抵御毒素和肠外病原体预防炎症的发生。多种因素均可以导致该屏障的损害,如临床上化疗性肠黏膜损伤(chemotherapy-induced intestinal mucosal injury, CIMI),严重影响了患者的治疗效果,甚至缩短生存期。对于CIMI 的防治,集中在症状控制上,不能从根源上解决障碍。因此,寻找防治CIMI 的有效手段已成为目前肿瘤学领域研究的热点问题。
亮菌口服液(Armillariella
oral solution, AOS)是一种拥有完全知识产权的中成药,临床上被用于放化疗引起的白细胞减少的辅助治疗等。AOS能够缓解5-FU 诱导的小鼠肠黏膜的损伤。亮菌多糖(Armillariella
tabescens polysaccharides, ATPS)作为其中最主要成分,研究表明其能够保护顺铂所导致的小鼠肠黏膜损伤。然而,ATPS 如何保护肠黏膜损伤的分子机制尚未有报道。现通过体外构建细菌脂多糖(lipopolysaccharide, LPS)诱导的IEC-6 肠上皮细胞损伤为模型,观察ATPS 对肠上皮细胞活性以及紧密连接蛋白表达的影响,并探讨ATPS对肠上皮细胞功能损伤的保护作用机制。1 材料与方法
1.1 主要仪器
全自动酶标仪(Molecular Devices公司,美国);荧光共聚焦显微镜(Laica公司,德国);凝胶成像仪(Bio-Rad公司,美国);EPS300 型电泳仪(北京天龙公司,中国);流式细胞仪(Beckman Coulter FC500公司,美国);超净工作台(苏州净化公司,中国);光学倒置显微镜(Olympus公司,日本);细胞培养箱(Sanyo公司,日本);微量取样枪(Eppendorf公司,德国);恒温摇床(北京六一生物科技有限公司,中国);低温高速离心机(安徽中科中佳科学仪器有限公司,中国)。1.2 主要试剂
大鼠肠上皮细胞系IEC-6 购自ATCC 细胞库;ATPS购自合肥诚志生物制药有限公司公司;苦参碱购自北京索莱宝科技有限公司;PERK(ab229912)、p-eIF2α(ab169528)、GRP78(ab108615)、Occludin(ab216327)、ZO-1(ab96587)抗体均购自英国abcam 公司;p-PERK(CST#3179)、CHOP(CST#5554)、Arrb1(CST#12697)抗体均购自德国CST 公司;内参β-actin抗体购自美国SantaCruz公司;MTT 购自美国Sigma 公司;RIPA 裂解液(组织/细胞)、BCA 蛋白浓度测定试剂盒均购自北京索莱宝科技有限公司;Annexin V-FITC/PI 双染细胞凋亡检测试剂盒、DAPI 染色液均购自江苏碧云天生物技术有限公司。1.3 体外肠上皮细胞损伤模型建立方法
根据参考文献的模型建立方法,并在此基础上进行改进,进行LPS处理IEC-6细胞建立体外肠上皮细胞损伤模型,LPS的最佳作用浓度通过此部分结果来选取。具体的实验方法如下:收集对数生长期的细胞,调整细胞浓度为4×10个/ml;将100 μl的细胞悬液接种于96孔板中,待细胞贴壁后,弃去培养基,使用不含血清的培养基配制不同浓度的LPS(0、10、20、40、80、160 μg/ml),分别加入100 μl对应浓度的LPS置各对应孔中,置于37 ℃、5% CO细胞培养箱中处理24 h后,各孔中分别加入10 μl MTT(浓度:5 mg/ml)溶液,置培养箱培养3 h,吸去孔内上清液终止培养,每孔加入150 μl DMSO,温和振荡10 min;通过酶标仪在570 nm波长下测量各孔的吸光度(OD)值。细胞存活率(%)=实验组A孔OD值/对照组A孔OD值×100 %。1.4 光学显微镜观察和MTT法检测ATPS对LPS诱导损伤的IEC-6 肠上皮细胞活性的影响
设置分组:对照组、LPS组、LPS+ATPS组、LPS+Matrine组,收集对数生长期的细胞,调整细胞浓度为4×10个/ml;将100 μl的细胞悬液接种于96孔板中,待细胞贴壁后,弃去培养基,使用不含血清的培养基配制不同浓度的ATPS(30、60、120 μg/ml)分别加入至LPS+ATPS组细胞中,LPS+Matrine组加入不含血清的培养基配制Matrine 100 μg/ml,对照组加入不含血清的培养基,37 ℃孵育3 h后,弃去培养基,LPS、LPS+ATPS、LPS+Matrine组分别加入不含血清的培养基配制的20 μg/ml LPS,37 ℃孵育24 h后,光学显微镜观察拍照记录各组细胞形态学,各孔中分别加入10 μl MTT,按照1.3方法检测细胞活性。1.5 流式细胞术检测ATPS对LPS诱导损伤的IEC-6肠上皮细胞凋亡的影响
按照1.4方法中的分组,收集对数生长期的细胞,调整细胞浓度为3.5×10个/ml;将1 ml的细胞悬液接种于6孔板中,待细胞贴壁后,弃去培养基,按照1.4的加药方法操作,37 ℃孵育24 h后,收集细胞,1 200 r/min离心5 min,弃上清液,用PBS 轻轻重悬细胞并计数。取5×10个细胞,1 200 r/min离心5 min,弃上清液,用195 μl Annexin V-FITC 结合液轻轻重悬细胞,加入5 μl FITC-Annexin V-和10 μl PI染色液轻轻混匀。室温避光孵育15 min,随后置于冰浴中。可以使用铝箔进行避光,立即上机检测。1.6 免疫荧光检测ATPS对LPS诱导损伤的IEC-6肠上皮细胞凋亡的影响
按照1.4方法中的分组,收集对数生长期的细胞,调整细胞浓度为2.5×10个/ml;将1 ml的细胞悬液接种于含有载玻片的6孔板中,待细胞贴壁后,弃去培养基,按照1.4的加药方法操作,37 ℃孵育24 h后,取出载玻片,4%多聚甲醛固定细胞2 min,PBS 洗涤,5 min/(次×3)。加入DAPI 染色液,室温10 min,室温PBS洗净,5 min/(次×3),凉干后用含荧光淬灭剂的封片液封片,荧光共聚焦显微镜下观察。1.7 Western blot检测ATPS对LPS诱导损伤的IEC-6肠上皮细胞紧密连接蛋白、内质网应激蛋白以及肠黏膜损伤重要蛋白Arrb1表达水平的影响
按照1.4方法中的分组、给药方法及1.5中的细胞种植密度操作。收集细胞加入RIPA (含蛋白磷酸酶抑制剂)蛋白裂解液,并按1 ∶100加入PMSF混匀。冰上摇床振荡30 min。4 ℃、15 000 r/min离心20 min后,将上清液转入至新的EP 管中并进行BCA 定量。取所需体积蛋白样本与5×SDS loading buffer以4 ∶1的体积比例混匀,煮沸10 min,冷却后置于-20 ℃冰箱,分装备用。蛋白进行SDS-PAGE电泳、转膜、转移到5%脱脂奶粉-TBST封闭液于室温封闭2 h(磷酸化的蛋白检测用5% BSA-TBST封闭)。PVDF 膜分别加入稀释的PERK、p-PERK、GRP78、CHOP、Occludin、ZO-1、Arrb1、β-actin 一抗,4 ℃过夜;TBST 洗涤后加入相应的二抗,常温摇床孵育1 h后TBST洗涤,显影。
2 结果
2.1 LPS成功诱导IEC-6肠上皮细胞损伤
利用不同浓度(0、10、20、40、80、160 μg/ml)的LPS 作用于肠上皮IEC-6 细胞24 h 后,MTT法检测细胞相对存活率,通过并按照改良寇式法计算IC。结果显示,与0 μg/ml组比较,IEC-6 肠上皮细胞损伤随着LPS浓度的增加呈现浓度依赖性趋势,差异有统计学意义(0 μg/ml组细胞与低浓度20 μg/ml的LPS组比较,F
=1.999 8,P
=0.009 54)。见图1和表1,IC=20 μg/ml。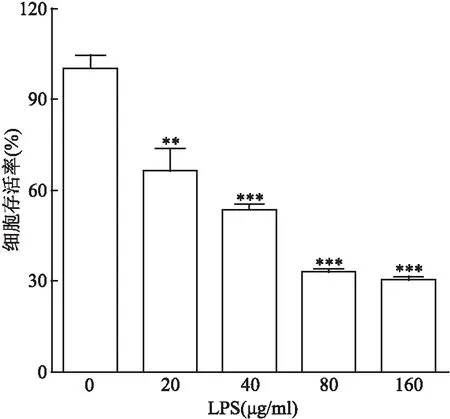
图1 MTT 法检测不同浓度LPS 对IEC-6 肠上皮细胞活性的影响与0 μg/ml组比较:**P<0.01,***P<0.001
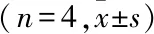
表1 不同浓度LPS对IEC-6肠上皮细胞活性的影响
2.2 ATPS抑制LPS诱导的IEC-6肠上皮细胞的凋亡
为了探索ATPS对LPS 诱导的IEC-6 肠上皮细胞损伤的作用,首先利用MTT 法确定ATPS 在IEC-6 肠上皮细胞中的安全使用浓度,结果显示,与对照组(未加入ATPS)和阳性对照组(苦参碱Matrine)相比,ATPS 在30、60、120 μg/ml 的浓度下对细胞的活性未有明显的影响,差异无统计学意义。见图2A。当ATPS 预先与IEC-6 肠上皮细胞孵育后,再利用LPS 诱导细胞损伤,结果显示与LPS(20 μg/ml)处理组比较,随着ATPS 浓度的增加,显微镜下观察细胞数目增多,MTT 统计结果也表明细胞的活性越明显,差异有统计学意义(20 μg/ml的LPS 组与低浓度20 μg/ml LPS+30 μg/ml ATPS组比较,F
=4.122 1,P
=0.028 975)。见图2B、C和表2。通过免疫荧光(DAPI 染色)、流式细胞术检测(FITC-Annexin V 和PI 双染法)结果显示,ATPS 的保护作用主要是通过阻止LPS 所诱导的肠上皮细胞的凋亡来实现的。见图2D、E。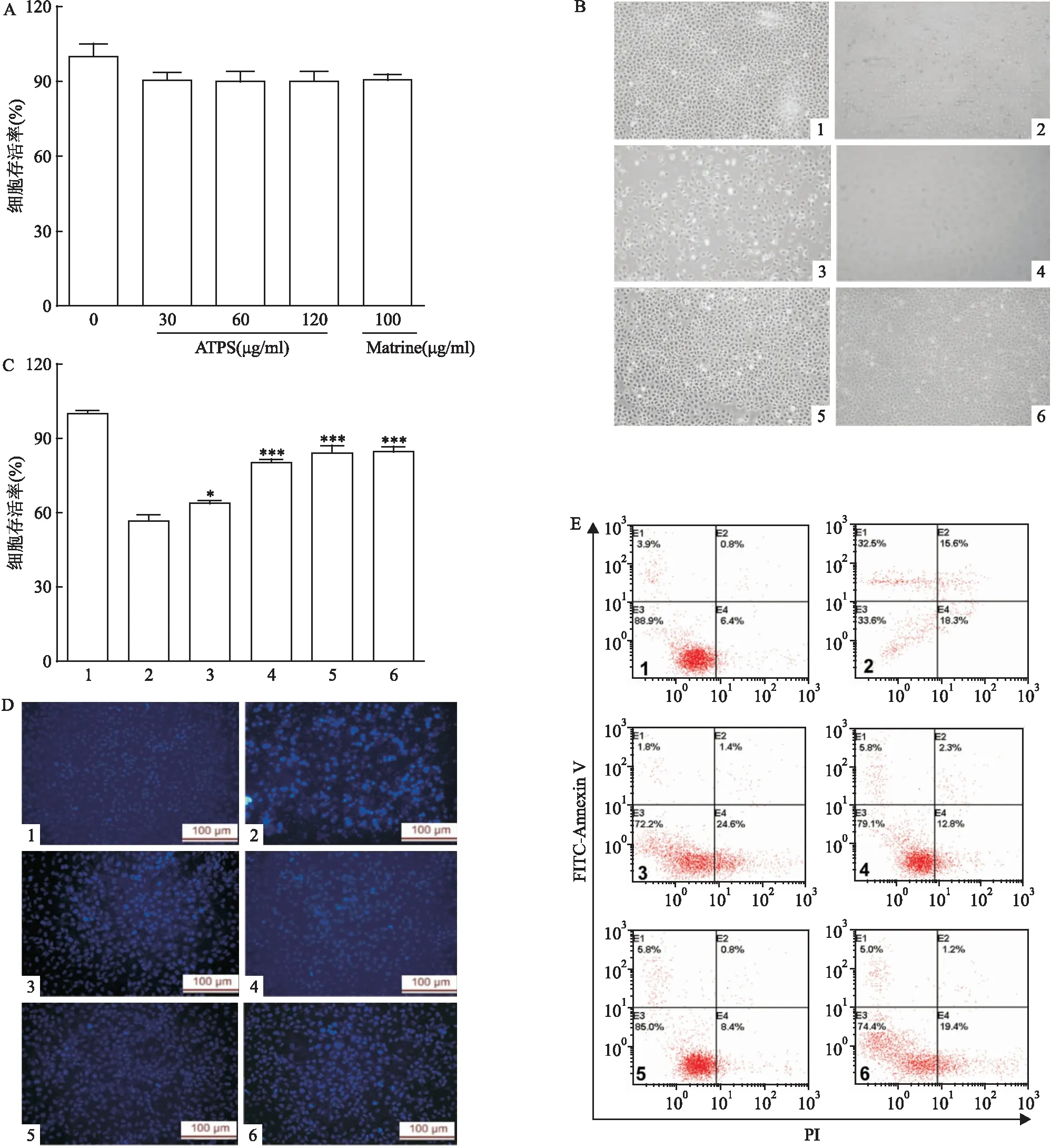
图2 ATPS 对LPS 诱导的损伤IEC-6 肠上皮细胞凋亡的影响A:各组不同浓度ATPS 处理后的IEC-6 细胞(每组n=6个复孔)存活率;B:显微镜下各组IEC-6 细胞数目和形态变化,光学显微镜×10;C:各组IEC-6 细胞(每组n=6个复孔)存活率;D:免疫荧光显微镜各组IEC-6 细胞DAPI染色,免疫荧光图×10;E:各组IEC-6细胞凋亡的流式细胞图;1:对照组;2:20 μg/ml LPS 组;3:20 μg/ml LPS+30 μg/ml ATPS 组;4:20 μg/ml LPS+60 μg/ml ATPS组;5:20 μg/ml LPS+120 μg/ml ATPS 组;6:20 μg/ml LPS+100 μg/ml Matrine组;与LPS(20 μg/ml)组比较:*P<0.05,***P<0.001
表2 不同浓度ATPS 对经LPS 诱导损伤的IEC-6 细胞活性的影响
2.3 ATPS促进LPS诱导的IEC-6肠上皮细胞紧密连接蛋白的表达
紧密连接蛋白及其相关蛋白(膜蛋白ZO-1、跨膜蛋白Occludin)对于维持细胞与细胞之间的黏附性、上皮屏障结构的完整性是必不可少的,实验结果显示LPS在诱导IEC-6肠上皮细胞发生损伤时,ZO-1、Occludin 的表达减少,而ATPS 能够起到逆转的作用,并与ATPS浓度呈正比,差异有统计学意义(针对20 μg/ml的LPS 组与低浓度20 μg/ml LPS+30 μg/ml ATPS 组比较,ZO-1 的蛋白表达,F
=1.014 4,P
=0.000 191;Occludin的蛋白表达,F
=4.435 4,P
=0.000 072 8)。见图3。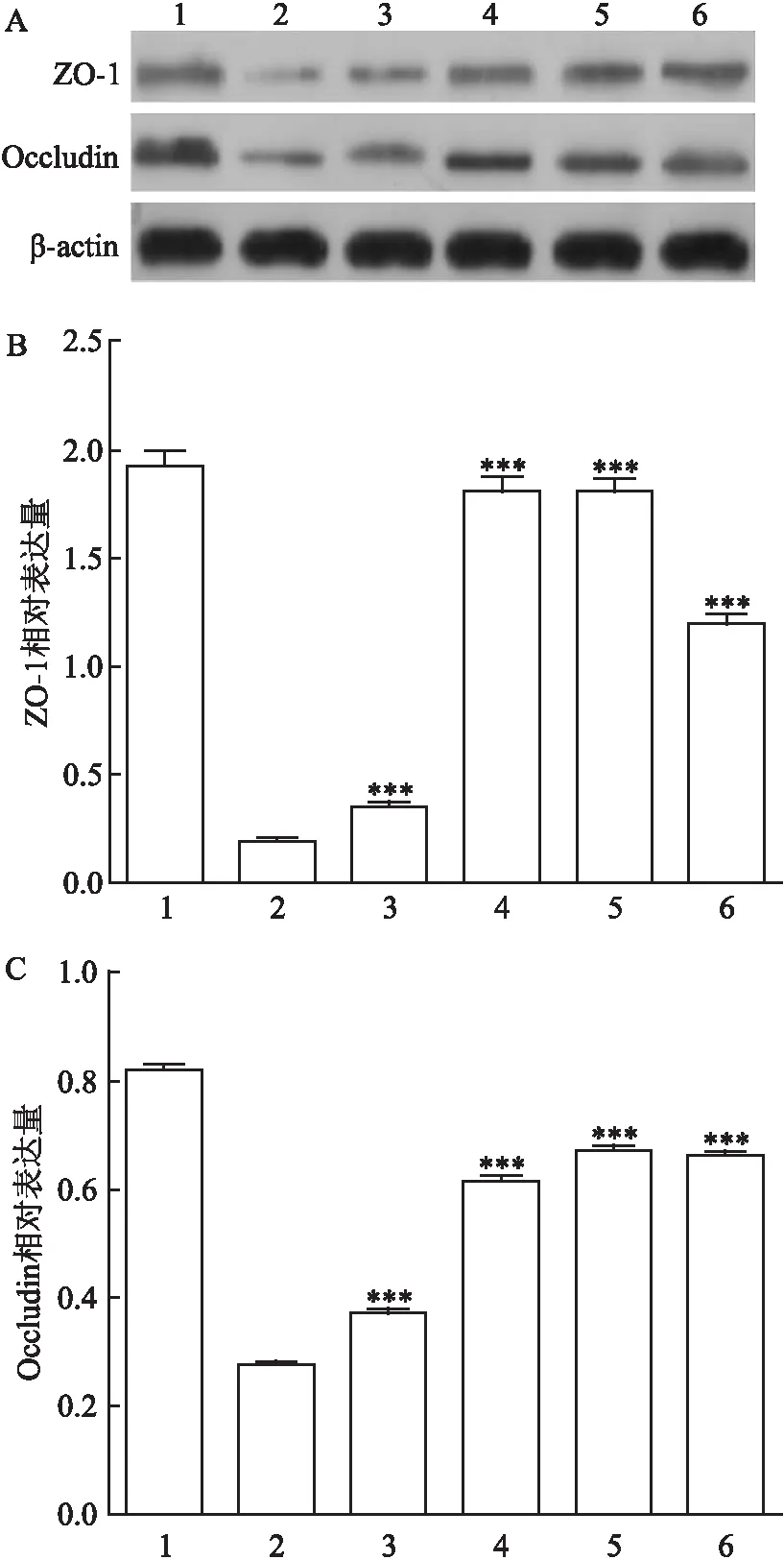
图3 ATPS 对LPS诱导损伤的IEC-6肠上皮细胞紧密连接蛋白的影响A:ZO-1、Occludin蛋白条带图;B:ZO-1蛋白相对表达量;C:Occludin蛋白相对表达量;1:对照组;2:20 μg/ml LPS 组;3:20 μg/ml LPS+30 μg/ml ATPS组;4:20 μg/ml LPS+60 μg/ml ATPS组;5:20 μg/ml LPS+120 μg/ml ATPS组;6:20 μg/ml LPS+100 μg/ml Matrine组;与LPS(20 μg/ml)组比较:***P<0.001
2.4 ATPS调控Arrb1及下游内质网应激途径PERK/eIF2α信号通路的变化抑制LPS介导的细胞凋亡
研究表明具有多种功能如调节细胞的增殖、生存、凋亡及运动功能和基因转录过程的Arrb1 分子(又名β-arrestin 1),在调节肠黏膜损伤过程中发挥重要的作用,可能是介导肠上皮细胞凋亡的重要调控分子。而Arrb1 介导肠上皮细胞增殖的抑制,其机制可能与近年来才发现的一种新的凋亡途径,即内质网应激(epdoplasmic reticulum stress,ERS)介导的细胞凋亡通路密切相关。因此,探究Arrb1 及ERS 凋亡通路的相关蛋白分子在ATPS 保护IEC-6 肠上皮细胞免受LPS 诱导损伤中的变化。Western blot 结果显示,与空白对照组相比,LPS 处理组中Arrb1、ERS 介导的凋亡通路中p-PERK、p-eIF2α、GRP78、CHOP 蛋白的表达升高,当ATPS 预先处理细胞后再经LPS 处理,上述蛋白的表达随着ATPS 浓度的增加而逐渐降低,Matrine 作为阳性对照组。见图4。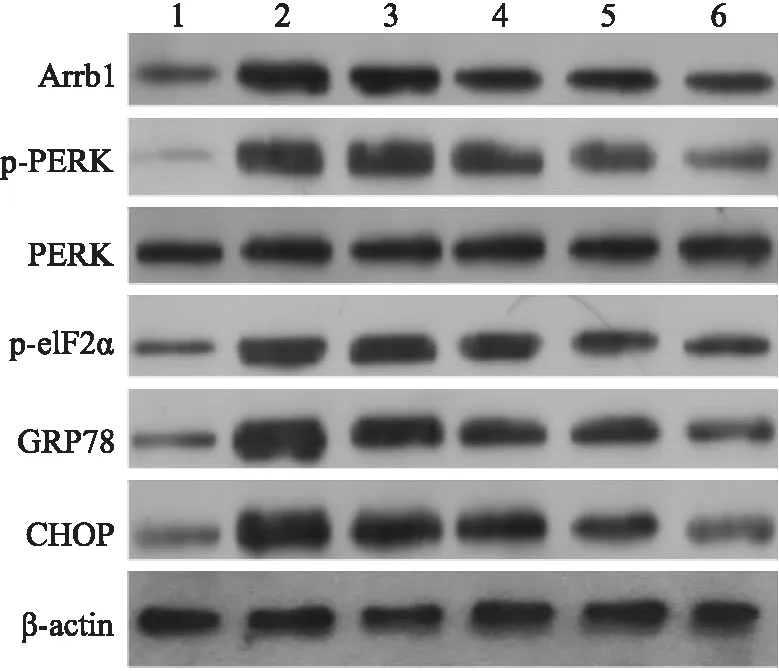
图4 ATPS 对LPS 诱导损伤的IEC-6 肠上皮细胞内质网应激蛋白以及调节肠黏膜损伤蛋白Arrb1 表达水平的影响Arrb1、p-PERK、p-eIF2α、GRP 78、CHOP 蛋白条带图;1:对照组;2:20 μg/ml LPS组;3:20 μg/ml LPS+30 μg/ml ATPS 组;4:20 μg/ml LPS+60 μg/ml ATPS 组;5:20 μg/ml LPS+120 μg/ml ATPS 组;6:20 μg/ml LPS+100 μg/ml Matrine 组
3 讨论
肠黏膜屏障在维持肠内稳态中起重要作用,其中肠黏膜上皮细胞屏障以单层上皮细胞和细胞间的紧密连接为基础,ZO-1、Occludin 是构成细胞间紧密连接的组成部分。当肠道黏膜屏障出现损伤时,会引起肠道的通透性变大,肠道的菌群失去正常比例,甚至会诱发或加重机体全身的炎症反应,使得多个脏器的功能出现障碍,如CIMI,到目前为止,尚且缺乏有效的治疗方案。亮菌作为中国最初发现并拥有自主知识产权的一种真菌,其主要成分ATPS具有抗肿瘤、升白、抗菌等防护作用。本文采用LPS 诱导的IEC-6 肠上皮细胞损伤模型,探讨ATPS 对肠上皮细胞的保护作用及机制。结果显示ATPS 抑制LPS 诱导的IEC-6 肠上皮细胞的凋亡,并呈现剂量依赖效应。此外,LPS 能够诱导肠上皮细胞中Occludin 和ZO-1 表达降低,而ATPS 上调这些蛋白的表达。
Arrb1 分子作为衔接蛋白具有调节细胞的增殖、生存、凋亡、运动和基因转录过程等功能,在调节CIMI 病变过程中发挥了重要的作用,可能是肠上皮细胞凋亡的重要调控分子。本结果显示,LPS 能够促进肠上皮细胞中Arrb1 的表达,而ATPS 能够逆反这种作用,呈现剂量依赖效应。
ERS介导的细胞凋亡是近年来发现的一种新的凋亡途径,多种信号通路、分子伴侣都参与其中。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)和CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding proteinhomologous protein,CHOP)是目前公认的ERS 标志物,在ERS 介导的细胞凋亡中发挥重要作用。蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)/真核生物翻译起始因子2α亚基(eukaryotic translation initiation factor 2 alpha subunit, eIF2α)信号通路是ERS 过程中的重要信号通路之一。文献报道,Arrb1的减少能够保护肠黏膜损伤,其机制可能与维持细胞稳态平衡有关。本结果显示,LPS 能够促进肠上皮细胞p-PERK、p-eIF2α、GRP78、CHOP 蛋白的表达发挥促凋亡作用,而ATPS 以剂量依赖的方式干预LPS 介导的凋亡作用。
综上所述,ATPS 可能是通过上调紧密连接蛋白Occludin 和ZO-1 的表达,减少IEC-6 肠上皮细胞的凋亡,缓解LPS 介导的肠上皮细胞损伤,其机制可能与Arrb1 分子、内质网应激及PERK/eIF2α 信号通路有关。
